乳酸/GPR81信号通路对运动诱导肌细胞甘油三酯堆积的调节作用
2019-04-08孙景权李松波谢敏豪
孙景权,严 翊,李松波,谢敏豪
(1.四川大学 体育学院,四川 成都 610065;2.北京体育大学,北京100084;3.国家体育总局运动医学研究所,北京100061)
长时间耐力训练能够增加骨骼肌细胞中甘油三酯(triglyceride,TG)含量。早在 1969年,研究者就发现训练程度较高的运动员其骨骼肌肌细胞甘油三酯含量(intramyocellular triglyceride,IMTG)也增高(Hoppeler et al.,1985; Morgan et al.,1969)。Goodpaster等(2001)发现,与健康静坐少动的中年瘦人相比,长期耐力锻炼人群肌肉内脂质含量显著增高,同时骨骼肌氧化能力(琥珀酸脱氢酶含量)较高。但是耐力训练增加骨骼肌细胞中 TG含量的机制还不清楚。
乳酸被认为是运动过程中代谢的中间产物,主要被用于糖异生底物和进入三羧酸循环氧化产生 ATP。近年研究发现,乳酸还是机体一个重要信号物质,在细胞中发挥信号分子作用。研究发现,生理浓度范围内(1~20 mM)的乳酸能够明显抑制小鼠及大鼠脂肪细胞以及人体脂肪细胞的脂解作用(Liu et al.,2009)。其中具体机制是乳酸与其受体——G蛋白偶联受体81(G protein-coupled receptors 81,GPR81)结合后,以自分泌形式抑制 Gi-介导腺苷酸环化酶,导致cAMP产量降低,降低cAMP-PKA信号通路,进而表现为抗脂解作用(Ahmed et al.,2010)。在体实验发现,乳酸(30 mM)抑制异丙肾上腺素诱发的小鼠白色脂肪水解,但是这种现象在 GPR81-/-小鼠中未观察到,同时乳酸抑制Forskolin诱发cAMP堆积(Sakurai et al., 2014)。有学者认为,乳酸/GPR81信号轴可能参与运动过程中供能底物的转换。这些结果均提示,乳酸通过结合GPR81降低脂肪组织脂解作用,并且可能参与运动脂肪代谢。那么,运动过程中骨骼肌组织堆积的乳酸是否通过结合其受体GPR81,进而参与运动训练诱导骨骼肌细胞 TG的堆积,目前还不清楚。
在细胞培养实验中,电脉冲刺激(electrical pulse stimulation, EPS)分化成的骨骼肌细胞(肌管)能够替代神经电信号激活骨骼肌纤维(Fujita et al.,2007; Thelen et al.,1997)。目前大部分 EPS诱导细胞收缩模型能够用于研究骨骼肌的一些适应性变化(Nikolic et al.,2012)。机体内,长时间低频率 EPS能够导致快肌糖酵解型肌纤维向慢肌氧化型肌纤维转化(Pette et al.,1992)。Aas等(2002)报道,在高糖和低糖情况下,一次性 EPS可以改善原代培养骨骼肌细胞对葡萄糖的敏感性。
本研究通过观察乳酸/GPR81信号通路是否参与调节EPS诱发 C2C12肌管细胞收缩诱导 TG含量增加,发现乳酸/GPR81信号通路在运动训练诱导骨骼肌细胞 TG堆积中发挥重要作用。
1 研究对象与方法
1.1 细胞培养
小鼠成肌细胞细胞株C2C12,接种于含培养基的100 mm培养皿中,在 37℃、5%CO2恒温培养箱中培养。培养基包含高糖 DMEM(SH30022.01, Hyclone)、10%胎牛血清/FBS(VS500T, 上海威正翔禹生物科技有限公司)、1%青链霉素混合液(KGY0023, 江苏凯基生物技术有限公司)。使用0.25%胰蛋白酶-EDTA消化液(KGY0012, 江苏凯基生物技术有限公司)进行细胞消化。将细胞铺入 6孔板(3335, 康宁公司),当6孔板中细胞融合达到90%~95%时,将C2C12细胞培养基更换为分化培养基(高糖DMEM,2%马血清,1%青链霉素混合液),每24 h更换一次分化培养基。细胞分化4~6天后,分化完成的肌管细胞用于药物处理和EPS处理。
1.2 药物处理
C2C12细胞分化 4~6天后,使用乳酸钠(L7022,Sigma)或者 Sodium 3-hydroxybutyrate/3-OBA(54965,Sigma)处理肌管细胞。另外,在抑制剂实验中,每次 EPS进行前 1 h,采用 3-OBA预处理细胞 1 h。3-OBA作为GPR81受体抑制剂,能够抑制细胞膜上 GPR81受体活性(Shen et al.,2015)。Sodium 3-hydroxybutyrate/ 3-OBA和乳酸钠均溶解在H2O中待用,储存浓度为1 M。
1.3 EPS方案
使用细胞培养刺激系统 C-Pace EP culture pacer(IonOptix)产生 EPS使肌管细胞收缩。此仪器能够发出双极性脉冲到悬挂在培养基中的C-dish碳电极上。EPS方案如下:EPS每天一次,共持续4天。第1天和第2天,电压14 V,单次刺激时长2 ms,频率1 Hz,电刺激总时间2 h;第3天和第4天:电压30 V,单次刺激时长2 ms,频率分别为0.5 Hz和1 Hz,电刺激总时间3 h(表1)。EPS前1 h,每孔更换2 ml新分化培养基。根据以往研究(Burch et al.,2010),在最后一次电刺激3 h后收集细胞提取总RNA;分别在最后一次电刺激后12 h、24 h和36 h收集细胞,使用裂解液后提取蛋白质和进行TG含量测试。
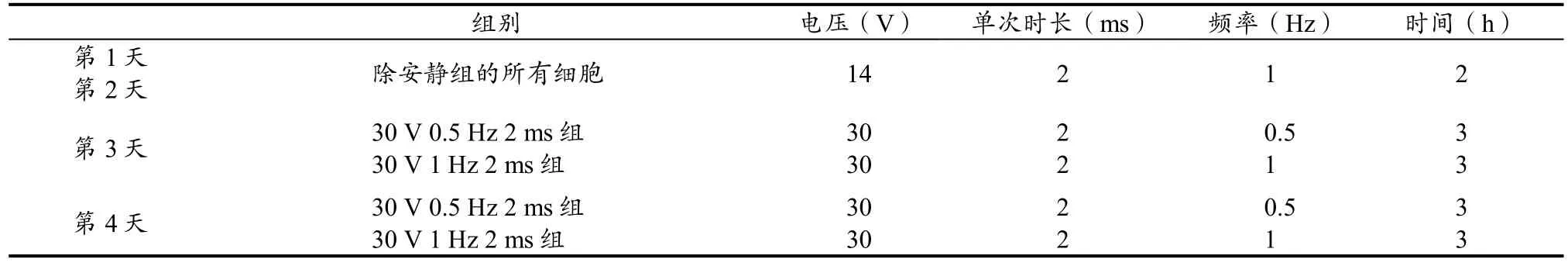
表1 EPS方案Table 1 The Protocol of Electrical Pulse Stimulation
1.4 蛋白质提取及浓度测定
细胞中加入裂解液(110000-L2,北京赛驰生物科技有限公司)充分裂解,4℃离心,12 000 g,15 min,将上清分装至预冷离心管中,-80℃保存备用。总蛋白浓度测定采用BCA蛋白定量分析试剂盒(Prod# 23225, 赛默飞世尔科技有限公司),采用 BSA作为标准液制作标准曲线,测试方法依照说明书进行。
1.5 肌管细胞中TG含量测试
采用组织甘油三酯酶法测定试剂盒(E1003,北京普利莱基因技术有限公司)进行测试,操作步骤严格按照试剂盒说明书进行。样品中相对 TG含量使用细胞总蛋白浓度进行校准。
1.6 肌管细胞中乳酸含量测试
细胞中乳酸含量测定使用乳酸比色法测定试剂盒(K607-100, 艾美捷科技有限公司),测试方法依照说明书进行。样品中相对乳酸含量使用细胞总蛋白浓度进行校准。
1.7 肌管细胞中ATP含量测试
细胞中ATP含量测定使用ATP检测试剂盒(S0026,上海碧云天生物技术有限公司),用 GloMax® 20/20 Luminometer化学发光检测仪(E5311, 美国 Promega-GloMax Promega GloMax)测定RLU值,试剂准备和操作依照说明书进行。相对ATP含量使用样品中总蛋白浓度校准。
1.8 Western blot 检测蛋白表达量
每样品孔加 50~100 µg细胞总蛋白,然后进行 SDS-PAGE电泳,转膜2 h;5%BSA缓冲液(含0.05% Tween-20)封闭1 h;经一抗和二抗孵育后加底物显影液(#34080,赛默飞世尔科技有限公司)进行曝光。蛋白名称及试剂提供公司如下:pCREB-1(Ser 133, sc-101663)和β-actin(C4,sc-47778)购买于Santa Cruz Biotechnology;CREB(ab7540)购买于Abcam。采用ChemiDocTMMP System全能型成像系统(1708280, Bio-Rad)进行蛋白凝胶检测。β-actin作为内参蛋白,Image Lab Software 4.0分析条带灰度值。
1.9 RT-PCR检测mRNA含量
细胞中总 RNA提取采用 TaKaRa MiniBEST Universal RNA Extraction Kit(9767, Takara),操作步骤按照试剂盒说明书进行。
总RNA浓度的测定:使用微量分光光度计(NanoDrop 2000)测定总 RNA浓度,纯度要求:A260/A280比值在1.9~2.0 之间,RNA 浓度= A260×稀释倍数×0.04 μg/μl。根据各个样品RNA浓度将其浓度统一配成100 ng/µl。
逆转录:mRNA(100 ng/µl)使用PrimeScriptTMRT Master Mix(Perfect Real Time)(RR036A, Takara)进行逆转录。
实时定量 RT-PCR:使用 SYBR® Premix Ex TaqTMII(Tli RNaseH Plus)(RR820A, Takara)试剂盒检测MyHCI、MyHCIIa、MyHCIIx、MyHCIIb 和 18S rRNA mRNA含量,并且用核糖体 18S1 RNA作为内参校准基因,引物购自生工生物工程(上海)股份有限公司,序列见表2。定量方法用 2—△△Ct表示基因的表达量,计算公式△△Ct=[Ct(实验组目的基因)-Ct(18S1)]-[Ct(对照组目的基因)-Ct(18S1)]。

表2 引物序列表Table 2 The Sequence of Primer
1.1 0 数据统计方法
数据以平均数±标准误(M±SEM)表示,用SPSS 18.0统计软件进行处理。组间比较采用单因素方差分析(Oneway ANOVA),同时采用双因素方差分析(Univariate法)检测抑制剂和 EPS之间交互作用,显著水平取P<0.05,非常显著水平取P<0.01。作图软件采用GraphPad Prism 5。
2 结果
2.1 乳酸对C2C12肌管细胞中TG含量的影响
不同浓度的乳酸(4、16、32、64 mM)处理C2C12细胞4.5 h后,采用比色法检测TG含量。结果如图1所示,与对照组相比,4、16和64 mM的乳酸处理C2C12细胞,肌管细胞中TG含量均出现显著增加(P<0.05),32 mM乳酸处理细胞后,TG含量出现非常显著增加(P<0.01)。

图1 乳酸对C2C12肌管细胞中TG含量的影响Figure 1. The Effect of Lactate Treatment on TG Contents in C2C12 myotubes注:*P<0.05,**P<0.01。
2.2 乳酸对C2C12肌管细胞中cAMP-PKA信号通路活性的影响
16 mM乳酸处理肌管细胞,采用Western Blot方法检测不同时间点(10 min、20 min和30 min)后细胞中pCREB和 CREB蛋白水平变化。结果如图 2所示,与对照组相比,16 mM乳酸处理C2C12肌管细胞后,细胞中CREB的磷酸化水平非常显著降低(P<0.01),这一作用在处理细胞10 min、20 min和30 min均有表现。数据表明,乳酸在C2C12肌管细胞中同样能够降低 cAMP-PKA信号通路活性。2.3 一次性 EPS对 C2C12肌管细胞中乳酸和 ATP含量的影响
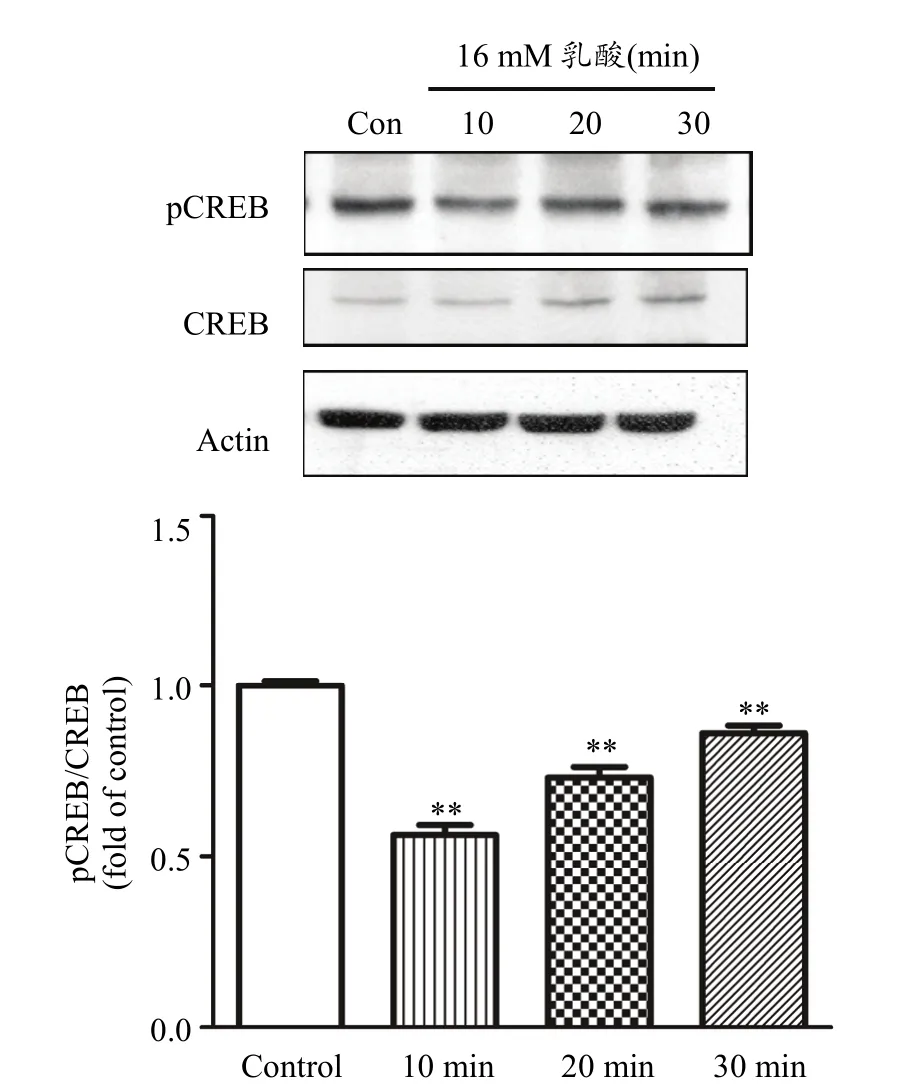
图2 乳酸对C2C12肌管细胞中cAMP-PKA信号通路活性的影响Figure 2. The Effect of Lactate Treatment on cAMP-PKA Signaling Pathway Activities in C2C12 Myotubes注:每组n=6,**P<0.01。
EPS之前和一次性 EPS后即刻收集细胞,采用比色法检测细胞中乳酸含量。结果显示,相对于未刺激组细胞,一次性的电压30 V、频率分别0.5 Hz和1 Hz、单次时长2 ms、共3 h的电刺激,均能够非常显著增加C2C12肌管细胞中乳酸含量(P<0.01,图3)。
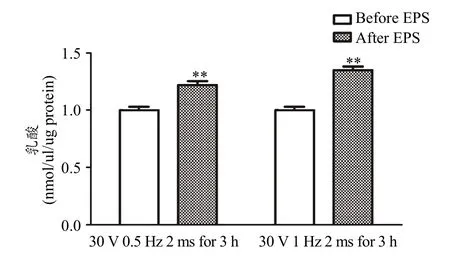
图3 一次性EPS方案对C2C12肌管细胞中乳酸含量的影响Figure 3. The Effect of Acute EPS on the Lactate Contents in C2C12 Myotubes注:每组n=6,**P<0.01。
EPS之前和一次性 EPS后即刻收集细胞,采用化学发光法检测细胞中ATP含量。结果如图4所示,相对于未刺激组细胞,一次性的电压30 V,频率1 Hz,单次时长2 ms,共3 h的 EPS电刺激显著降低电刺激即刻 C2C12肌管细胞中ATP含量(P<0.05)。并且,频率 0.5 Hz的 EPS电刺激能够非常显著降低肌管细胞中ATP含量(P<0.01)。这些数据表明,EPS可使 C2C12肌管细胞出现收缩,并消耗 ATP作为能源供应,同时能够使C2C12肌管细胞中乳酸显著升高。
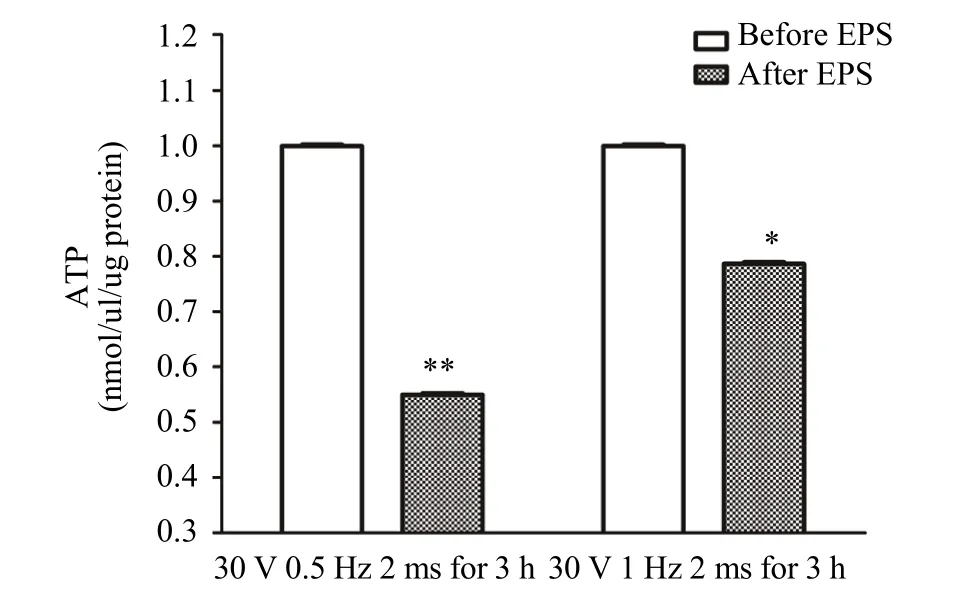
图4 一次性EPS方案对C2C12肌管细胞中ATP含量的影响Figure 4. The Effect of Acute EPS on ATP Levels in C2C12 Myotubes注:每组n=6,*P<0.05,**P<0.01。
2.4 不同EPS方案对C2C12肌管细胞中肌球蛋白重链亚型mRNA含量的影响
分化 4~6天的肌管细胞按照 EPS方案进行电脉冲刺激。将C2C12肌管细胞分为对照组(Control)、30 V 0.5 Hz 2 ms和30 V 1 Hz 2 ms组,最后一次电刺激后3 h收集细胞,提取总RNA。采用RT-PCR方法检测肌球蛋白重链亚型 MyHCI、MyHCIIa、MyHCIIb和 MyHCIIx 的 mRNA 含量。结果如图 5所示,与未电刺激组相比,电压 30 V、频率0.5 Hz和/或1 Hz、单次时长2 ms共3 h的电刺激均能够显著增加氧化型蛋白重链 I型(MyHCI)mRNA含量(P<0.05)和快肌纤维标志性肌球蛋白重链 IIb型(MyHCIIb)mRNA 含量(P<0.05),而对 MyHCIIa和MyHCIIx 的mRNA含量影响不明显。这些结果表明,EPS触发骨骼肌纤维类型的重新装配,电压30 V、频率0.5 Hz和/或1 Hz、单次时长2 ms共3 h的EPS能够显著增加C2C12肌管细胞氧化型和快速收缩型肌纤维含量。
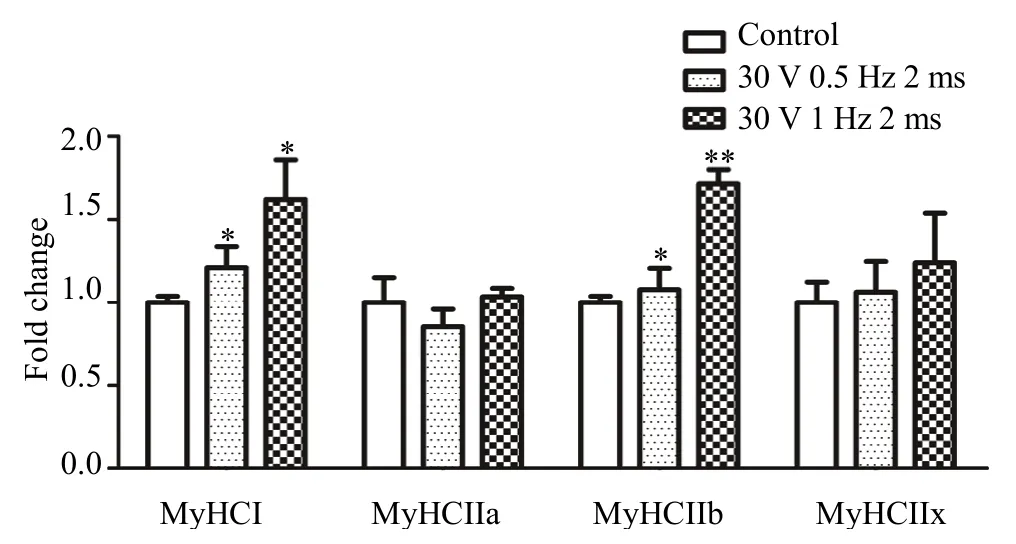
图5 不同EPS方案对C2C12肌管细胞肌球蛋白重链亚型mRNA含量的影响Figure 5. The Effect of Different EPS Protocols on the mRNA Levels of the Myosin Heavy Chain Subtypes in C2C12 Myotubes注:每组n=3,*P<0.05,**P<0.01。
2.5 EPS诱发C2C12肌管细胞中TG堆积模型建立
采用两种 ESP方案刺激肌管细胞,分别在每组电刺激后的12 h、24 h和36 h收集细胞,采用比色法检测细胞中TG含量。结果如图6所示,与未电刺激组相比,电刺激后12 h和24 h两组肌管细胞中TG含量均没有出现变化(P>0.05);而电刺激后36 h,30 V 0.5 Hz 2 ms组细胞中TG含量显著增加(P<0.05),30 V 1 Hz 2 ms组细胞中TG含量非常显著增加(P<0.01)。基于这一结果,我们认为,电压30 V、频率0.5 Hz或/和1 Hz、单次时长2 ms、电刺激后36 h收集细胞的方案能够作为EPS诱发C2C12肌管细胞中TG堆积的模型。
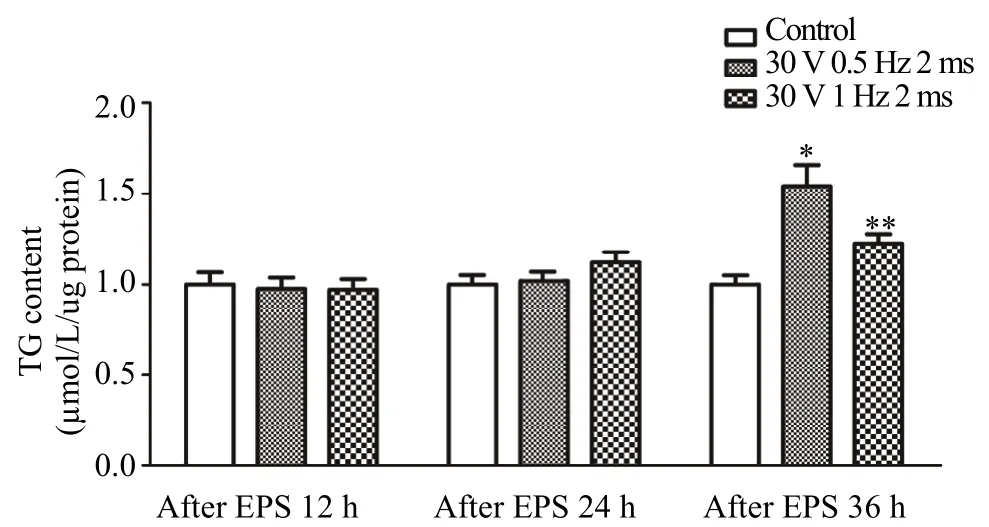
图6 EPS处理后不同时间点C2C12肌管细胞中TG含量的变化Figure 6. The Changes of TG Contents at Different Time Points after EPS Treatment in C2C12 Myotubes注:每组n=6,*P<0.05,**P<0.01。
2.6 乳酸/GPR81信号通路参与调节 EPS诱发 C2C12肌管细胞TG堆积
分化 4~6天的肌管细胞,每天 EPS之前采用 GPR81的抑制剂3-OBA(6 mM)预处理1 h。然后按照EPS方案进行电脉冲刺激。电刺激后36 h收集细胞,采用比色法检测 C2C12肌管细胞中TG含量。结果如图7所示,相对于未刺激组,30 V 0.5 Hz 2 ms的EPS有增加C2C12肌管细胞中TG含量的趋势(P=0.052);30 V 1 Hz 2 ms的EPS能够非常显著增加 C2C12肌管细胞中 TG含量(P<0.01)。与30 V 1 Hz 2 ms 组相比,3-OBA+30 V 1 Hz 2 ms组C2C12肌管细胞中TG含量显著降低(P<0.05)。结果表明,用6 mM 3-OBA抑制C2C12肌管细胞GPR81活性后,30 V 1 Hz 2 ms的EPS诱发TG堆积的能力减弱;在30 V 0.5 Hz 2 ms的EPS方案中TG有下降趋势,但差异不够显著(P>0.05)。另外,采用Univariate法分析3-OBA和EPS对TG含量影响发现,3-OBA这一变量对 TG含量无影响(P>0.05),EPS这一变量对 TG含量有非常显著影响(P<0.01),3-OBA和 EPS之间存在交互作用(P<0.01)。以上结果表明,3-OBA本身对 C2C12肌管细胞 TG含量无影响,EPS能够显著增加C2C12肌管细胞TG含量,当EPS和3-OBA同时作用时出现交互作用,3-OBA能够起到减弱EPS诱发C2C12肌管细胞 TG增加的作用,说明乳酸/GPR81信号通路参与调节EPS诱发C2C12肌管细胞中TG的堆积。
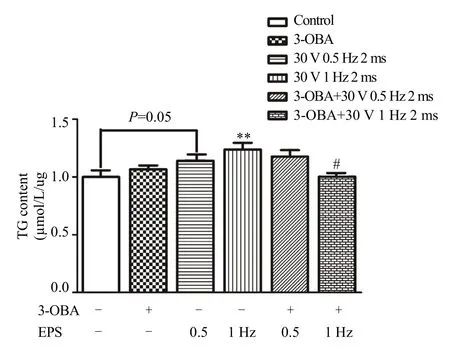
图7 乳酸/GPR81信号通路参与调节EPS诱发C2C12肌管细胞中TG堆积Figure 7. Lactate/GPR81 Signaling Pathway was Involved in the Regulation of TG Accumulation Induced by EPS in C2C12 Myotubes注:每组n=6,与Control比,**P<0.01;与30 V 1 Hz 2 ms组相比,#P<0.05。
3 分析与讨论
骨骼肌细胞中TG是有氧耐力运动过程中骨骼肌细胞的主要能源物质。研究报道,运动训练能够增加骨骼肌细胞中 TG含量和增强线粒体氧化功能,即 ATP产生的能力(Amati et al.,2011; Goodpaster,et al.,2001)。早在1969年,研究者已经发现,训练程度较高且胰岛素敏感性较高的运动员其 IMTG含量也增高(Hoppeler et al.,1985; Morgan et al,1969)。Amati等(2011)也同样发现,相对正常体重静坐少动人群,正常体重耐力运动员(有氧锻炼≥5次/周)骨骼肌肌细胞间脂滴中 TG和DAG显著较高,同时伴随胰岛素敏感性显著增加。同时,研究发现,长期进行耐力运动将导致骨骼肌细胞中TG含量增加和线粒体脂肪酸氧化能力增强。Pruchnic等(2004)发现,12周的中等强度有氧锻炼(≥3次/周,前 4周:50%~60% V̇O2max强度,30 min/ 次;5~8 周:50%~60% V̇O2max强度,40 min/次;9~12 周:70%V̇O2max,40 min/次)显著增加静坐少动老年人骨骼肌肌细胞间TG含量、SDH含量和I型肌纤维数量比例,骨骼肌氧化能力显著增加。但是目前关于运动诱导骨骼肌细胞脂滴堆积和线粒体功能增加的分子机制还不清楚。
运动过程中乳酸大量堆积,从安静状态下 0.5~2 mM到高强度无氧运动后 10~20 mM(Cheetham et al.,1986;Hughson et al.,1987; Kamijo et al.,2000; Ohkuwa et al.,1984)。乳酸作为葡萄糖代谢产物,长期以来被认为是葡萄糖无氧酵解的副产物或是废物,主要被用于作为能源物质进入三羧酸循环产生 ATP或者是在肝脏中糖异生成葡萄糖(Cori et al.,1935; Issekutz et al.,1965; Kamijo et al.,2000; Miller et al.,1964)。近年来,学者们注意到乳酸一个新的角色——分子信号物质(Kuei et al.,2011; Lam et al.,2005),如乳酸通过结合其受体,降低细胞内 cAMP合成(IC50是 29 mM)(Lauritzen et al.,2014,2015)和神经元钙诱发峰值(IC50是4.2 mM)(Bozzo et al.,2013)。本研究采用C2C12肌管细胞模型研究乳酸对骨骼肌细胞 TG含量的影响。结果表明,在细胞培养水平上,生理浓度范围内的乳酸增加了肌管细胞中TG堆积。由此说明,乳酸在调节骨骼肌细胞TG含量方面起着信号分子的作用。
本研究进一步发现,乳酸可能通过激活其受体 GPR81来诱发C2C12肌管细胞中TG堆积。GPR81是一种孤立的G蛋白偶联受体,主要在脂肪组织中表达,分化后的3T3L1脂肪细胞中也高表达,同时在肝脏、肾脏、骨骼肌和棕色脂肪组织中也有少量表达(Liu et al.,2009)。Bjorntorp(1965)发现3 mM和20 mM乳酸浓度能够抑制去甲肾上腺素诱发 SD大鼠附睾周围脂肪垫释放甘油和脂肪酸作用。乳酸被确认是GPR81的内源性配体(Cai et al.,2008; Liu et al,2009)。进一步研究发现,乳酸激活 GPR81的EC50大约是5 mM,而且在生理浓度范围内(1~20 mM)乳酸均能够激活 GPR81(Kuei et al.,2011)。cAMP-PKA信号通路激活会导致脂肪分解和抑制脂肪合成(Hwang et al.,2015)。在脂肪细胞中,乳酸激活 GPR81进而抑制 cAMPPKA信号通路,从而抑制脂解作用和诱导 TG堆积(Ahmed et al.,2010; Cai et al.,2008; Liu et al.,2009; Sakurai et al.,2014)。另有研究发现,乳酸抑制野生型小鼠脂肪细胞脂解作用,而对 GPR81敲除小鼠并未发现类似效果(Liu et al.,2009)。同时,研究也认为,乳酸能够降低白色脂肪组织中脂肪酶活性(Bjorntorp,1965)。这些研究均表明,在生理浓度情况下,乳酸诱导人类、小鼠和大鼠脂肪细胞中TG堆积(Ahmed et al.,2010)。本研究数据表明,乳酸/GPR81信号通路同样在 C2C12肌管细胞中起作用,乳酸可能通过激活GPR81从而抑制cAMP信号通路,进而达到诱导TG堆积效果。
近年来,骨骼肌细胞 EPS模型常被用作在体外进一步探究运动引起骨骼肌适应性变化的分子机制模型(Burch et al.,2010; Fujita et al.,2007; Nedachi et al.,2008,2009; Park et al.,2008; Silveira et al.,2006)。在细胞培养实验中,EPS分化成功的骨骼肌细胞(肌管)能够替代神经电信号激活骨骼肌纤维(Fujita et al.,2007; Thelen et al.,1997)。本研究采用EPS诱发 C2C12肌管细胞收缩,模拟运动诱导的骨骼肌收缩,进一步观察运动代谢产物乳酸及其受体GPR81在运动诱导骨骼肌细胞 TG堆积中的作用。首先本研究采用的EPS方案为:分化 4~6天的肌管细胞,先进行 2天 EPS(电压14 V,单次刺激时长2 ms,频率1 Hz,电刺激总时间 2 h/天),其目的是利用此 EPS方案来加速 C2C12肌管与肌小节的生成(Fujita et al.,2007);第3天和第4天分别进行一次性高电压不同频率刺激(电压:30 V,单次刺激时长2 ms,频率分别为0.5 Hz和1 Hz,电刺激总时间3 h)。本研究结果发现,一次性 EPS方案(电压 30 V、频率 0.5 Hz和1 Hz、脉冲 2 ms、共3 h)能够显著增加EPS后即刻细胞内乳酸含量,同时降低细胞内 ATP含量,这说明本研究采用的EPS能够成功诱发C2C12肌管细胞收缩。另外,运动训练可诱发骨骼肌出现适应性变化,包括相关代谢基因表达变化。研究发现,骨骼肌细胞氧化能力与肌球蛋白重链I和IIa型含量密切相关,这些氧化能力强且耐力高的骨骼肌纤维被称为I和IIa型肌纤维;相反,IIx和 IIb型骨骼肌纤维具有快速收缩特性,肌球蛋白重链亚型IIx和IIb是这一骨骼肌类型的标志物(Pette et al.,2000,2001)。肌球蛋白重链亚型基因表达情况,常被用于区分骨骼肌纤维类型的不同(Spangenburg et al.,2003)。有研究报道,电压30 V、频率1 Hz、脉冲时长2 ms共24 h或者48 h EPS能够显著增加 MyHCI(慢缩氧化型肌纤维标志物)(Nikolic et al.,2012)。本研究数据也显示,电压30 V、频率0.5 Hz/1 Hz、单次时长2 ms共3 h的EPS能够显著增加氧化型肌纤维标志物 MyHCI和快缩型肌纤维标志物MyHCIIb,这说明这一 EPS方案能够显著增加骨骼肌氧化型和快速收缩型肌纤维含量。本研究还发现,EPS方案(电压14 V、频率1 Hz、单次时长2 ms、每天2 h共2天,和电压30 V、频率0.5 Hz/ 1 Hz、单次时长2 ms、每天3 h共2天,电刺激后36 h收集细胞)均能够显著诱发骨骼肌细胞中 TG堆积,表明采用该 EPS方案在细胞水平上模拟运动诱发骨骼肌细胞收缩 TG堆积模型是成功的。因此,此EPS方案可以用于研究乳酸/GPR81信号通路是否参与运动诱导骨骼肌 TG堆积过程,而且它也将是研究长时间耐力训练增加骨骼肌细胞TG含量的机制的成功细胞模型。
在 EPS模型成功建立的基础上,本研究进一步探讨了乳酸/GPR81信号通路在EPS诱发C2C12肌管细胞TG堆积中承担的角色。本研究采用长时间EPS使C2C12肌管细胞收缩诱发 TG堆积。当使用 GPR81的抑制剂 3-OBA抑制C2C12肌管细胞膜上GPR81活性后,EPS诱发TG堆积的效果减弱。研究发现,乳酸/GPR81信号通路通过抑制cAMP产量,降低PKA活性从而抑制脂滴分解作用(Ahmed et al.,2010; Feingold et al.,2011; Langin,2010),即乳酸能够通过其受体GPR81来抑制脂滴分解。另外,Nikooie等(2016)研究发现,高强度间歇运动(high intensity interval training,HIIT)诱发的乳酸堆积参与调节运动后骨骼肌细胞中 TG恢复和增加。基于以上研究,研究认为,乳酸/GPR81信号通路参与调节EPS诱发C2C12肌管细胞TG堆积过程,即乳酸是运动诱发骨骼肌脂滴堆积的分子信号物质。
本研究从运动代谢产物乳酸角度,解释耐力训练导致骨骼肌细胞中 TG含量增加的机制。研究结果将为开展长时间运动锻炼诱导骨骼肌细胞中能源物质 TG堆积的机制研究提供新思路,同时为研究乳酸/GPR81信号通路是否参与调节长时间运动锻炼诱导骨骼肌细胞中能源物质 TG堆积奠定基础。另外,通过研究骨骼肌细胞中是否存在乳酸/GPR81信号通路,以及它对骨骼肌脂肪含量的影响,将可能解释高强度运动中骨骼肌脂肪酸氧化供能比例降低的可能机制,以及为训练负荷评定和运动促进健康研究提供分子机制。然而,我们认识到本研究数据来源于体外细胞培养,由于体外肌管细胞与体内骨骼肌组织整体系统尚存在差异,并且受限于 EPS诱导肌管细胞收缩并不能完全模拟神经支配肌细胞收缩等原因,因此,利用体外实验所得的实验结果并不一定能真实地反映体内骨骼肌组织中 TG堆积的确切机制,尚需更多在体研究数据的进一步支持。
4 研究结论
长时间的 EPS能够诱导肌细胞收缩,增加乳酸和 TG含量。乳酸作为信号分子物质,通过结合其受体GPR81降低C2C12肌管细胞肌细胞中cAMP信号通路活性来抑制脂解,从而促进 TG堆积。乳酸/GPR81信号通路参与调节EPS诱发C2C12肌管细胞收缩诱导TG堆积的过程,可能是骨骼肌细胞收缩诱导能源物质脂滴增加的分子机制之一。
