TNF-α对小鼠骨骼肌成肌细胞生理功能的影响
2015-12-24刘文斌,吴丽姿,肖坚
TNF-α对小鼠骨骼肌成肌细胞生理功能的影响
刘文斌1,吴丽姿2, 肖坚1
(1.武汉轻工大学 医学技术与护理学院,湖北 武汉 430023;2. 佛罗里达大学 医学院,佛罗里达 甘城 FL 32610)
摘要:肿瘤坏死因子(TNF-α)是一种炎症相关的细胞因子。通过基因组PCR对Maml1基因敲除和MAML1转基因小鼠进行了鉴定,通过去除血清和增加TNF-α来检测小鼠骨骼肌成肌细胞的抗饥饿能力。通过分化培养基诱导、TNF或staurosporine处理来研究成肌细胞肌管形成能力。结果表明,TNF-α促进了成肌细胞抗饥饿的能力,促进成肌细胞分化形成更多、更长、更持久的肌管。同样,MAML1基因也能够促进肌管形成。对进一步了解TNF-α对骨骼肌成肌细胞生理功能的影响提供了借鉴。
关键词:肿瘤坏死因子-α;成肌细胞;抗饥饿;细胞分化;肌管
收稿日期:2014-06-11.修回日期:2015-03-23.
作者简介:刘文斌(1970-),男,博士,副教授,楚天学子,E-mail:liuwenbin_1@yeah.net.
文章编号:2095-7386(2015)03-0031-06
DOI:10.3969/j.issn.2095-7386.2015.03.007
中图分类号:Q 2
Effects of TNF-α on murine skeletal muscle myoblasts
LIUWen-bin1,WuLi-zi2,XiaoJian1
( 1. School of Health Science and Nursing,Wuhan Polytechnic University,Wuhan 430023,China;
2. College of Medicine,University of Florida,Gainesville FL 32610,USA)
Abstract:Tumor necrosis factor, TNF, is a kind of cytokine related to inflammation. The genome PCRs were performed to identify the genotypes of Maml1-knock-out and MAML1-transgenic mice. The cellular anti-starvation ability was detected by removing serum and adding TNF-α, and myotube formation ability was detected by exchanging with differentiation medium and adding TNF or staurosporine. The results indicate that TNF-α helps murine skeletal muscle myoblasts the ability of anti-starvation and promotes their differentiation to form more myotubes and keeps them longer and more persistent. MAML1 promotes the differentiation of myoblasts as well. This study helps people to further understand the effects of TNF-α on the physiological functions of myoblasts.
Key words:TNF-α;myoblast;anti-starvation;cell differentiation;myotube
1引言
肿瘤坏死因子-α(Tumor Necrosis Factor α,TNF-α)是一种涉及到系统性炎症的细胞因子,由巨噬细胞分泌,通过与受体的相互作用,调节免疫细胞的增殖与分化,最终杀灭肿瘤细胞及入侵的微生物[1]。
TNF-α与肌肉系统的关系表现在其相关信号通路参与了心衰的发生和进程[2],并影响了气道平滑肌细胞的增殖[3]。TNF-α能够影响骨骼肌细胞中氨基酸的运输及蛋白的含量[4-5]。激活的TNF-α可以诱导NF-κB的产生,并激活心脏成肌细胞的转录因子myocardin/SRF的表达,最终促进了心肌肥厚[6]。长期的TNF-α参与的炎症会引起肌肉组织对胰岛素反应减弱[7]。包括TNF-α在内的细胞因子对骨骼肌成肌细胞的增殖与分化的影响,人们所知不多[8]。
本文中笔者研究了TNF-α对小鼠骨骼肌成肌细胞的增殖和分化的影响。
2材料与方法
2.1细胞培养及其它试剂
野生型(WT)、Maml1基因敲除(KO)和MAML1转基因(TG)的C57BL/6小鼠系购自美国The Jackson Laboratory(Bar Harbor,ME,USA)。TNF-α和马血清购自Sigma公司。Staurosporine购自Santa Cruz公司。 F10培养基和bFGF购自Invitrogen公司。DMEM购自Cellgro公司,而胎牛血清(FBS)、青霉素和链霉素购自HyClone公司。
2.2基因鉴定
剪取0.5 cm的4周龄或新生的野生型(WT)、Maml1基因敲除(KO)或MAML1转基因(TG)小鼠的尾巴,放入含有0.3 mL DNA消化缓冲液(50 mM Tris-HCl,100 mM EDTA,100 mM NaCl和1% SDS,pH 8.0)和2 μL蛋白酶K(20 mg/mL)的Eppendorf管中,用封口膜封住,在50—55 ℃孵育过夜。然后在细胞裂解物中加入1.5 μL RNase H(0.5 mg/mL,不含有DNA酶),上下颠倒离心管5次,高速离心几秒,然后放在37 ℃孵育15—60 min。采用常规的苯酚/氯仿/异戊醇(25∶24∶1)方法提取基因组DNA,测量DNA浓度后使用PCR来鉴定MAML1基因。小鼠Maml1基因的PCR上游引物序列为5’GCCACTCCCGCCACCAAAAAC 3’,下游引物序列为5’TTTCCGACCTCATTCTTTACA 3’。人MAML1基因的PCR上游引物(外显子2)序列为5’CGAGCAGAACTCCCTGTTTC 3’,下游引物(外显子4)序列为5’CCCTGTGAACTGTCCAACCT 3’。基因型PCR循环是1 个循环 (96℃ 1 min,62℃ 1 min,72 ℃ 45 s);加35 个循环 (94 ℃ 50 s,62 ℃ 1 min,72 ℃ 45 s);72 ℃ 延长5 min,终产物放置室温。扩增条带大小为MAML1,415 bp;Maml1,534 bp。
2.3分离和培养新生小鼠骨骼肌成肌细胞
将CO2处理的新生小鼠浸泡在70%的乙醇中,去头,剪取尾巴用于基因型鉴定。再把鼠身放置磷酸缓冲液(PBS)中,取下四肢,将肌肉与皮肤和骨骼分离。冰上将肌肉剪碎,碎片转移进无菌的1.5 mL Eppendorf管中,加入0.5 mL 0.2% collagenase与0.05% dispase混合液,在37 ℃上下颠倒摇动5 min,去上清。组织碎片转入加有2 mL collagenase/dispase 混合液的15 mL离心管中,封口。在37 ℃上下颠倒摇动10—20 min。组织碎片消化成浆糊状,使用微量进样器吸取组织碎片吹打几次,以破碎团块。在37 ℃再次上下颠倒摇动5—10 min。将上清液转移入15 mL管中,加入1 mL血清以终止消化。将组织碎片过滤80 μm尼龙网,再次转移至另一个15 mL管中,1 000 r/min 离心5 min。除去上清,使用2—4 mL F10原代成肌细胞生长培养基(80% F10,19% FBS,1% 青霉素和链霉素,2.5—5.0 ng/mL bFGF)重悬沉淀,将成肌细胞放置于35—60 mm胶原蛋白包被的培养皿中,于37 ℃,5% CO2的培养箱中培养。
2.4饥饿实验及TNF-α处理
将2×105野生型(WT)、Maml1基因敲除(KO)和MAML1转基因(TG)小鼠的骨骼肌成肌细胞接种于胶原蛋白(collagen)包被的6孔板中,其中含10%FBS的F10培养基,培养过夜。待细胞丰度达到80—90%时,除去F10完全培养基,PBS清洗一次,加入无血清的F10培养基,饥饿处理24 h。除去旧的F10培养基,加入含有不同浓度TNF-α(0 ng/mL,20 ng/mL,40 ng/mL),无血清的F10培养基,再培养24 h,PBS洗两次,胰酶消化,用F10培养基重悬细胞,使用血球计数板在显微镜下进行细胞计数。
2.5成肌细胞分化及TNF-α处理
当小鼠成肌细胞生长到80%丰度时,将生长培养基换成分化培养基(95%—98% DMEM,2%—5% 马血清,1% 青霉素和链霉素)。连续2天更换分化培养基持续培养成肌细胞,直至肌管被诱导形成。第三天、第四天、第五天,在分化培养基中添加不同浓度TNF-α(0 ng/mL,1 ng/mL,10 ng/mL,20 ng/mL,40 ng/mL)或100 μM促细胞凋亡试剂staurosporine,继续培养成肌细胞,观察肌管形成情况。
2.6肌管数量及长度计算
当肌管形成时,随机选择5个视野拍照,然后计算每个视野中的平均肌管数量。随机选择5个视野拍照,然后量取每根肌管的平均长度,根据显微镜提供的长度标尺计算肌管的实际平均长度。
2.7统计学分析
使用Student’s t 检验对实验数据进行统计学分析,当P≤ 0.05时认为具有统计学差异。数值表示为平均值 ± 标准方差。
3结果与分析
3.1基因敲除和转基因小鼠中Maml1和MAML1基因的鉴定
如图1所示,Maml1是小鼠本身的内源性基因,在Maml1基因敲除小鼠(KO)的基因组中不能扩增出534 bp Maml1条带,如小鼠2和4;能扩增出534 bp条带的是野生型,如小鼠1和3;-指的是阴性对照,不加任何基因组DNA进行PCR扩增,+指的是阳性对照,加入已知Maml1基因DNA进行PCR扩增。M指DNA分子量Marker。在MAML1转基因小鼠(TG)的基因组中能够扩增出415 bp的条带,如小鼠6、7、8、9、12,野生型小鼠(WT)是不能扩增出415 bp的条带的,如小鼠5、10、11,但是能扩增出534 bp条带,这是内源性的Maml1基因条带;-指的是阴性对照,不加任何基因组DNA进行PCR扩增,+指的是阳性对照,加入已知MAML1基因DNA进行PCR扩增。
3.2TNF-α促进小鼠成肌细胞抗饥饿能力
在小鼠成肌细胞进行饥饿处理(除去或减少胎牛血清供给)2天后,相对于野生型小鼠(WT)而言,Maml1基因敲除(KO)小鼠的成肌细胞存活能力较差,而MAML1转基因(TG)小鼠的成肌细胞存活能力较强,能达到2倍以上,如图2所示。Maml1蛋白(小鼠基因产物)或MAML1(人的同源基因产物)蛋白是一个基因转录共激活因子,它和Notch1或NOTCH1及CSL蛋白形成复合物,在细胞核内启动Notch1或NOTCH1靶基因的转录和表达,如Cyclin A,Cyclin D1,MAPK,Myc,Bcl-XL等基因,这些基因的表达产物参与细胞的生长和增殖。如果将Maml1基因敲除,必然影响这些靶基因的表达,从而抑制了细胞的生长和分裂,导致成肌细胞存活能力较差,而转入MAML1基因则会增强这些基因的表达,从而增强成肌细胞的存活能力。在加入20 ng/mL TNF-α进行处理后,野生型、基因敲除型和转基因型小鼠的抗饥饿能力都增强。但加入40 ng/mL TNF-α处理的成肌细胞的抗饥饿能力不如20 ng/mL TNF-α处理组,说明更高浓度的TNF-α还是对成肌细胞有伤害的,数据具有统计学意义,*表示P≤0.05;**表示P≤0.01。

图2 TNF-α处理的小鼠骨骼肌成肌细胞
3.3TNF-α促进形成更多、更长、更持久的肌管
由于Maml1基因敲除小鼠(KO)的成肌细胞不能分化形成肌管,因此笔者只研究分析野生型(WT)和MAML1转基因型(TG)成肌细胞的分化情况及TNF-α的影响。在诱导分化1天后,成肌细胞开始迁移、融合形成肌管。MAML1转基因型成肌细胞相对于野生型(对照)成肌细胞而言,能够形成更多、更长的肌管,如图3所示。每个视野中,野生型成肌细胞形成的肌管平均数量为11个,平均长度为105 μm;而MAML1转基因型成肌细胞形成的肌管平均数量为17个,平均长度为160 μm,诱导分化2天后,肌管最长可达580 μm。2天后加入不同浓度TNF-α(0 ng/mL,1 ng/mL,10 ng/mL,20 ng/mL,40 ng/mL)或100 μM促细胞凋亡试剂staurosporine,经过1天之后,浓度小于20 ng/mL的TNF可以使得成肌细胞产生肌管,但40 ng/mL的TNF有抑制肌管形成的作用。MAML1转基因型成肌细胞相比野生型成肌细胞,能够形成更多、更长的肌管。加入100 μM staurosporine之后,绝大多数成肌细胞出现凋亡,即使是已经形成的肌管也出现凋亡现象。但MAML1转基因型成肌细胞产生的肌管还有少量残留,如图4。4天以后,添加staurosporine的平皿中,成肌细胞基本上都死亡。对于没有添加staurosporine的平皿,其中的成肌细胞,无论是野生型还是MAML1转基因型,都形成了更多、更长的肌管。1—20 ng/mL的TNF明显有促进肌管形成的作用,而40 ng/mL的TNF-α则没有促进作用,甚至有抑制作用。五天后,野生型和MAML1转基因型成肌细胞形成的肌管均出现凋亡和降解,但1—10 ng/mL的TNF-α则有保护作用,经过TNF-α处理的较长的肌管能够存在更长时间。MAML1转基因型成肌细胞形成的肌管保存得更完好一些。有趣的是在实验中偶然有一次发现,经过1 ng/mL的TNF-α处理过的MAML1转基因型成肌细胞形成的大肌管(长度超过1 000 μm)居然能够搏动,象心肌细胞一样有规律地跳动。
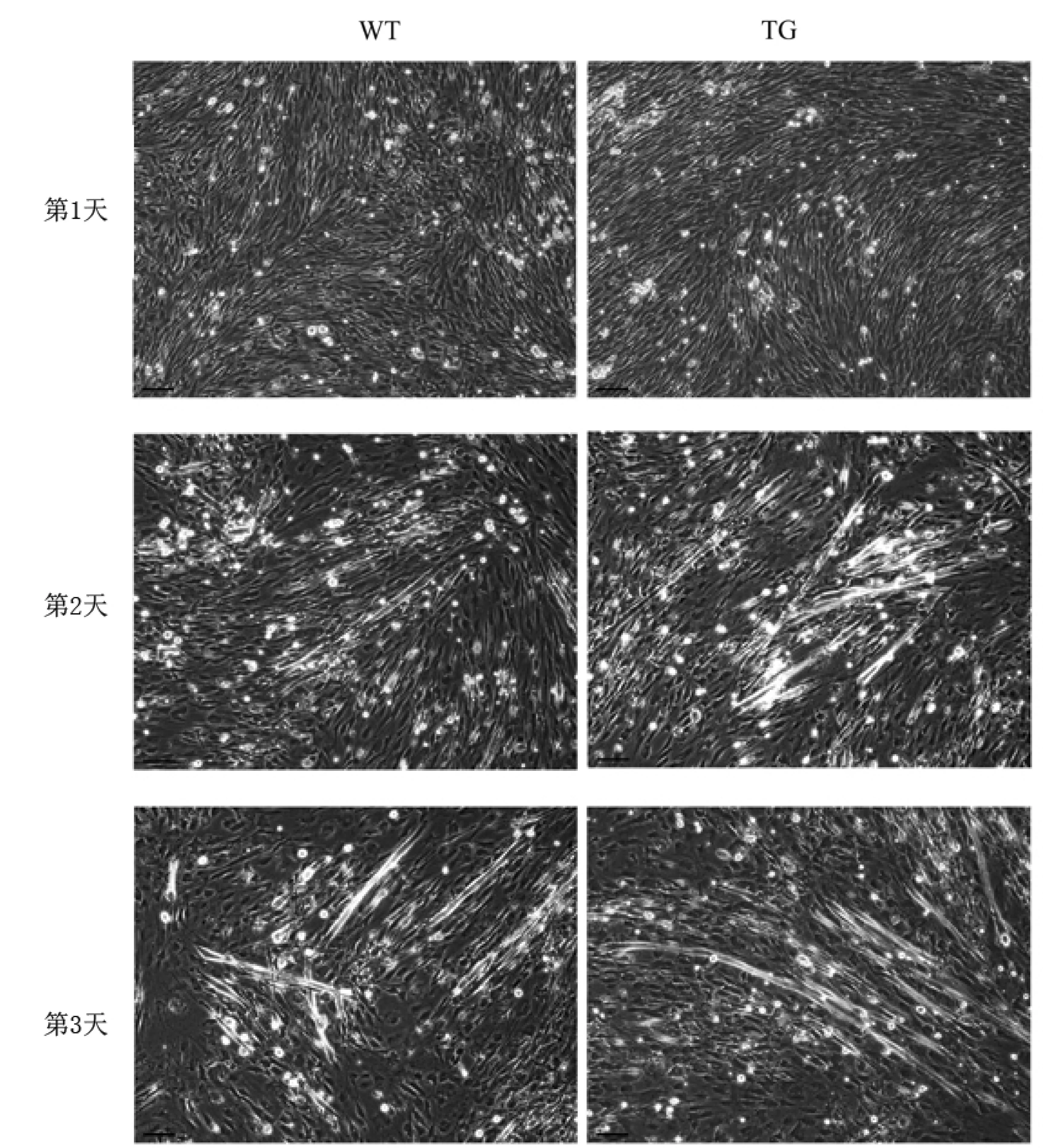
图3 诱导分化2天的小鼠骨骼肌成肌细胞

图4 TNF-α处理诱导分化5天的小鼠骨骼肌成肌细胞
4结论与讨论
人类MAML1基因的mRNA序列有95%和小鼠的Maml1基因同源,其翻译出的蛋白质也是及其相似的,我们尝试为MAML1和Maml1基因设计了逆转录PCR的引物,但扩增之后两者PCR产物的大小和序列是一样的,因此,在野生型和转基因型小鼠中检测MAML1和Maml1基因的mRNA是没有意义的。同时,我们不能使用Western blot检测到MAML1蛋白,因为其表达量非常低或者在转基因小鼠的肌肉中MAML1基因被修饰抑制了,如甲基化,其它基因的转基因小鼠也经常发生这种修饰。
TNF-α在某些情况下可以促进细胞的死亡,但在另一些条件下则促进细胞的增殖和分化,情况较为复杂[9-11]。针对不同的细胞、组织、器官,TNF-α引起的生理效应也是不一样的。在用低浓度TNF-α处理的小鼠骨骼肌成肌细胞,其抗饥饿能力非但没有减弱,反而增强,可能TNF-α通过结合受体,引起一系列信号通路反应,改变了细胞利用营养物质的方法和路径,减少了对细胞因子(胎牛血清提供)和能量的依赖,从而增加了成肌细胞的存活数量。但是高浓度TNF-α仍然是激活细胞凋亡信号通路的,因此,TNF-α对细胞生长、分化和死亡的影响是比较复杂的,需要依据不同细胞,不同实验条件而定。影响细胞这些生理过程的还有Erk1/2,EGFR,Akt等信号通路,彼此之间有着复杂的联系。
促凋亡试剂staurosporine在24 h 内就可以诱导成肌细胞凋亡或肌管降解,而低浓度TNF-α没有诱导成肌细胞或肌管凋亡,却是诱导形成更多、更长和更持久的肌管。低浓度TNF-α可能通过激活NF-κB或mTOR信号通路而促进了肌管的形成和持久。
因此,TNF-α在小鼠肌肉组织的炎症反应和再生中可能发挥重要的作用,其详细的分子、细胞机制还有待进一步研究。
参考文献:
[1]Croft M. The TNF family in T cell differentiation and function - Unanswered questions and future directions [J].Semin Immunol,2014,pii: S1044-5323(14)00018-9.
[2]Kroetsch J T,Bolz S S. The TNF-α/sphingosine-1-phosphate signaling axis drives myogenic responsiveness in heart failure [J]. J Vasc Res,2013,50(3):177-185.
[3]Khan M A. Inflammation signals airway smooth muscle cell proliferation in asthma pathogenesis [J]. Multidiscip Respir Med,2013,8(1):11.
[4]Tayek J A. Effects of tumor necrosis factor alpha on skeletal muscle amino acid metabolism studied in-vivo [J].J Am Coll Nutr,1996,15(2):164-168.
[5]van Hall G. Cytokines: muscle protein and amino acid metabolism [J]. Curr Opin Clin Nutr Metab Care,2012,15(1):85-91.
[6]Madonna R,Geng Y J,Bolli R,et al. Co-activation of nuclear factor-κB and myocardin/serum response factor conveys the hypertrophy signal of high insulin levels in cardiac myoblasts [J].J Biol Chem,2014,pii: jbc.M113.540559.
[7]Lee H,Jee Y,Hong K,et al. MicroRNA-494,upregulated by tumor necrosis factor-α,desensitizes insulin effect in C2C12 muscle cells [J]. PLoS One,2013 8(12):e83471.
[8]Ge Y,Waldemer R J,Nalluri R,et al. RNAi screen reveals potentially novel roles of cytokines in myoblast differentiation [J]. PLoS One,2013,8(7):e68068.
[9]Dong C,Wei K J,Zhang W B,et al. LATS2 induced by TNF-alpha and inhibited cell proliferation and invasion by phosphorylating YAP in oral squamous cell carcinoma [J]. J Oral Pathol Med,2015,doi: 10.1111/jop.12317.
[10]Shinohara H,Teramachi J,Okamura H,et al. Double stranded RNA-dependent protein kinase is necessary for TNF-α-induced osteoclast formation in vitro and in vivo [J]. J Cell Biochem,2015,doi: 10.1002/jcb.25151.
[11]Li L,Wang J,Tang L,et al. Coculture with bone marrow stromal cells protects PC12 neuronal cells from tumor necrosis factorαinduced apoptosis by inhibiting the tumor necrosis factor receptor/caspase signaling pathway [J]. Mol Med Rep,2015,doi: 10.3892/mmr.2015.3421.
