基于网络药理学预测白藜芦醇抗胰腺癌靶点与分子机制研究*
2019-04-03徐宵宵黎荣陈健
徐宵宵 黎荣 陈健,△
(1.桂林医学院基础医学院病理生理学教研室,广西 桂林 541004;2.广西肿瘤免疫与微环境调控重点实验室,桂林医学院,广西 桂林 541004)
胰腺癌是一种快速侵袭性和高度转移性的癌症,对大多数的临床化疗药物已产生了耐药性[1]。因此,开发高效价和低毒性的替代药物是抗胰腺癌的研究新重点。白藜芦醇是一种多酚植物抗毒素,存在于葡萄、浆果、花生和葡萄酒中,具有抗氧化、抗炎、抗凋亡和抗癌等药理活性[2]。白藜芦醇对治疗癌症有良好的疗效,是预防和治疗胰腺癌的潜在候选化合物[3]。实验证明,白藜芦醇血浆滞留时间较长,能更好地发挥药物的治疗效果,安全且耐受良好[4]。真核拓扑异构酶II是白藜芦醇的分子靶点之一,它是染色体分离和DNA超螺旋内环境稳定所必需的酶[5]。
网络药理学是在系统生物学和多向药理学快速发展的基础上提出的药物设计新方法和新策略,它基于“疾病-基因-靶点-药物”相互作用网络的基础,通过分析基因网络库、蛋白网络库、疾病网络库、药物网络库等现有数据库的信息资料,结合从实验中获得的谱图数据,利用专业网络分析软件及算法,系统的、整体的揭示疾病-疾病、疾病表型-靶点蛋白、靶点蛋白-药物、药物-药物之间的联系[6],因而为中药成分-靶点-疾病-机制的研究提供了新的方法。
目前,对白藜芦醇治疗胰腺癌的作用靶点及其分子机制研究较少,为进一步挖掘和整合,本文利用网络药理学方法构建“成分-靶点-疾病-通路”相互作用关系网络,预测白藜芦醇治疗胰腺癌的作用靶点及其可能作用机制,为后续实验提供参考性依据。
1 材料与方法
1.1 实验设计
首先,根据实验设计制定本课题的研究思路流程图,如图1。
1.2 白藜芦醇抗胰腺癌作用靶点的获取
运用Superpred数据库获得白藜芦醇已验证靶点和预测靶点,通过Swiss Target Prediction数据库找到白藜芦醇的预测靶点;应用DisGeNET数据库查找胰腺癌相关作用靶点。最后,将各个数据库白藜芦醇靶点与胰腺癌相关靶点相映射,获得白藜芦醇治疗胰腺癌作用的靶点。利用Uniprot数据库将靶点蛋白名称转换成相对应的基因名称并去除非人源的靶点基因名称,为后期蛋白互作网络(PPI)的拓扑分析做准备。

图1 研究思路设计流程图
1.3 白藜芦醇-靶点-胰腺癌PPI网络构建与拓扑分析
将映射后获得的白藜芦醇抗胰腺癌作用靶点在STRING数据库中获得靶点-靶点功能相关蛋白间的作用,设置置信度得分>0.9的蛋白相互作用,剔除重复项;并将结果导入Cytoscape_v3.2.1构建白藜芦醇-靶点-胰腺癌PPI网络;运用Cytoscape_v3.2.1中Network-Analyzer分析白藜芦醇-靶点-胰腺癌PPI网络中平均自由度和最大自由度等拓扑参数,并根据Degree值筛选核心靶点,筛选范围上限为拓扑数据中的最大Degree值,下限为平均自由度的两倍。
1.4 核心靶点生物功能和通路富集分析
应用DAVID数据库获得核心靶点生物功能和通路富集结果,整理导入Omicshare云平台对白藜芦醇抗胰腺癌核心靶点可能调节的生物过程及涉及的信号通路进行可视化,并根据Pvalue绘制生物过程和信号通路高级气泡图。
2 结果
2.1 靶点信息
本文通过DisGeNET数据库共收集到1868个基因作为本次研究疾病靶点。通过SuperPred webserver数据库检索到白藜芦醇的171个验证靶点,20个预测靶点,并通过Swiss Target Predictio数据库检索到15个res作用靶点。去除掉重复的30个靶点,共有176个白藜芦醇的相关靶点。映射后得到64个交集靶点。
2.2 白藜芦醇抗胰腺癌靶点及功能相关蛋白相互作用网络
应用STRING数据库收集这64个靶点功能相关的蛋白-蛋白相互作用数据,选取置信度得分大于0.9的数据,导入Cytoscape-v3.2.1中,构建白藜芦醇抗胰腺癌靶点及功能相关蛋白相互作用网络,如图2所示,网络有64个节点,由552条边相互作用与关联。
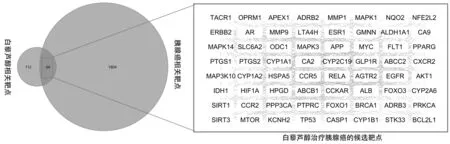
图2 映射后的核心靶点集合
2.3 PPI网络拓扑参数分析及核心靶点筛选
应用Network-Analyzer分析白藜芦醇抗胰腺癌靶点及功能相关蛋白相互作用网络的拓扑参数表,最短路径长度越小,介数值越大说明蛋白越重要。通过计算得自由度的中位数为17.25,最大自由度为45,因此将核心靶点筛选条件范围设为34.5~45,最终获得7个核心靶点蛋白,分别为TP53、EGFR、PTGS2、AKT1、MAPK3、MYC以及ALB,见图3。
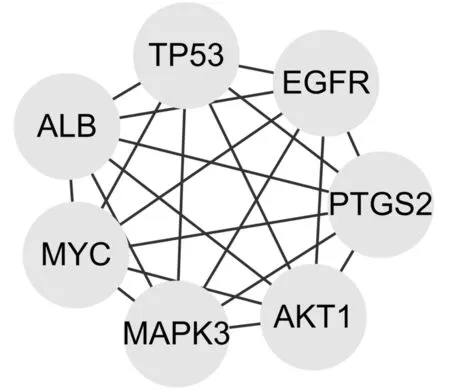
图3 预测后的核心关联靶点
2.4 核心靶点的生物功能和通路富集分析
通过DAVID数据库及omicshare云平台可视化分析,Top 20生物功能富集分析结果如图4所示,结果表明,核心靶点的生物过程主要涉及平滑肌细胞增值正调控、细胞对机械刺激的反应、细胞凋亡过程的负调控、细胞对DNA损伤刺激的反应、血管收缩的正调控、细胞对表皮生长因子刺激的反应、一氧化氮生物合成的正调控、细胞对紫外线的反应、RNA聚合酶II启动子转录的正调控、细胞增殖、细胞对药物反应、磷脂酰肌醇3激酶信号通路的调节、细胞对缺氧的反应、对氧化应激的反应、蛋白磷酸化的正调控、对紫外线的反应、细胞周期蛋白依赖性蛋白丝氨酸的正调控、MAPK信号级联、排卵、细胞凋亡过程的正调控等。这些生物过程多与炎症、DNA损伤修复、氧化应激等的发生发展密不可分,表明白藜芦醇可能是通过调节以上生物过程发挥其抗胰腺癌作用。
通过DAVID数据库及omicshare云平台可视化分析,Top 20信号通路富集分析结果如图4所示。结果表明,核心靶点的KEGG通路主要涉及于宫内膜癌通路、中心碳代谢在癌症中的通路、癌症通路、膀胱癌通路、蛋白聚糖在癌症的通路、非小细胞肺癌通路、结肠直肠癌通路、神经胶质通路、胰腺癌通路、MAPK信号通路、黑素瘤通路、小细胞肺癌通路、ErbB信号通路、前列腺癌通路、P13K-Akt信号通路、甲状腺激素信号通路、丙型肝炎通路、乙型肝炎通路、甲状腺癌通路。
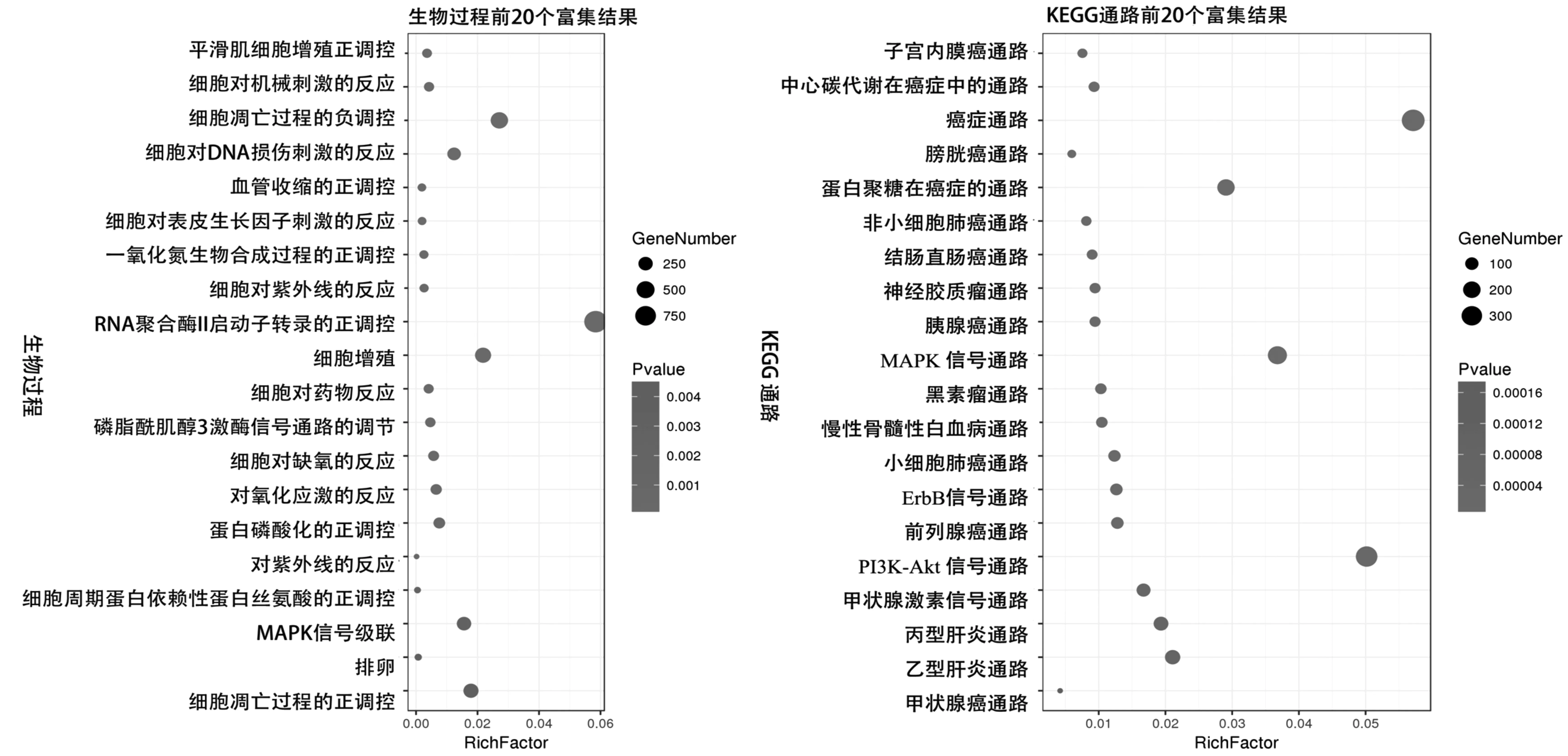
图4 与核心靶点相关的top 20生物学过程和信号通路
3 讨论
胰腺癌是一种起病隐匿的高致死性疾病。大多数胰腺癌患者在病情发展到晚期才出现症状。大多数胰腺癌发生于胰腺导管内微小的非侵袭性上皮增生,即胰腺上皮内瘤变,并且胰腺癌细胞有广泛的代谢重编程,使胰腺癌的治疗难度大幅度增强[7]。研究表明,胰腺癌有四个主要的驱动基因:KRAS、CDKN2A、TP53和SMAD4[8]。白藜芦醇的抗氧化和抗炎作用突出,能够保护胰腺,在糖尿病小鼠试验中作用显著[9]。同时有研究表明,白藜芦醇抑制胰腺癌细胞的增殖[10],诱导细胞凋亡和细胞周期阻滞。借助网络药理学的方法对白藜芦醇抗胰腺癌的作用机制进行探讨,发现其多靶点、多通路作用特点。
为了找到白藜芦醇治疗胰腺癌的关键靶点,本文利用网络药理学挖掘到了176个白藜芦醇作用靶点以及1868个胰腺癌作用靶点,映射后获得64个白藜芦醇治疗胰腺癌作用靶点,然后在STRING数据库获得白藜芦醇治疗胰腺癌作用靶点及功能相关蛋白相互作用,构建PPI网络,经过筛选获得7个核心靶点,分别为TP53、EGFR、PTGS2、AKT1、MAPK3、MYC和ALB。TP53是非常重要的抑癌基因,调节细胞生长和增殖的作用。免疫化学染色显示,TP53突变的胰腺导管腺癌组织中WISP1蛋白水平的上调更为显著[11]。白藜芦醇抗肿瘤的分子机制与抑制表皮生长因子受体(Epidermal growth factor receptor,EGFR)信号有关。蛋白激酶B/AKT有三种亚型AKT1-3,由于其在各种癌症中的本构激活,在调节细胞生长和增殖方面发挥着中心作用,其中AKT1过表达是高血糖触发因素[12]。免疫组化和免疫荧光结果显示,DKK4与MAPK3,VAV3在胰腺癌组织中共表达,推测其与MAPK信号通路激活有关[13]。MYC结合在小鼠肿瘤细胞的神经内分泌基因中富集,促进胰腺导管腺癌导管-神经内分泌谱系的可塑性,导致生存和化疗耐受性差。CRP/Alb比值可能是胰腺癌炎症预后的一个重要且有前途的评分指标[14]。根据文献分析,我们可以推测白藜芦醇通过调节胰腺癌细胞内的预测靶点表达,发挥有效的抗癌作用。同时,这些预测靶点可作为潜在的抗胰腺癌分子标记物。此外,通过靶点蛋白进行GO注释分析和KEGG通路分析,结果显示大多富集生物学信息与癌症通路相关。因此,白藜芦醇抗胰腺癌药理活性可能是直接通过抑制这些癌症相关通路有关。
综上所述,白藜芦醇抗胰腺癌的药理机制可能与调控细胞调控及癌症相关通路密切相关,表明基于网络药理学的技术手段预测药物药效及分子机制具有一定的准确性和实用性,为进一步探讨白藜芦醇抗胰腺癌的药理靶点及分子机制奠定了良好基础。
