基于超高效液相色谱-电喷雾四极杆飞行时间质谱的人血白蛋白未知蛋白分析
2019-04-02郭江红柯兵兵胡远华王文晞姜红
郭江红,柯兵兵,胡远华,王文晞,姜红
(湖北省药品监督检验研究院,武汉 430075)
人血白蛋白是血浆中含量最高的蛋白质,等电点为5.9,相对分子量为69 000,为一级结构较为简单的单链结构蛋白。在血液制剂系列产品中,人血白蛋白是血液制品中的主要产品,属于血容量扩充剂,临床上主要用于失血、烧伤、水肿等低蛋白血症[1]。人血白蛋白是最早从人血浆中提取并大规模生产应用的血液制品[2]。然而,随着白蛋白的临床用量日益上升,不良反应的报道逐渐增多。不良反应除与临床输注技巧及个体差异相关外,主要与白蛋白中存在的聚合物相关。制剂中的聚合物达到一定量时,可促使机体发生免疫应答,产生变态反应;有报道显示人血白蛋白中自身聚合物的产生可能是因为产品中白蛋白的浓度较高,离体条件下容易形成聚合体。另外,人血白蛋白工艺中均采用巴氏消毒法(60 ℃,10 h)灭活病毒,产品中残留的未知杂蛋白对热不稳定,在灭活工艺中易变性与白蛋白形成聚合体。因此探究白蛋白制品中的未知蛋白可为临床不良反应提供参考[3]。人血白蛋白是上市多年的传统产品,学者对该类品种的临床适应症关注较多,对其中的未知蛋白的关注较少,目前笔者尚未见国内外对人血白蛋白进行系统的蛋白质组分的研究报道。本研究通过对聚合体的分离收集,并对其中未知蛋白进行质谱鉴定,建立人血白蛋白未知蛋白谱,结合各个企业的生产工艺参数,为提升人血白蛋白生产工艺提供参考。
1 仪器与试药
1.1主要仪器 AKTA Pure25蛋白纯化仪(美国GE公司);G2 Q-ToF LC/MS 液质联用色谱仪(美国Waters公司);Waters蛋白组学服务器(ProteinLynx Global SERVERTMPLGS);5804R高速冷冻台式离心机(德国eppendorf 公司);Hiprep 16/60 Sepharyl S-200 HR凝胶过滤色谱柱;ACQUITY UPLC BEH130 C18(2.1×100 mmol·L-1,1.7 μm)色谱柱;超滤管(德国Sartorius 公司,截留Mr 10000)。
1.2试药 Trypsin (Sigma公司,批号:SLBG6452V),二硫苏糖醇(DTT,DLAEL-SM,东京化成),碘乙酰胺(IAA,Sigma公司,批号:SLBD7510V),甲酸(Sigma公司,批号:SZBE3390V),乙腈(Merck公司,色谱级,批号:JA045030)。尿素(批号:20160711)、盐酸(批号:20150413)、磷酸二氢钠(批号:20140922)、磷酸氢二钠(批号:20161114)、异丙醇(批号:20160624)均为国药集团化学试剂有限公司产品。15批人血白蛋白样品分别为5家企业生产产品(A企业,批号:20160607,20160709,20160711;B企业,批号:201604010,201605016,201606020;C企业,批号:20160205,20160309,20160410;D企业,批号:20160204,20160307,20160409;E企业,批号:201603004,201604012,201605018)。
2 方法与结果
2.1凝胶色谱层析分离 采用AKTA Pure25蛋白纯化仪,Hiprep16/60SepharylS-200HR凝胶色谱柱;流动相为磷酸二氢钠-磷酸氢二钠溶液(0.5 mol·L-1磷酸二氢钠 200 mL,0.5 mol·L-1磷酸氢二钠 420 mL,异丙醇15.5 mL,纯水914.5 mL,调节pH值6.98),柱温25 ℃,流速0.5 mL·min-1;检测波长 280 nm。供试品溶液浓度25 mg·mL-1,进样量1 mL。在上述的色谱条件下,以5家企业白蛋白制剂作为供试品,供试品溶液色谱图见图1。结果显示在白蛋白主峰前有两个大分子峰,按《中华人民共和国药典》2015年版通则3121人血白蛋白多聚体测定法标准图谱,两个峰分别为多聚体与二聚体。重复进行3次试验,均得到基本相同的色谱图。
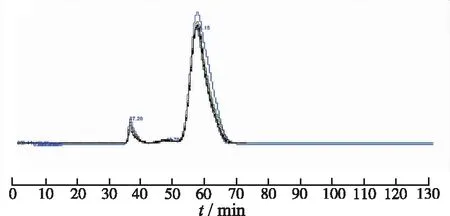
图1 SEC法分离人血白蛋白典型色谱图
Fig.1TypicalchromatogramofhumanserumalbuminseparatedbySECmethod
2.2大分子蛋白组分的收集与浓缩 在上述色谱条件下,分别收集分离峰1和分离峰2的流分,每批样品重复进样2次,置超滤管中,离心5次(4000×g,5 min),以除去样品中残留的盐,最后浓缩至1 mL,于4 ℃保存备用。
2.3胰蛋白酶酶解 量取浓缩除盐后的样品溶液各100 μL,分别加胰蛋白酶酶解溶液300 μL(6 mol·L-1尿素、50 mmol·L-1Tris-HCl(pH值8),5 mmol·L-1DTT),37 ℃水浴1 h,冷却至室温,加入碘乙酰胺至终浓度为15 mmol·L-1,室温避光30 min,加入3倍体积的50 mmol·L-1Tris-HCl,37 ℃孵育过夜,12 000×g离心30 min,取上清液,备用。
2.4UPLC-ESI-Q-TOF分析
2.4.1UPLC色谱条件 色谱柱:ACQUITY UPLC BEH130 C18(2.1×100 mmol·L-1,1.7 μm);流动相:水(含0.1%甲酸)(A),乙腈(B);进样量为2 μL,检测波长为280 nm。梯度洗脱程序见表1。
2.4.2ESI-Q-TOF质谱条件 正离子模式,脱溶剂气流速800 L·h-1,脱溶剂温度400 ℃,源电压2000 V,扫描方式为全扫描二级质谱(full scan),采集模式为MSE,采集范围100~2500 m·z-1。见图2,3。
2.5数据分析 将采集的数据用Protein Lynx Global Server3.0软件进行数据库搜索,从uniprot蛋白数据库中下载Human Plasma,进行搜库鉴定。搜库参数为:
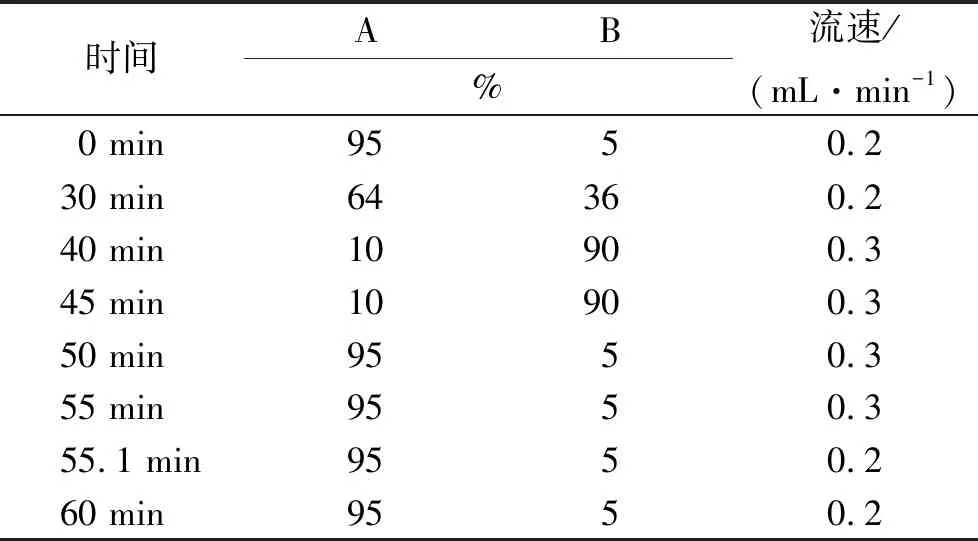
表1 梯度洗脱程序
图2 胰蛋白酶酶切总离子流图
Fig.2Chromatogramoftotalionflowsamplesdigestedwithtrypsin
图3 一级质谱图
人血浆蛋白数据库;蛋白酶:胰蛋白酶;蛋白质相对分子质量范围:10~150 000;漏切位点数为1,可变修饰:氧化(甲硫氨酸)。软件会以打分的形式评判鉴定结果的可信度,为了保证鉴定结果的可靠性,数据分析时优先考虑蛋白质中匹配的肽段个数,随后考虑连续b/y离子以及氨基酸序列的覆盖率,综合分析将鉴定阈值分数设为150。
2.6方法的重复性 取1批样品(C企业,批号:20160309)作为重复性考察的样品,按照上述拟定的方法重复实验。结果显示:3次实验分别鉴定到10,10,8种蛋白,其中共有蛋白有8个,说明该方法重复性良好。
2.7未知蛋白质谱鉴定结果 本研究共收集5家企业各3批次,共15批次人血白蛋白样品,按照拟定的方法鉴定产品中未知蛋白,汇总结果见表2。峰1共鉴定出21种未知蛋白,峰2共鉴定出8种未知蛋白。15批次产品中鉴定出5个共有未知蛋白,分别为血色素结合蛋白、触珠蛋白、载脂蛋白A-II、a-1B 糖蛋白、a-2-HS 糖蛋白。5家企业产品共鉴定出21种未知蛋白,A企业产品未知蛋白种类最少,仅有7种。B企业、C企业与D企业的未知蛋白种类数分别为10种、10种与12种。E企业产品未知蛋白种类最多,有19种(表2)。以人血红素结合蛋白为例,蛋白质多肽EVGTPHGIILDSVDAAFICPGSSR匹配示意图见图4。
3 讨论
目前,国内企业及大部分国外企业均采用低温乙醇沉淀法生产人血白蛋白,其分离血浆蛋白的主要原理是:向蛋白质的水溶液中加入乙醇,从而降低水分子的活动,降低溶液的介电常数,排斥蛋白质周围的水分子,使蛋白分子之间通过极性基团的相互作用在范德华引力下发生凝集,从而沉淀下来[4-5]。影响这种沉淀过程的主要有5大参数:溶液的蛋白浓度、pH值、离子强度、温度与乙醇浓度。通过不同的参数组合,可以将不同的血浆蛋白分离出来。目前国内企业采用基本相同的工艺路线,但各企业具体工艺参数、步骤及控制水平有差异。产品中未知杂蛋白的种类及数量能有效反映工艺的差异,因此,建立产品中未知杂蛋白的检测鉴定方法能够比较不同企业工艺水平与产品的内在质量。笔者主要建立了未知蛋白分离、酶解及质谱鉴定的方法。在研究过程中,对蛋白分离方法与蛋白酶的选择均进行了比较分析。在未知杂蛋白的分离中,最初选择阴离子交换色谱柱进行分离,但分离效果较差,只有白蛋白单一主峰,无法获得白蛋白峰以外的杂蛋白峰。可能因为人血白蛋白生产工艺利用蛋白质的等电点性质进行分离,残留的未知杂蛋白与白蛋白的等电点差异不大,导致阴离子交换色谱柱无法有效分离[6]。对鉴定出21种杂蛋白等电点进行分析,等电点主要集中于pH值5.3~7.3之间,与人血白蛋白等电点(5.9)接近。在酶解过程中比较了胃蛋白酶与胰蛋白酶酶切效果,采用胃蛋白酶进行水解后,在进行质谱检测,其总离子流图结果显示胃蛋白酶未能将蛋白质完全消化为肽段,且质谱鉴定出的未知蛋白种类数较少,可信度不高,重复性较差;胃蛋白酶的酶切位点为苯丙氨酸、色氨酸、酪氨酸等疏水氨基酸,是一种比较温和的蛋白酶,特异性并不明显;而胰蛋白酶的酶切位点为精氨酸、赖氨酸等碱性氨基酸特异性较高,肽图显示其酶解较为完全,质谱鉴定出的未知蛋白可信度较高,且重复性较好,因此最后选择胰蛋白酶进行水解。
《中华人民共和国药典》2015年版中也采用分子排阻法测定人血白蛋白多聚体含量,按照通则3121的标准图谱[7],图1中峰1、2应分别为白蛋白多聚体与二聚体,但质谱鉴定结果显示:峰1与峰2中均鉴定出白蛋白与其他血浆蛋白,且这些血浆蛋白大部分相对分子量分布在11 000~62 000,结果提示可能相对分子质量较小的未知蛋白以及白蛋白通过相互作用,形成分子量较大的聚合物或聚合体。以触珠蛋白为例,在质谱鉴定结果中以其β-链(40 000)的形式显示,然而在生理条件下,触珠蛋白是以四聚体(α1β)2的形式存在于血液中,完整分子量大于白蛋白[8];而且在体内,触珠蛋白与血红蛋白相互作用,参与到血浆游离血红蛋白清除的过程,因此它与血红蛋白有较高的亲和力,两者残留在产品中容易形成分子量较大的复合物或多聚体[9];而且由于人血白蛋白对热比较稳定,生产工艺中均采用巴氏病毒灭活(60 ℃,10 h),这些热不稳定的杂蛋白在灭活工艺时容易变性,捕获白蛋白单体共价形成聚合体[10];因此,《中华人民共和国药典》2015年版人血白蛋白多聚体含量项下所测得多聚体与二聚体不仅是白蛋白聚合体,也包含其他杂蛋白。
笔者通过本研究,初步建立了人血白蛋白中未知蛋白的检测方法,得到不同企业产品中未知蛋白种类,为白蛋白质量控制和评价提供了重要的数据支撑;所鉴定的未知蛋白质种类,能够为临床用药安全提供重要的信息支持。同时,也对蛋白质种类与工艺控制的相关性作了初步的探索,为人血白蛋白工艺的优化提升奠定了基础。
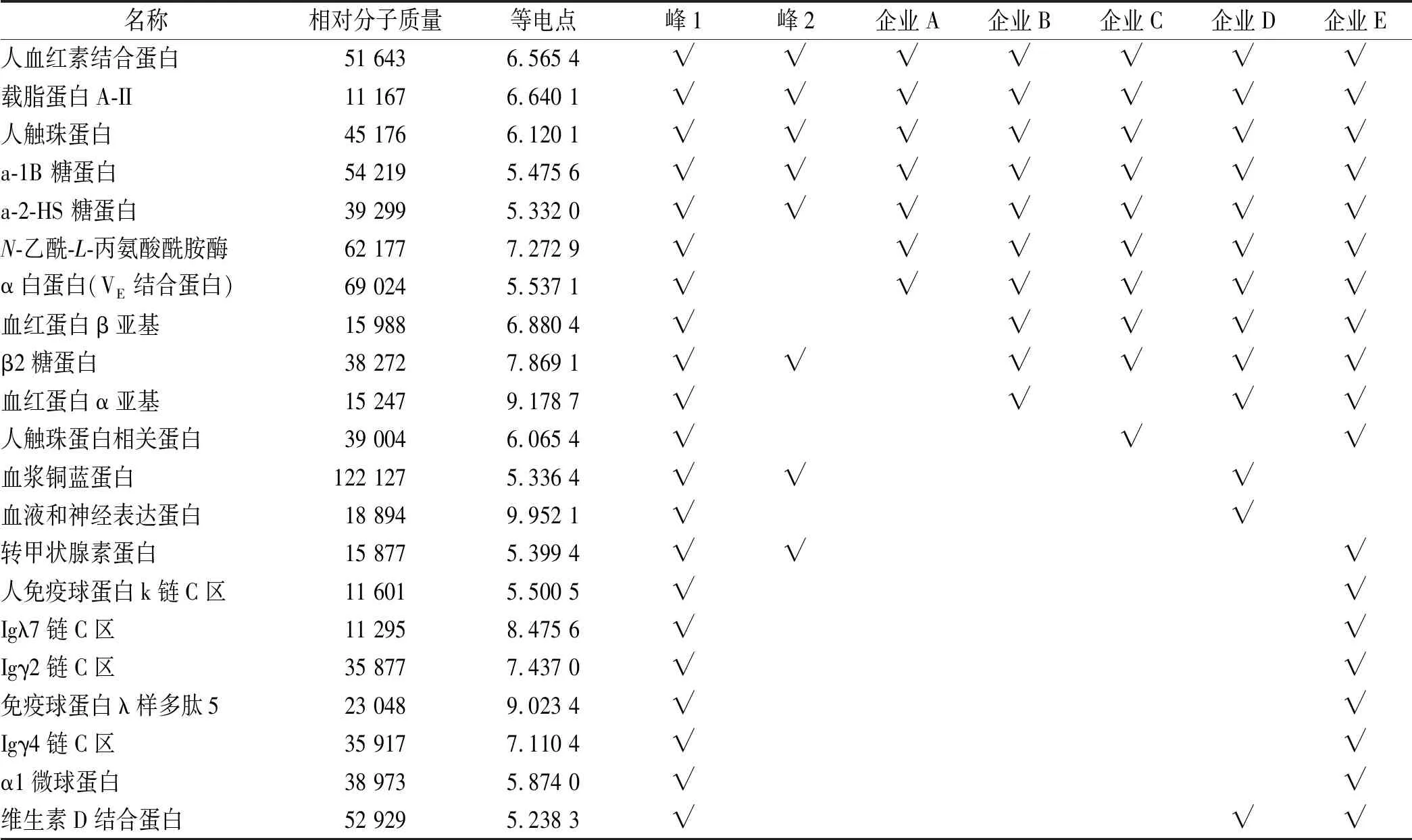
表2 5家企业未知蛋白鉴定结果

图4 人血红素结合蛋白多肽EVGTPHGIILDSVDAAFICPGSSR匹配示意图
