止吐六味散对顺铂引起异食癖模型大鼠多巴胺和多巴胺2受体的影响
2019-04-02陈香梅鲍布日额新红苏日娜
陈香梅,鲍布日额,新红,苏日娜
(内蒙古民族大学蒙医药学院,通辽 028000)
蒙药止吐六味散出自《诊治明医典》,从8世纪至今蒙医临床应用,疗效确切,为蒙医止呕首选良方。方中甘草配以粳米止呕为君药,祛巴达干功能的酸梨干为臣,开胃功能的小茴香和芫荽子,调胃火功能的蔓荆子为佐使而形成治疗诸呕吐病的良方[1]。蒙医临床上用于泛酸,不思饮食,胃肠道疾病,晕车船,妊娠呕吐,食物中毒及巴达干热引起的恶心呕吐的治疗,现今亦用于美尼尔氏综合征引起的恶心呕吐,肝胆病引起的呕吐[2-5],蒙药止吐六味散对术后引起的恶心呕吐疗效与雷莫司琼相当[6];对化疗所致胃肠道毒性反应的治疗效果甚好[7]。因此蒙药止吐六味散具有潜在的进一步开发利用价值。通过前期实验得出,蒙药止吐六味散对顺铂引起异食癖实验大鼠在72 h摄食高岭土的量明显减少;蒙医临床上对顺铂引起的恶心呕吐具有一定的抑制作用。笔者以外周及中枢多巴胺(DA)及其D2受体为切入点,研究蒙药止吐六味散对顺铂引起异食癖大鼠DA合成与代谢、回肠和延髓中D2受体mRNA表达和D2受体蛋白表达的影响,探究止吐六味散治疗化疗药诱发引起的恶心呕吐的作用机制。
1 材料与方法
1.1实验动物 SPF 级 Wistar 雄性大鼠72只,8周龄,体质量200~230 g,购自长春市亿斯实验动物技术有限责任公司,许可证号码:SCXK(吉)-2016-0003。饲养于国家民委-教育部重点实验室(内蒙古民族大学动物室),相对湿度(50%±10%),温度(20±3) ℃,摄食饲料量和饮水量不限。
1.2药品 止吐六味散(由锡盟蒙医研究所提供,内药制字M13040163,批号:20160616)。注射用顺铂(齐鲁制药海南有限公司,规格:20 mg,批号:AA2A7003A);注射用盐酸昂丹司琼(江苏奥赛康药业有限公司,规格:8 mg,批号:B1612012)。
1.3仪器与试剂 Sunrise型多功能酶标仪(帝肯上海贸易有限公司);ABI 7500实时荧光定量PCR仪;Fluor Chem HD2化学发光成像系统(美国Protein Simple公司)。大鼠DA酶联免疫吸附检测法(ELISA)试剂盒(批号:E20170601A),大鼠TH ELISA试剂盒(批号:E20170601A),二羟基苯乙酸(dihydroxy-phenyl acetic acid,DOPAC)ELISA试剂盒(批号:E20170601A),延髓单胺氧化酶B(monoamine oxidase B,MAOB)ELISA试剂盒(批号:E20170601A)均购自上海源叶生物科技有限公司。SuperReal荧光定量预混试剂增强版(SYBR Green,批号:Q5705);Fast King cDNA第一链合成试剂盒(去基因组,批号:Q6019);总RNA提取试剂盒(批号:Q5919)均购自天根生化科技有限公司。D2receptor Antibody(批号:13F10);ECM Kit(兔IgG,批号:12I08A);Anti-GAPDH Antibody(HRP conjugated,批号:BST17003896)均购自博士德生物工程有限公司。
1.4动物分组与观测指标 将72只雄性Wistar大鼠采用随机数字表法分为空白对照组、模型对照组、昂丹司琼组和止吐六味散大、中、小剂量组,每组12只,单笼饲养。参照《中药药理研究方法学(3版)》大鼠化疗性异食癖恶心呕吐模型的造模方法对各治疗组与模型对照组腹腔注射6 mg·kg-1 [8],空白对照组腹腔注射等容积0.9%氯化钠溶剂,复制模型成功率达90%以上。造模前1 h(7:00)、造模后 11 h(19:00)给药。给药量:昂丹司琼组1.3 mg·kg-1,止吐六味散小剂量组0.51 g·kg-1、止吐六味散中剂量组1.02 g·kg-1和止吐六味散大剂量组2.04 g·kg-1,正常对照组和模型对照组给等容积0.9%氯化钠溶液。观察大鼠每天摄入高岭土量的变化作为恶心呕吐的指标。造模72 h后腹腔注射水合氯醛30 mg·kg-1麻醉大鼠,采集回肠和延髓,从腹主动脉取血。采用ELISA 法检测止吐六味散对异食癖大鼠DA合成及代谢的影响;采用实时荧光定量PCR法和Western blotting法检测异食癖大鼠回肠和延髓中D2受体mRNA表达和D2受体蛋白表达的影响。
1.5ELISA法检测DOPAC和DA的含量 运用双抗夹心ELISA检测方法测定血清和延髓、回肠组织中DOPAC,DA的含量变化,回肠和延髓MAOB 及酪氨酸羟化酶(tyrosine hydroxylase,TH)水平。严格按照说明书标明的方法制备相关试剂,在酶标板上设置标准孔和样本孔,标准孔加不同浓度相应标准品50 μL(做复孔),样品孔中加入待测样本(血清、回肠匀浆上清液、延髓匀浆上清液)10 μL,再加样品稀释液40 μL,空白孔不加。除空白孔外其余每孔加100 μL HRP标记的检测抗体,用封板膜封板,37 ℃孵育60 min,弃去液体吸水纸上拍干,重复洗板5次,每孔加入底物A,B各50 μL,37 ℃孵育15 min,每孔加50 μL终止液,波长450 nm处测定各孔吸光度(A值),计算出样品浓度。
1.6SYBR GreenⅠ Real-time PCR法检测回肠和延髓组织中D2受体的mRNA表达水平 按照总RNA提取试剂盒和cDNA第一链合成试剂盒说明书提取总RNA再进行反转录反应。引物序列:D2R上游引物5′-CAGTGAACAGGCGGAGAATGG -3′下游引物5′-GAGAGTGAGCTGGTGGTGACT-3′(扩增片长度131 bp);GAPDH上游引物5′-GCAAGTTCAACGGCACAGTCA-3′下游引物5′-TGG TGGTGAAGACGCCAGTAG -3′(扩增片长度153 bp)由赛默飞世尔科技有限公司合成。扩增条件:95 ℃预变性 10 min,95 ℃变性 15 s,60 ℃复性和延伸50 s,40个循环。按照得到溶解曲线和扩增曲线进行结果分析,以GAPDH为内参相对定量D2受体的mRNA表达水平。
1.7Western blotting法检测大鼠回肠和延髓组织中D2受体的表达 将组织称量后切成几个较小的组织块放入匀浆器中与预先配好的PMSF(最终浓度为1 mmol·L-1)按组织净重(g):裂解液(mL)=1:10进行匀浆,冰上孵育1~3 h充分裂解得组织蛋白。按照BCA蛋白定量试剂盒说明书具体步骤操作定量。样品与SDS-PAGE蛋白上样缓冲液(×2) 按1:1比例混匀100 ℃水浴加热变性5 min,上40 μg蛋白样品经10%SDS-PAGE分离转至PVDF膜上按所需蛋白分子量剪开,10%脱脂奶粉(TBST含0.1%聚山梨酯20)封闭2 h,加入5HT3A多克隆抗体(按1:350稀释)及兔抗鼠GAPDH(HRP conjugated)单克隆抗体(按1:370稀释)室温孵育2 h(摇床),TBST(含0.1%聚山梨酯20)洗涤3次每次10 min,加入二抗兔IgG(按1:6000稀释)室温孵育1 h(摇床),TBST(含0.1%吐温20)洗涤3次每次10 min,ECM 显色剂按1 mL双蒸水,加显色剂A,B 各50 μL混匀配制显色拍照。

2 结果
2.16组大鼠高岭土摄入量变化比较 适应性饲养1周后开始造模,造模前 72 h每组大鼠每天摄食的高岭土量差异无统计学意义(P>0.05);造模后与空白对照组比较,大鼠每天摄食高岭土的量均明显增多,说明造模成功。24 h后大鼠摄食高岭土量的变化最为明显,模型对照组与空白对照组比较,差异有统计学意义(P<0.01),造模后 48,72 h模型对照组大鼠摄食高岭土量摄入有所减少,但仍多于空白对照组。昂丹司琼组、止吐六味散大、中、小剂量组大鼠高岭土摄入量与模型对照组比较差异有统计学意义(P<0.05或P<0.01)。见表1。
2.26组大鼠DA合成和代谢的比较 造模后72 h模型对照组与空白对照组比较,大鼠血清、延髓和回肠DA含量明显升高,差异有统计学意义(P<0.01);给止吐六味散72 h后,止吐六味散小剂量组血清、回肠和延髓DA含量比模型对照组明显降低(P<0.01),止吐六味散中剂量组、大剂量组血清、回肠和延髓DA含量均显著降低(P<0.01)。昂丹司琼组与模型对照组比较大鼠血清、回肠及延髓DA含量差异无统计学意义(P>0.05)。造模后72 h后,模型对照组与空白对照组比较,大鼠血清、回肠和延髓DOPAC含量明显升高。模型对照组与止吐六味散小剂量组、中剂量组、大剂量组比较,大鼠血清、回肠和延髓DOPAC含量明显降低(P<0.01)。昂丹司琼组与模型对照组比较,大鼠血清、回肠及延髓DOPAC含量有所降低,但差异无统计学意义(P>0.05)。造模后72 h,模型对照组与空白对照组比较大鼠回肠和延髓 TH 水平明显升高,差异有统计学意义(P<0.01);止吐六味散大、中、小剂量组与模型对照组比较,大鼠回肠和延髓TH水平明显降低(P<0.01)。昂丹司琼组与模型对照组比较,大鼠回肠及延髓TH水平差异无统计学意义(P>0.05)。造模后72 h,模型对照组与空白对照组比较大鼠回肠和延髓MAOB水平显著上调(P<0.01);与止吐六味散大、中、小剂量组比较,大鼠回肠和延髓MAOB水平比模型对照组明显升高(P<0.05,P<0.01)。而昂丹司琼组,大鼠回肠及延髓MAOB水平与模型对照组比较差异无统计学意义(P>0.05)。见表2,3。
2.36组大鼠回肠和延髓组织D2受体mRNA表达水平的比较 造模后72 h模型对照组与空白对照组比较,大鼠延髓和回肠D2受体mRNA表达水平显著上调,差异有统计学意义(P<0.01);给止吐六味散治疗72 h后,与模型对照组比较,止吐六味散小剂量组回肠和延髓肠D2受体mRNA表达水平比模型对照组显著下调(P<0.05或P<0.01),止吐六味散中剂量组、大剂量组回肠和延髓肠D2受体mRNA表达水平均显著下调(P<0.01)。昂丹司琼组与模型对照组比较,大鼠回肠及延髓肠D2受体mRNA表达水平有所降低,但差异无统计学意义(P>0.05)。见表4。
2.46组大鼠回肠和延髓组织D2受体蛋白表达的比较 造模后72 h后,模型对照组与空白对照组比较,大鼠延髓和回肠D2受体蛋白表达水平显著上调,差异有统计学意义(P<0.01)。止吐六味散组72 h后,与模型对照组比较,止吐六味散小剂量组回肠和延髓D2受体蛋白表达水平比模型对照组显著下调(P<0.05或P<0.01),止吐六味散中剂量组、大剂量组回肠和延髓D2受体蛋白表达水平均显著下调(P<0.01)。昂丹司琼组与模型对照组比较,大鼠回肠及延髓D2受体蛋白表达水平明显下调,差异有统计学意义(P<0.01)。见表5。
表16组大鼠高岭土摄入量比较


组别造模前72 h造模前48 h造模前24 h造模成功时造模后24 h造模后48 h造模后72 h空白对照组0.38±0.120.25±0.070.22±0.050.25±0.080.38±0.140.25±0.090.38±0.15模型对照组0.39±0.130.27±0.070.25±0.060.18±0.072.89±0.951.91±0.391.64±0.10昂丹司琼组0.44±0.070.19±0.060.19±0.050.25±0.031.86±0.38∗11.41±0.45∗10.91±0.27∗1止吐六味散 小剂量组0.42±0.100.28±0.050.22±0.040.28±0.042.11±0.22∗21.61±0.37∗11.02±0.15∗1 中剂量组0.41±0.050.28±0.070.19±0.050.31±0.071.60±0.32∗11.20±0.43∗10.92±0.30∗1 大剂量组0.42±0.060.19±0.070.23±0.050.22±0.071.24±0.39∗10.96±0.09∗10.41±0.10∗1
与模型对照组比较,*1P<0.05,*2P<0.01
Compared with model control group,*1P<0.05,*2P<0.01
表26组大鼠血清、延髓和回肠DA和DOPAC含量比较

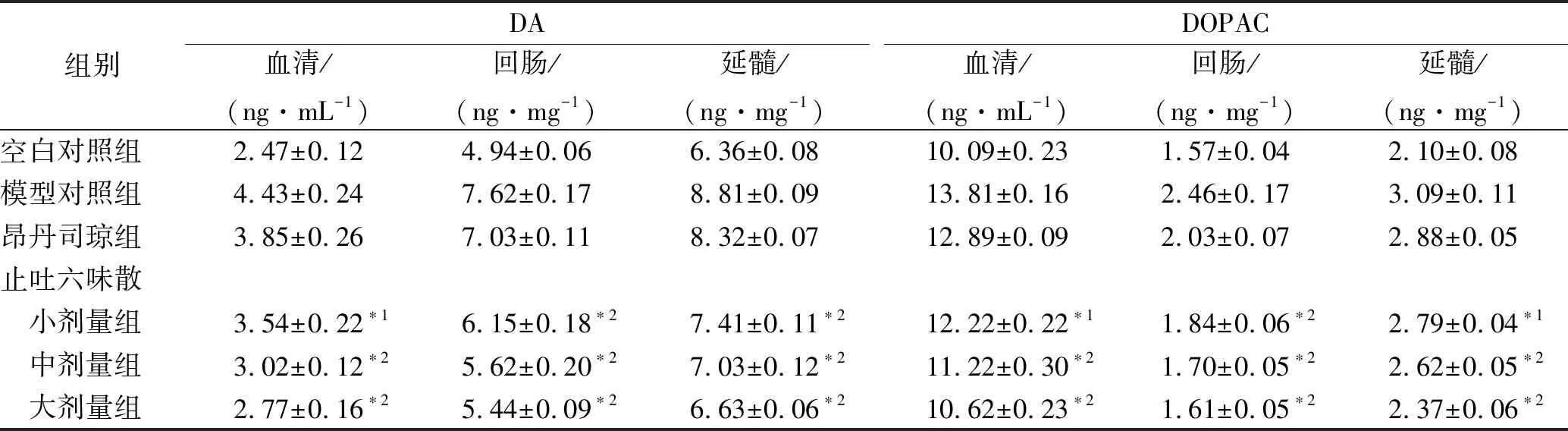
组别DA血清/(ng·mL-1)回肠/(ng·mg-1)延髓/(ng·mg-1)DOPAC血清/(ng·mL-1)回肠/(ng·mg-1)延髓/(ng·mg-1)空白对照组2.47±0.124.94±0.066.36±0.0810.09±0.231.57±0.042.10±0.08模型对照组4.43±0.247.62±0.178.81±0.0913.81±0.162.46±0.173.09±0.11昂丹司琼组3.85±0.267.03±0.118.32±0.0712.89±0.092.03±0.072.88±0.05止吐六味散 小剂量组3.54±0.22∗16.15±0.18∗27.41±0.11∗212.22±0.22∗11.84±0.06∗22.79±0.04∗1 中剂量组3.02±0.12∗25.62±0.20∗27.03±0.12∗211.22±0.30∗21.70±0.05∗22.62±0.05∗2 大剂量组2.77±0.16∗25.44±0.09∗26.63±0.06∗210.62±0.23∗21.61±0.05∗22.37±0.06∗2
与模型对照组比较,*1P<0.05,*2P<0.01
Compared with model control group,*1P<0.05,*2P<0.01
表36组大鼠回肠和延髓TH和MAOB水平比较
Tab.3ComparisonofthelevelsofTHandMAOBinileumsandmedullaoblongatasamongsixgroupsofrats

组别TH回肠延髓MAOB回肠延髓空白对照组40.05±0.79172.64±7.048.02±0.3360.90±1.66模型对照组67.54±3.92266.95±6.075.07±0.4347.00±1.13昂丹司琼组61.89±1.11246.55±7.135.62±0.5149.46±0.68止吐六味散 小剂量组52.43±1.65∗1227.19±8.69∗16.63±0.31∗153.24±1.46∗1 中剂量组49.78±2.10∗1204.46±5.96∗17.10±0.15∗156.09±0.84∗1 大剂量组45.68±1.21∗1182.42±4.63∗17.73±0.31∗159.86±1.05∗1
与模型对照组比较,*1P<0.01
Compared with model control group,*1P<0.01
表46组大鼠回肠和延髓组织D2受体mRNA表达水平的比较
Tab.4ComparisonofthemRNAlevelsofD2Rinileumsandmedullaoblongatasamongsixgroupsofrats

组别回肠延髓空白对照组0.89±0.190.84±0.04模型对照组2.74±0.222.55±0.17昂丹司琼组2.32±0.112.15±0.13止吐六味散 小剂量组1.90±0.25∗11.69±0.09∗1 中剂量组1.68±0.10∗21.46±0.16∗2 大剂量组1.28±0.21∗21.02±0.33∗2
与模型对照组比较,*1P<0.05,*2P<0.01
Compared with model control group,*1P<0.05,*2P<0.01
表56组大鼠回肠和延髓组织D2受体蛋白表达的比较
Tab.5ComparisonofD2Rproteinexpressioninileumsandmedullaoblongatasamongsixgroupsofrats
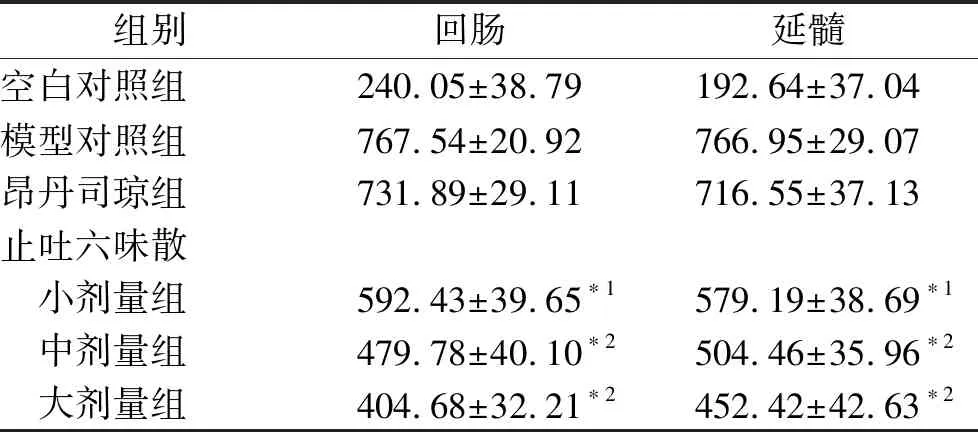
组别回肠延髓空白对照组240.05±38.79192.64±37.04模型对照组767.54±20.92766.95±29.07昂丹司琼组731.89±29.11716.55±37.13止吐六味散 小剂量组592.43±39.65∗1579.19±38.69∗1 中剂量组479.78±40.10∗2504.46±35.96∗2 大剂量组404.68±32.21∗2452.42±42.63∗2
与模型对照组比较,*1P<0.05,*2P<0.01
Compared with model control group,*1P<0.05,*2P<0.01
3 讨论
大鼠异食癖模型在国内已经开始广泛用于化疗性呕吐的相关研究[9-17]。大鼠脑内存在与呕吐相关的神经通路,大鼠异食癖行为可以作为呕吐模型,大鼠摄食高岭土量可以作为恶心呕吐程度的观测指标[18-22]。在呕吐的发生过程中DA为传统的神经递质,在呕吐发生机制研究中常把DA及其相应受体作为呕吐研究的传统靶点[23]。影响DA合成与代谢的因素有很多,其中起到关键作用的因素为TH和MAOB。TH为DA合成的限速酶,MAOB为主要代谢酶,神经元内的DA 主要由 MAOB 转化为DOPAC,TH水平升高或降低和MAOB水平上下调节与DA的合成和降解紧密相关[24]。由于昂丹司琼有效率高于雷莫司琼且成本低[25],故在实验中选用了昂丹司琼作为阳性对照药。
实验结果表明,顺铂造模后72 h大鼠血清、脑延髓和回肠DA含量明显升高,止吐六味散治疗后能够显著降低其含量,说明止吐六味散能够抑制顺铂引起异食癖大鼠DA的合成。DOPAC含量显著升高表明,TH水平降低和MAOB的升高可证实止吐六味散能够减少DA的合成,促进DA的代谢;给止吐六味散治疗后大鼠回肠和延髓D2受体mRNA表达和D2受体蛋白表达水平均下调,抑制DA与D2受体结合。通过本实验证实,止吐六味散对顺铂引起大鼠异食癖反应有抑制作用,能够有效降低异食癖大鼠回肠与延髓 TH含量,提高MAOB含量,抑制 DA 合成、促进DA代谢。其抑制呕吐可能与下调D2受体mRNA表达和D2受体蛋白表达有关。因此得出蒙药止吐六味散抑制大鼠异食癖行为与抑制DA的合成及促进DA代谢密切相关。
