犬恶丝虫丝氨酸蛋白酶抑制剂特性分析与诊断价值的初步评价
2019-04-02李春燕兰景超黄文俊张浩杰董晓薇古小彬杨光友
李春燕,兰景超,罗 娌,黄文俊,张浩杰,董晓薇,古小彬,谢 跃,杨光友*
(1.四川农业大学动物医学院/ 动物寄生虫病研究中心,四川成都611130;2.成都大熊猫繁育研究基地,四川成都610081)
犬恶丝虫病(Dirofilariasis)是一种以犬恶丝虫(Dirofilaria immitis)为病原,蚊为中间宿主的,主要危害犬科、猫科动物的人畜共患寄生虫病,在亚洲、非洲、大洋洲、欧洲南部和美洲等蚊虫聚集地广泛分布,引起一系列的公共安全问题[1]。虫体主要寄生于动物的右心室及肺动脉,有时也可见于动物的胸腔和支气管。动物患病早期可能不表现明显的临床反应或仅表现皮肤瘙痒等皮炎症状,患病后期根据虫体寄生部位和寄生数量的不同也可能表现出不同的临床症状。犬恶丝虫少量寄生时,动物常呈隐性感染,症状不明显;当寄生于心脏和肺脏的虫体数量较大时动物可能表现出身体消瘦、皮肤黄染、少动、咳嗽,剧烈运动中突然出现呼吸困难,猝死等症状。人也可以被含有感染期幼虫(L3)的蚊叮咬感染该病,主要侵害人的肺脏,引起咳嗽、胸闷和胸疼等症状,有时也可寄生于人的皮下、眼部和阴囊[2]。
丝氨酸蛋白酶抑制剂(Serpin)属于丝氨酸蛋白酶抑制剂超家族,主要通过灭活或抑制同源的丝氨酸蛋白酶活性来调节蛋白酶介导的活动,参与多种生理活动,如血液凝固、补体激活和肿瘤抑制等。此外,Serpin 也是生物体免疫系统的重要组成部分,能够介导宿主20 多种抗炎作用,起到增强或抑制免疫的作用[3]。现已证实Serpin 蛋白在线虫病和吸虫病中具有一定的诊断价值[4]。
目前,犬恶丝虫病的诊断主要包括常规诊断方法(直接血涂片检查法、改良柯氏法等)、免疫学诊断方法(间接ELISA 检测循环抗原、免疫层析等)和分子生物学诊断方法(PCR 鉴定),但由于虫体“隐性感染”的存在,这些方法均存在一定的缺陷,敏感性不高[5]。本实验首次扩增犬恶丝虫的Di-Serpin基因片段,原核表达并纯化重组蛋白rDi-Serpin,通过western blot 和间接免疫荧光(IFA)定位探究其生物学特性,并初步评价了rDi-Serpin 的诊断价值,为犬恶丝虫病早期诊断方法的研究提供参考。
1 材料与方法
1.1 虫株、菌株、载体及实验动物 犬恶丝虫虫体采自四川省自然感染并剖检的犬,虫体自犬心脏分离后使用PBS 清洗,参照有关文献资料,经形态学鉴定为犬恶丝虫。大肠杆菌DH5α、大肠杆菌BL21(DE3)、pET-32a(+)载体和pMD19-T 载体购自天根生化科技(北京)有限公司;犬恶丝虫的虫体粗提蛋白由四川农业大学动物寄生虫病研究中心提供。2只3 月龄~4 月龄雌性健康新西兰兔,体质量1.5 kg~2.0 kg,购自成都达硕生物有限公司。
1.2 血 清 20 份犬恶丝虫阳性血清采自四川省自然感染的犬(经剖检在心脏内查到犬恶丝虫虫体);24 份犬恶丝虫阴性血清采自春季,经体内外驱虫处理后粪检鉴定无寄生虫感染的3 月龄犬。8 份人工感染豆状带绦虫(Taenia pisiformis)的犬血清样品、9份人工感染多头带绦虫(Taenia multiceps)的犬血清样品、9 份自然感染犬钩口线虫(Ancylostoma caninum)的犬血清样品、19 份自然感染犬弓首蛔虫(Toxocara canis)的犬血清样品和5 份自然感染等孢球虫(Isosporasp.)的犬血清样品均由四川农业大学动物寄生虫病研究中心提供。以上血清样本均经粪检和死亡剖检确认,为单一虫种感染。兔阴性血清采自四川省某兔场1 月龄~2 月龄的仔兔。
1.3 主要试剂 总RNA 抽提试剂盒、琼脂糖凝胶回收试剂盒、质粒小量抽提试剂盒和HRP-DAB 底物显色试剂盒、TMB 底物显色液均购自天根生化科技(北京)有限公司;DNA Marker、Protein Marker、限制性内切酶(BamHⅠ、EcoRⅠ)、T4 DNA 连接酶均购自宝生物工程(大连)有限公司;羊抗兔HRP-IgG、兔抗犬HRP-IgG、羊抗兔FITC-IgG 购自武汉博士德生物工程有限公司;逆转录试剂盒、Ni2+螯合亲和层析柱、HiTrap Protein A 预装柱均购自美国Bio-Rad 公司。
1.4 犬恶丝虫Di-Serpin 基因的克隆、表达与纯化从液氮中取出犬恶丝虫虫体,研究后根据总RNA抽提试剂盒说明提取犬恶丝虫的总RNA,按逆转录试剂盒说明获得合成cDNA。参照犬恶丝虫成虫转录组数据库中的Serpin 基因序列unigene 979,切除信号肽后利用软件Primer premier 6.0 设计引物(上游: 5'-CGCGGATCCAAAGTTGTAAAATTACCCTA-3',含BamHⅠ酶切位点;下游:5'-CCGGAATTCTTAGATTCTCCAAATAAACTGCGG-3',含EcoRⅠ酶切位点)。以制备的cDNA 为模板进行PCR 扩增,反应条件为:94 ℃5 min;94 ℃1 min、50.4 ℃45 s、72 ℃30 s,35 个循环;72 ℃10 min;8 ℃储存。PCR 扩增完成后,构建pET-32a(+)-Serpin 重组表达质粒,将该重组质粒转入表达菌BL21 中,经菌液PCR 鉴定后测序。引物合成及目的基因测序均由成都擎科梓熙生物技术有限公司完成。扩大培养测序正确的pET-32a(+)-Serpin 表达菌,在优化的最佳诱导条件(IPTG 诱导浓度、诱导温度、诱导时间)下大量表达,使用Ni2+螯合亲和层析柱纯化表达产物,得到纯化后的重组蛋白rDi-Serpin,使用SDS-PAGE 对纯化后的rDi-Serpin 进行检测。
1.5 Di-Serpin 基因的生物信息学分析 根据扩增得到的犬恶丝虫Di-Serpin 基因序列,利用在线软件Translate(https://web.expasy.org/translate/)推测其氨基酸序列;软件Yaspin(http://www.ibi.vu.nl/programs/yaspinwww/)预测Di-Serpin 蛋白的二级结构。采用软件Clustal W 比对Di-Serpin 蛋白的同源序列后利用DNAMAN 软件进行序列相似性分析、 MEGA 6.0软件构建系统进化树(Maximum Likelihood 法)。
1.6 兔抗rDi-Serpin-IgG 血清的制备与纯化 将纯化后的rDi-Serpin 与弗氏完全佐剂或弗氏不完全佐剂按1∶1 比例混合制成油包水的乳制剂,蛋白浓度约为1 mg/mL。分别对两只新西兰兔皮下多点注射,蛋白量为200 μg/只,每次间隔2 周,共免疫4次。以兔免疫前血清为阴性对照,PBS 为空白对照,测得兔多抗血清效价大于1∶1 200 后对其心脏采血并分离血清。获得的兔多抗血清经饱和硫酸铵粗提纯,0.45 μm NC 膜过滤,HiTrap Protein A 预装柱纯化得到兔抗rDi-Serpin-IgG,使用SDS-PAGE 对纯化后的兔抗rDi-Serpin-IgG 进行检测。参照上述方法纯化得到兔阴性血清IgG。
1.7 Western blot 分析 纯化后的rDi-Serpin 和犬恶丝虫的虫体粗提蛋白经SDS-PAGE 分离后电转至硝酸纤维素滤膜(NC 膜)上,5 %脱脂奶粉室温封闭2 h 后分别利用犬的犬恶丝虫阳性血清和阴性血清(1∶100 稀释)、兔抗rDi-Serpin-IgG 和兔阴性血清IgG(1 ∶200 稀释)作为一抗孵育rDi-Serpin,利用兔抗rDi-Serpin-IgG 和兔阴性血清IgG (1∶200 稀释)作为一抗孵育犬恶丝虫的虫体粗提蛋白。充分洗涤后分别加入兔抗犬HRP-IgG 和羊抗兔HRP-IgG (1∶2 000 稀释)作为二抗,western blot 检测rDi-Serpin 与rDi-Serpin-IgG 的反应原性。
1.8 犬恶丝虫虫体横切面Serpin 蛋白的IFA 定位将4 %多聚甲醛固定的犬恶丝虫雌性和雄性成虫经石蜡包埋、切片处理(4 μm/片)、光学显微镜下观察筛选得到结构完整的切片。切片经二甲苯脱蜡、梯度酒精水化、柠檬酸缓冲液热修复、3 % H2O2氧化修复后滴加5 %牛白蛋白溶液(BSA)室温封闭1 h,分别滴加兔抗rDi-Serpin-IgG 和兔阴性血清IgG (1∶100 稀释)作为一抗,羊抗兔FITC-IgG (0.1 %伊文氏蓝1∶100 稀释)作为二抗,4,6- 二脒基-2- 苯基吲哚(DAPI)染色剂对虫体细胞核显色,甘油缓冲液封片后荧光显微镜下观察Serpin 蛋白在犬恶丝虫虫体横切面上的分布并拍照记录。
1.9 间接ELISA 方法的建立 以纯化后的rDi-Serpin 为包被抗原,采用棋盘滴定法,对包被抗原浓度(3.75 μg/ 孔、1.87 μg/ 孔、0.94 μg/ 孔、0.47 μg/孔、0.23 μg/ 孔和0.12 μg/ 孔)、血清的稀释度(1∶20、1 ∶40、1 ∶80、1 ∶160、1 ∶320、1 ∶640、1 ∶1 280 和1∶2 560)、封闭液(1 % BSA、5 % 脱脂奶粉和10%脱脂奶粉)、二抗的稀释度(1 ∶1 000、1 ∶2 000、1∶3 000、1∶4 000、1∶5 000、1∶6 000)进行优化。使用优化后的最佳包被抗原浓度4 ℃孵育过夜,封闭液封闭,以犬恶丝虫阳性血清和阴性血清作为一抗,兔抗犬HRP-IgG 作为二抗,TMB 底物显色液显色,2 mol/L 的H2SO4终止后,酶标仪测定其OD450nm值。
阴阳性判断标准采用Cut off 值法,即采用优化后的反应条件分别对24 份犬的犬恶丝虫阴性血清的OD450nm值进行测定,计算算数平均值(X)和标准方差(SD)后根据公式临界值=X+3SD 得到Cut off 值,当检测样本OD450nm值大于且等于Cut off 值则判定为阳性。
利用优化后的间接ELISA 方法对犬的20 份犬恶丝虫阳性血清和24 份犬恶丝虫阴性血清进行检测判定该方法的敏感性;同时,对犬的8 份豆状带绦虫阳性血清、9 份多头带绦虫阳性血清、9 份犬钩口线虫阳性血清、19 份犬弓首蛔虫阳性血清和5 份球虫阳性血清进行检测,判定该方法的特异性;将犬恶丝虫阳性血清按1∶10~1∶12 800 做2 倍系列稀释,判定血清最大稀释倍数,确定该方法的灵敏度。根据公式敏感性=100 %×真阳性血清数/(真阳性血清数+假阴性血清数),特异性=100 %×真阴性血清数/(真阴性血清数+ 假阳性血清数)确定该方法的敏感性和特异性。每次每板均设置阴、阳性血清对照和空白对照,以空白调零,通过批内和批间重复性试验的变异系数(CV= 标准方差/ 平均值)来检测该方法的重复性。
1.10 Di-Serpin 诊断价值的初步评价 使用建立间接ELISA 方法对经传统方法- 饱和食盐水漂浮法和贝尔曼法检测犬粪便内寄生虫种类后剖检犬心脏及肠道进行寄生虫检查,确定的24 份无寄生虫病感染的犬血清、20 份仅感染犬恶丝虫病的阳性血清和50 份仅感染除犬恶丝虫病的其它寄生虫病的犬血清进行检测,比较该方法与传统方法的差异,按公式总体符合率=100 %×(真阳性血清数+ 真阴性血清数)/(真阳性血清数+ 假阳性血清数+ 真阴性血清数+假阴性血清数)计算。
2 结 果
2.1 Di-Serpin 基因的克隆、表达与纯化 PCR 扩增结果显示,扩增产物大小与预期的Di-Serpin 相符(图1),测序结果显示Di-Serpin 基因片段长363 bp,表明克隆结果即所求片段。扩大培养测序正确的pET-32a(+)-Serpin/BL21 表达菌,37 ℃,经0.8 mmol/L IPTG 诱导12 h 后检测,结果显示,rDi-Serpin 正确表达(图2 泳道2),且该蛋白主要以包涵体的形式存在,大小约为32 ku (Di-Serpin 蛋白约14 ku,His标签约18 ku)。经Ni2+螯合亲和层析柱纯化后,得到的rDi-Serpin 条带较单一,表明该蛋白纯度较好(图2 泳道3),具备进一步研究的潜力。
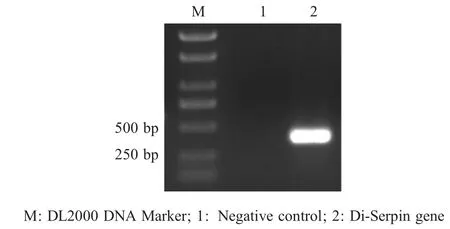
图1 Di-Serpin 基因的PCR 扩增Fig.1 Amplification of Di-Serpin gene by RT-PCR
2.2 Di-Serpin 基因的生物信息学分析 分析结果显示扩增的基因片段共编码121 个氨基酸,预测蛋白质分子量为13.56 ku,等电点为5.06,含有1 个Serine protease inhibitor 结构域,2 个糖基化位点和2个豆蔻酰化位点,表明Di-Serpin 是Serpin 超家族中的一员。基于软件DNAMAN 对不同来源的Serpin氨基酸序列进行相似性分析,结果显示犬恶丝虫的Di-Serpin 与罗阿丝虫(Loa loa)Serpin 氨基酸的序列相似性最高(78 %),与旋毛虫(Trichinella spiralis)和猪带绦虫(Taenia solium)的Serpin 氨基酸序列相似性较低(51 %和37 %)。系统进化树显示,犬恶丝虫与罗阿丝虫亲缘关系较近,先与之聚类后再依次与马来丝虫(Brugia malayi)、班氏丝虫(Wuchereria bancrofti)聚类,与旋毛虫、猪带绦虫等亲缘关系较远(图3),表明Di-Serpin 基因的系统进化关系与该虫的进化关系一致。
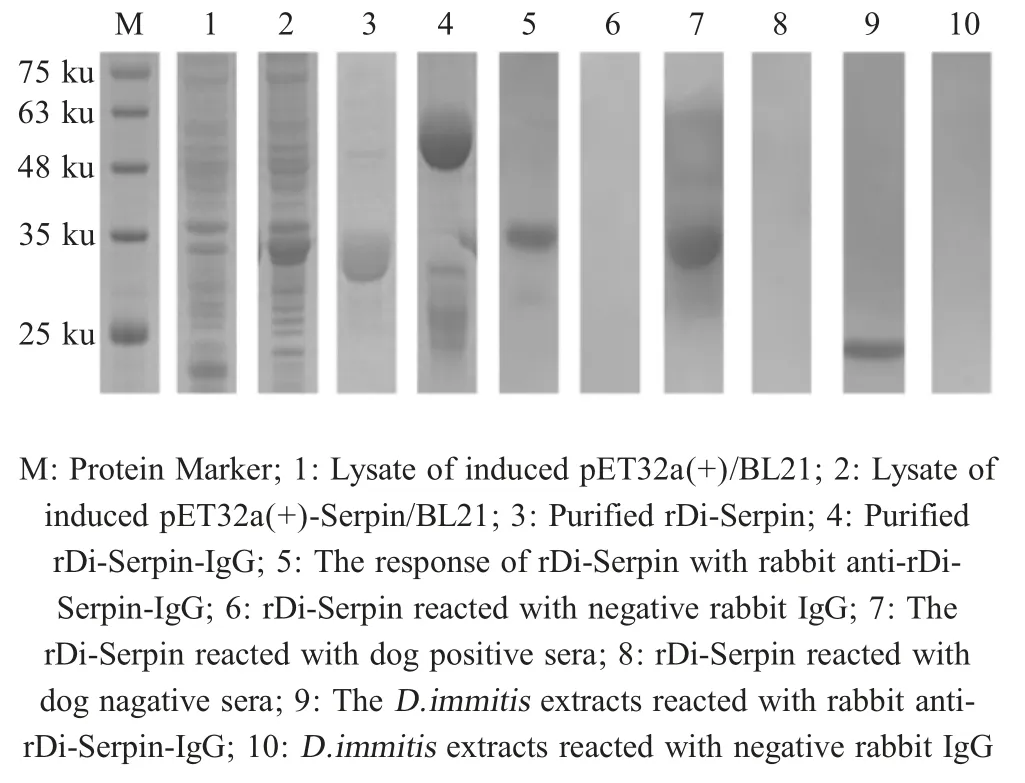
图2 基于rDi-Serpin 的SDS-PAGE 检测与western blot 分析Fig.2 The SDS-PAGE detection and western blot analysis of rDi-Serpin
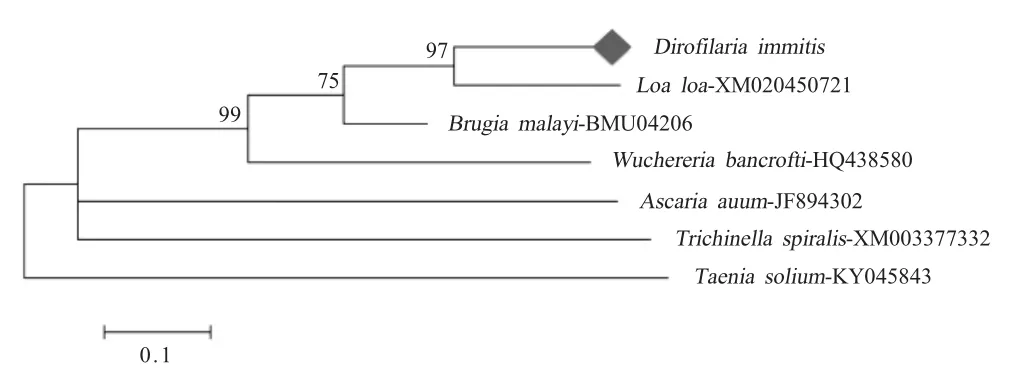
图3 Di-Serpin 的系统进化树(ML 树)Fig.3 The phylogenetic tree based on Di-Serpin gene(Maximum Likelihood tree)
2.3 兔抗rDi-Serpin-IgG 的制备与western blot 分析 纯化后的兔抗rDi-Serpin-IgG 在约50 ku 和25 ku分别出现抗体的重链和轻链,且50 ku 条带较清楚(图2 泳道4),表明纯化后的rDi-Serpin-IgG 结构完整且纯度较好。Western blot 结果显示,纯化后的rDi-Serpin 能够被自然感染犬恶丝虫的犬阳性血清与纯化后的兔抗rDi-Serpin-IgG 识别,不能被犬阴性血清和兔阴性血清IgG 识别(图2 泳道5~8),表明rDi-Serpin 具有较好的反应原性。纯化后的兔抗rDi-Serpin-IgG 能够与犬恶丝虫的虫体粗提蛋白反应,在约23 ku 位置能检测到蛋白信号,大小与预测的Serpin 天然蛋白大小基本一致(图2 泳道9),表明rDi-Serpin 即犬恶丝虫的Serpin 蛋白。
2.4 Di-Serpin 蛋白的IFA 定位 IFA 检测Serpin蛋白在犬恶丝虫虫体模切面上的分布,结果显示,Di-Serpin 在雌性和雄性成虫的表皮层、肌肉层、肠上皮、子宫、睾丸中均有表达,其中在表皮层和肠上皮表达水平较高,在虫体的肌肉层、雄虫睾丸的表面和雌虫子宫表达量较低(图4),提示Di-Serpin可能是一种分泌性的蛋白。
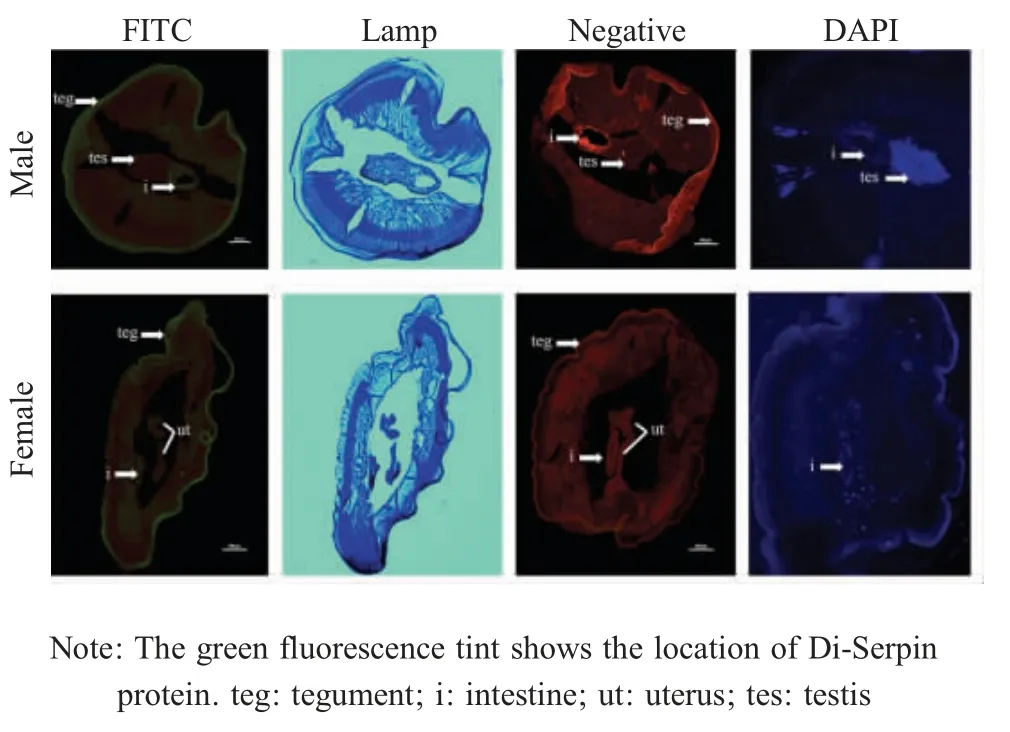
图4 雄性、雌性犬恶丝虫横切面Di-Serpin 蛋白的IFA 定位Fig.4 Tissue localization of the transverse sections of male and female D.immitis Di-Serpin protein detected by indirect immunofluorescence
2.5 间接ELISA 方法的建立 采用棋盘滴定法优化结果显示,rDi-Serpin 蛋白最佳包被浓度为0.47 μg/孔,血清的最佳稀释度为1∶160,最佳封闭液为5 %脱脂奶粉,二抗的最佳稀释度为1∶3 000。利用优化后的反应条件测定24 份犬的犬恶丝虫阴性血清OD450nm值,结果显示,OD450nm值的算数平均值为0.241,标准差为0.029,根据公式计算得到Cut off值为0.328,即当OD450nm≥0.328 时,可判定为阳性,当OD450nm<0.328 可判定为阴性。
2.6 敏感性和特异性分析 利用建立的间接ELISA方法检测20 份犬的犬恶丝虫阳性血清和24 份阴性血清,结果显示14 份阳性血清OD450nm>0.328,6 份阳性血清和24 份阴性血清OD450nm<0.328 (图5A),该方法的敏感性为70 % (14/20),使用该方法进行检测可能出现假阴性结果。利用建立的间接ELISA方法检测豆状带绦虫阳性血清、多头带绦虫阳性血清、犬钩口线虫阳性血清、犬弓首蛔虫阳性血清和球虫阳性血清,对其它寄生虫阳性血清结果显示包被的rDi-Serpin 除与豆状带绦虫阳性血清交叉反应较强外,与其它虫种的阳性血清也存在部分交叉反应(图5B),该方法的特异性为70 % (35/50),使用该方法进行检测可能出现假阳性结果。

图5 重组蛋白rDi-Serpin 的间接ELISA 检测犬恶丝虫Fig.5 Indirect ELISA for the detection of the D.immitis in dog by using rDi-Serpin
2.7 灵敏度试验 利用间接ELISA 方法检测经1:10~1∶12 800 倍比稀释后的犬恶丝虫阳性血清,结果显示,当阳性血清1∶1 600 稀释时OD450nm>0.328,当1∶3 200 稀释时OD450nm<0.328,因此该方法的灵敏度为1∶1 600,阳性血清稀释1 600 倍后仍能被检出。
2.8 重复性试验 利用间接ELISA 方法进行批内和批间重复性试验,结果显示,批内重复性试验变异系数小于5%;批间重复性试验变异系数小于10%(表1),表明该检测方法重复性较好。
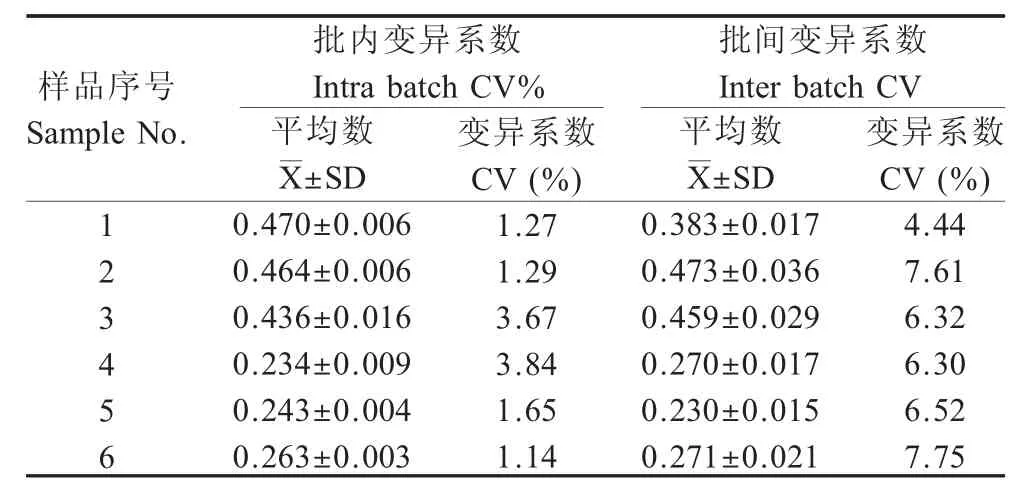
表1 间接ELISA 重复性试验(n=6)Table 1 Repeatability assay of the indirect ELISA (n=6)
2.9 符合率试验 20 份犬恶丝虫阳性血清、24 份犬恶丝虫阴性血清和50 份其它虫种阳性血清均是经过传统方法确认无误后使用。间接ELISA 检测结果表明,该方法对无寄生虫感染的犬检测正确率为100 %,但对仅感染犬恶丝虫和仅感染其它寄生虫的犬检测正确率均为70 %,阴性符合率为79.7 %(59/74),总体符合率为77.7 % (73/94),表明该方法的正确率不高。
3 讨 论
犬恶丝虫“隐性”感染的存在,即犬恶丝虫感染早期宿主血液中幼虫尚未发育成熟,或宿主体内仅存在雄虫,或宿主体内发育成熟的雌虫未产生循环微丝蚴,严重影响着犬恶丝虫病诊断的准确性,常规的诊断方法常出现假阴性的结果[2,5-6],市场上现有的犬恶丝虫病商品化检测试剂盒对宿主体内仅感染雄虫或感染早期也无法准确检测[7-8]。由于宿主体内犬恶丝虫抗体比循环抗原能更早地被检出,抗体检测或许可以用于犬恶丝虫病的早期诊断[9]。研究表明,使用纯化后的犬恶丝虫粗抗原检测该病敏感性(91.7 %)和特异性均较高,但该方法存在虫体粗抗原来源受限和虫体各时期粗抗原的差异性较大的缺点[10-11]。虫体的重组抗原由于具有稳定的来源和较好的敏感性及特异性,现已成为该病诊断研究的方向之一,犬恶丝虫转录组数据和分泌组数据的相继公开,也为该病候选诊断抗原的筛选创造了可能。近期,有研究表明以犬恶丝虫的重组蛋白二酰基甘油激酶(DgK)作为抗原诊断该病,敏感性和特异性分别为92.5 %和87.5 %[12]。
Serpin 广泛存在于寄生虫中,是寄生虫与宿主间发生相互作用的重要分子,可作用于宿主酶有利于虫体从宿主获取营养,或抵抗宿主酶对虫体的损伤,或调节宿主的炎症及免疫应答[4]。本研究首次对雌性和雄性犬恶丝虫横切面上Di-Serpin 蛋白的分布进行研究,结果显示Di-Serpin 的分布情况与旋盘尾丝虫(Onchocerca volvulus)、华支睾吸虫(Clonorchis sinensis)和多房棘球绦虫(Echinococcus multilocularis)等虫体上Serpin 的分布规律相似,主要分布于虫体体表和肠上皮[13-15]。这提示Di-Serpin 可能是一种分泌性的蛋白,能够分泌到虫体外与宿主中的蛋白酶反应,有利于幼虫在宿主体内的移行和长期寄生,本研究结果为进一步探究其功能奠定了基础。
寄生虫的Serpin 具有良好的免疫反应性,可以作为寄生虫早期血清学诊断的候选抗原,现有研究已证实该蛋白在马来丝虫、旋毛虫和旋盘尾丝虫上具有较好的诊断价值[4]。本研究首次使用western blot 对rDi-Serpin 的免疫原性进行了研究,发现该蛋白具有较好的免疫反应性,可能具备犬恶丝虫早期诊断候选抗原的潜力。虽然基于rDi-Serpin 建立的间接ELISA 方法灵敏度高达1∶1 600,对无寄生虫感染的犬血清样品进行检测正确率达100 %,但对仅感染犬恶丝虫病和仅感染其它寄生虫的犬血清样品进行检测正确率不高,敏感性和特异性均为70 %,既存在假阴性结果,也存在假阳性结果。分析间接ELISA 方法敏感性较低的原因,一是本次扩增的Di-Serpin 基因是犬恶丝虫Di-Serpin 蛋白的一个片段[16],可能未包含全部抗原决定簇,犬血清中针对该抗原决定簇的抗体含量较低;二是可能与犬血清中抗原-抗体复合物的存在有关,有研究表明血清中抗原-抗体复合物的存在会干扰抗原的检测[17-18]。本研究结果显示,该蛋白或许并不适合作为犬恶丝虫病的候选诊断抗原。
