AP2M1在狂犬病病毒侵入中的作用研究
2019-04-02王金良王子龙王鑫鑫王喜军葛金英温志远步志高
马 骁,王 翀,王金良,王子龙,王鑫鑫,帅 磊,王喜军,葛金英,温志远,步志高
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江 哈尔滨150069)
狂犬病病毒(Rabies virus,RABV)属于单股负链病毒目(Mononegavirales)弹状病毒科(Rhabdoviridae)狂犬病病毒属(Lyssaviruses)的有囊膜病毒。基因组为单股负链RNA,编码5 种结构蛋白:核蛋白(N)、磷酸化蛋白(P)、基质蛋白(M)、糖蛋白(G)和大蛋白(L)[1-2]。Whelan 等研究发现RABV G 蛋白在病毒感染早期与突触或者神经细胞膜中的神经元受体相结合,引起网格蛋白介导RABV 内吞[1-4]。衔接蛋白复合体2 (Adaptor related protein complex 2,AP2)是参与网格蛋白介导内吞过程中的重要因子。AP2 具有结合细胞膜中磷脂酰肌醇,识别货物蛋白分类信号[5],参与网格蛋白介导的内吞(Clathrin mediated endocytosis),承担连接货物蛋白物和网格蛋白间的桥梁作用,其由α、β、μ 和σ 4 个亚基构成。本实验室前期利用RNA 干扰技术(RNA interference,RNAi)在人类全基因组水平上筛选到了与RABV 生命周期有关的宿主基因,发现敲低AP2 的μ 亚基(AP2M1),可以抑制RABV 感染。AP2M1 在病毒感染过程中通过结合货物蛋白胞内区“YxxФ”(Y 代表酪氨酸,x为任意氨基酸,Ф 是重链疏水残基--L/I/M/V/F)分类信号将其聚集形成网格蛋白包被小窝介导丙型肝炎病毒(Hepatitis C virus,HCV)进入宿主细胞内[3,6-7]。为探究AP2M1 在RABV 侵入细胞机制,通过RABV 感染敲低或者过表达AP2M1 的HEK-2P3 细胞,检测分析AP2M1 对RABV 感染率的影响,以期为阐明AP2M1 在RABV 感染中的作用机制奠定基础[4,7]。
1 材料与方法
1.1 主要实验材料 RABV 弱毒株rERA-eGFP 由本实验室拯救并保存;pCAGGS-Flag、pCAGGSFlag-AP2M1、表达RABV ERA 株G 蛋白的红色荧光质粒DsRed-RV-G、pEGFP-AP2M1、表达RABV ERA 株G 蛋白的质粒pCAGGS-Flag-ERA-G、pCMV-myc-AP2M1 和pCMV-myc 质粒由本实验室构建保存;质粒小提试剂盒购自Omega 公司;阳性对照RABV-L 基因siRNA(GGAAUGCACUUUCGAUAUA TT)、 AP2M1 siRNA (AGUUUGAGCUUAUGAGGU A)、阴性对照non-targeting siRNA、Hoechst 33342 核酸染料、限制性内切酶、T4 DNA 连接酶、Lipofectamine RNAiMAX 等均购自Thermo Fisher 公司;CellTiter-BlueⓇReagent 购自Promega 公司;兔源Myc 标签抗体、鼠源Flag 标签抗体、羊抗鼠HRP-IgG、羊抗兔HRP-IgG 等均购自GenScript 公司;ANTI-FLAGⓇM2 Affinity Gel 购自Sigma 公司;Anti-AP2M1、Anti-Na/k ATPase 抗体购自Abcam 公司;TRIzol 购自Invitrogen 公司;TransIT-293 Transfection Reagent 购自Mirus 公司;玻璃底细胞培养皿购自Thermo Fisher 公司;PhantaⓇSuper Fidelity DNA Polymerase 和ClonExpress II 均购自Vazyme 公司;细胞膜提取试剂盒MinuteTMPlasma Membrane Protein Isolation and Cell Fractionation kit 购自Invent公司。
1.2 敲低AP2M1 对HEK-293 细胞活性和AP2M1表达量的影响 将HEK-293 细胞以6×103个/孔接种96 孔细胞培养板,将AP2M1 siRNA 按Lipofectamine RNAiMAX 说明书进行转染,同时设置阴性对照(non-targeting,NT)和阳性对照(RABV-L),转染后48 h,利用CellTiter-BlueⓇReagent 进行细胞活性检测;同时将HEK-293 细胞接种于6 孔板中,将上述siRNA转染HEK-293 细胞,48 h 后收获细胞。根据AP2M1基因序列(NM_001311198.1)设计引物(AP2M1-F:AGCTTATGAGGTATCGCACAACC/AP2M1-R: CTT CTGAGCCAGCAGTGAGGGTT)。以β-actin 基 因 序列设计内参引物(β-actin-F:CACTGTGCCCATCTA CGAGG/β-actin-R: TAATGTCACGCACGATTTCCC GC)。以本实验室建立的SYBR Green Ⅰ嵌合荧光法,利用LightCycler 480 ⅡqPCR 仪进行荧光定量PCR (qPCR)扩增,以β-actin 基因作为内参,采用2-△△Ct法,进行相对定量分析检测AP2M1 基因的变化。
1.3 敲低AP2M1 对RABV 感染率的影响 以6×103个/ 孔接种Perkin Elmer 96 孔微板中的HEK-293细 胞, 按Lipofectamine RNAiMAX说明书, 将AP2M1、NT 和RABV-L siRNA 转染HEK-293 细胞,转染后48 h,以MOI=0.05 的rERA-eGFP 感染细胞。感染后48 h 采用4 %多聚甲醛固定细胞,Hoechst 33342 细胞核染色30 min,利用高内涵筛选系统进行数据处理和分析。同时,分别在病毒感染后24 h、36 h、48 h、60 h、72 h、84 h 后收集细胞上清,用于病毒滴度检测。
1.4 过表达AP2M1 对RABV 感染率的影响 按TransIT-293 Transfection Reagent 说明书,将pCAGGS-Flag-AP2M1 质粒转染HEK-293 细胞,同时设置pCAGGS-Flag 空质粒作为对照,转染后48 h 收集细胞,利用细胞膜提取试剂盒按照说明书提取转染了siRNA 细胞的细胞膜,以Na/k ATPase 作为细胞膜内参,以anti-AP2M1 和anti-Nalk ATPase 抗体为一抗,羊抗兔HRP-IgG 为二抗,western blot 鉴定AP2M1 蛋白过表达效果;收集细胞提取RNA,反转录后利用qRCR 方法分析AP2M1 mRNA 转录水平变化;同时转染48 h 后,以MOI=0.04 rERA-eGFP感染细胞,分别于感染后24 h、36 h、48 h、60 h、72 h、84 h 收集细胞上清,用于病毒滴度检测。
1.5 酸绕过试验 按照Lipofectamine RNAiMAX 说明书,将AP2M1 siRNA 和阴性对照NT siRNA 转染HEK-293 细胞,转染后48 h 后以MOI=5 rERA-eGFP感染细胞后置4 ℃使病毒充分吸附结合1 h 后弃上清,DMEM 洗涤3 次,去除未吸附的病毒。分别加入100 μL pH5.5 或7.2 的PBS,37 ℃孵育10 min,用DMEM 洗涤3 次,换为含2 %血清的细胞培养液。为阻止病毒再次感染,在培养液中加入NH4Cl使其终浓度为20 mmol/L,继续37 ℃培养48 h,4%多聚甲醛固定细胞,Hoechst 33342 细胞核染色,利用高内涵筛选系统统计病毒感染率。
1.6 RABV G 蛋白与宿主AP2M1 蛋白的共定位试验 将HEK-293 细胞以6×104个/ 孔接种玻璃底细胞培养皿,按TransIT-293 Transfection Reagent 说明书,将DsRed-RV-G 和pEGFP-AP2M1 共转染HEK-293 细胞,转染48 h 后以4 %多聚甲醛固定细胞,Hoechst 33342 染细胞核,利用Leica SP2 激光共聚焦显微镜观察和分析RABV G 蛋白与宿主AP2M1蛋白是否存在共定位。
1.7 免疫共沉淀试验 按TransIT-293 Transfection Reagent 说明书,将pCAGGS-Flag-ERA-G 和pCMV-myc-AP2M1 共转染HEK-293 细胞, 同时转染pCAGGS-Flag 和pCMV-myc 为对照。转染48 h 后利用预冷的无菌PBS 缓冲液漂洗细胞3 次,采用含PMSF 的细胞裂解液裂解细胞,裂解后的样品经4 ℃下13 000 r/min 离心10 min 后取上清,与ANTIFLAGⓇM2 Affinity Gel 结合12 h 后,500 r/min 离心3 min 保留底部沉淀,裂解液洗4~6 次,4 ℃5 000 r/min 离心3 min。在沉淀中加入蛋白上样缓冲液煮沸,以兔抗Myc 标签、鼠抗flag 标签为一抗,羊抗鼠HRP-IgG、羊抗兔HRP-IgG 为二抗,western blot 分析AP2M1 与RABV G 蛋白是否有相互作用。
2 结 果
2.1 敲低AP2M1 基因对RABV 感染率的影响HEK 293 细胞转染AP2M1 siRNA 后,采用qPCR 检测AP2M1 mRNA 水平变化。结果显示,AP2M1 siRNA 转染后细胞内AP2M1 的mRNA 转录水平与NT siRNA 转染细胞相比显著下降(p<0.0001)(图1A),表明AP2M1 siRNA 能够有效抑制细胞内AP2M1 的表达。转染后经细胞活力检测,显示AP2M1 siRNA 与对照组NT siRNA 相比,对细胞活力有一定影响(图1B),但并不影响病毒感染的准确性,可以用于后续试验。AP2M1 siRNA 转染48 h后,感染RABV 弱毒株rERA-eGFP,通过高内涵筛选系统对结果进行数据分析,结果显示,经AP2M1 siRNA 转染后的细胞与NT siRNA 转染细胞相比,RABV 感染率下降约30 % (图1C),表明AP2M1 能够显著抑制RABV 的感染(p<0.0001)。AP2M1 siRNA 转染后48 h,感染RABV 弱毒株rERA-eGFP,并分别于感染后各时间点收集细胞上清检测病毒滴度,结果显示,对照组病毒滴度显著高于经AP2M1 siRNA 敲 低 的 实 验 组(图1D),AP2M1 siRNA 转 染48 h 后,感染RABV 弱毒株rERA-eGFP,荧光图像显示沉默AP2M1 后,感染绿色荧光的细胞显著减少(图1E),表明AP2M1 siRNA 沉默AP2M1 基因后,RABV 感染率下降。
2.2 AP2M1 过表达对RABV 感染率的影响 利用western blot 鉴定过表达AP2M1 对RABV 感染HEK-293 细胞的影响,结果显示,在细胞膜内参蛋白(Na/k ATPase)表达量基本相同的情况下,转染pCAGGS-Flag-AP2M1 质粒细胞相比转染pCAGGSFlag 的细胞,AP2M1 蛋白表达量明显增加(图2A)。qPCR 检测显示,过表达pCAGGS-Flag-AP2M1 质粒细胞比转染空质粒细胞内AP2M1 mRNA 转录水平显著增加(p<0.0001)(图2B)。转染pCAGGS-Flag-AP2M1 和pCAGGS-Flag 质粒后48 h 感染rERA-eGFP,分别于病毒感染后各时间点收集细胞上清进行病毒滴度测定,结果显示,相对于空质粒对照组,过表达AP2M1 能够促进RABV 对细胞的感染(图2C)。结果显示,转染pCAGGS-Flag-AP2M1 质粒细胞比转染pCAGGS-Flag 细胞由rERA-eGFP 感染复制产生的绿色荧光增多(图2D),表明过表达AP2M1 基因后,RABV 感染率上升。
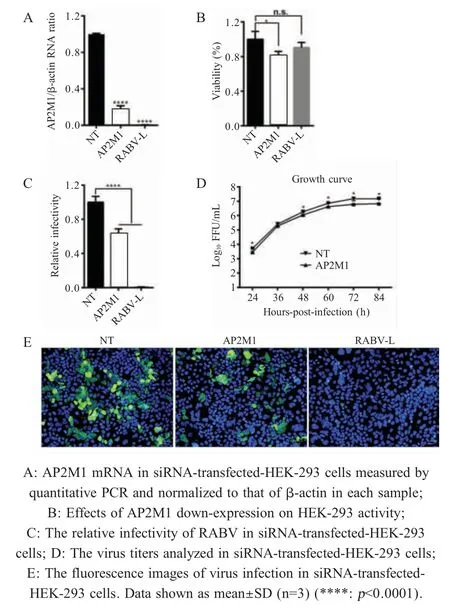
图1 敲低AP2M1 基因对RABV 感染率的影响Fig.1 Effects of AP2M1 down-expression on RABV infection
2.3 酸绕过试验结果 为明确AP2M1 对RABV 感染的调控是否由于其参与网格蛋白介导的内吞而产生影响,进行酸绕过试验,结果显示,细胞通过低pH 的PBS 酸化后,病毒与细胞膜发生融合从而进入细胞,而在抑制AP2M1 表达的细胞中RABV 感染率依然降低(图3),表明AP2M1 在病毒感染过程中起作用,可能作用时期不止发生在早期,具体病毒感染的时期依然需要后续实验研究。
2.4 RABV G 蛋白与AP2M1 共定位试验结果 将真核质粒DsRed-RV-G 和pEGFP-AP2M1 同时转染HEK293 细胞,通过激光共聚焦显微镜观察,结果显示无红色荧光和绿色荧光重合(图4),表明RABV G 蛋白与宿主AP2M1 蛋白无共定位。
2.5 AP2M1 与RABV G 蛋白免疫共沉淀试验结果将pCAGGS-Flag-ERA-G 和pCMV-myc-AP2M1 共 转染 HEK-293 细 胞, 同 时 转 染 pCAGGS-Flag 和pCMV-myc 为对照,进行免疫共沉淀试验,在转染后48 h 收集的细胞裂解物(Input)样品western blot结果显示,转染的pCAGGS-Flag-ERA-G 和pCMV-myc-AP2M1 质粒均可表达,而在洗脱物样品(IP)中,共转染pCAGGS-Flag-ERA-G 和pCMV-myc-AP2M1的样品中仅检测到pCAGGS-Flag-ERA-G 的条带,无法检测到pCMV-myc-AP2M1 的条带(图5),表明AP2M1 蛋白与RABV G 蛋白无相互作用。
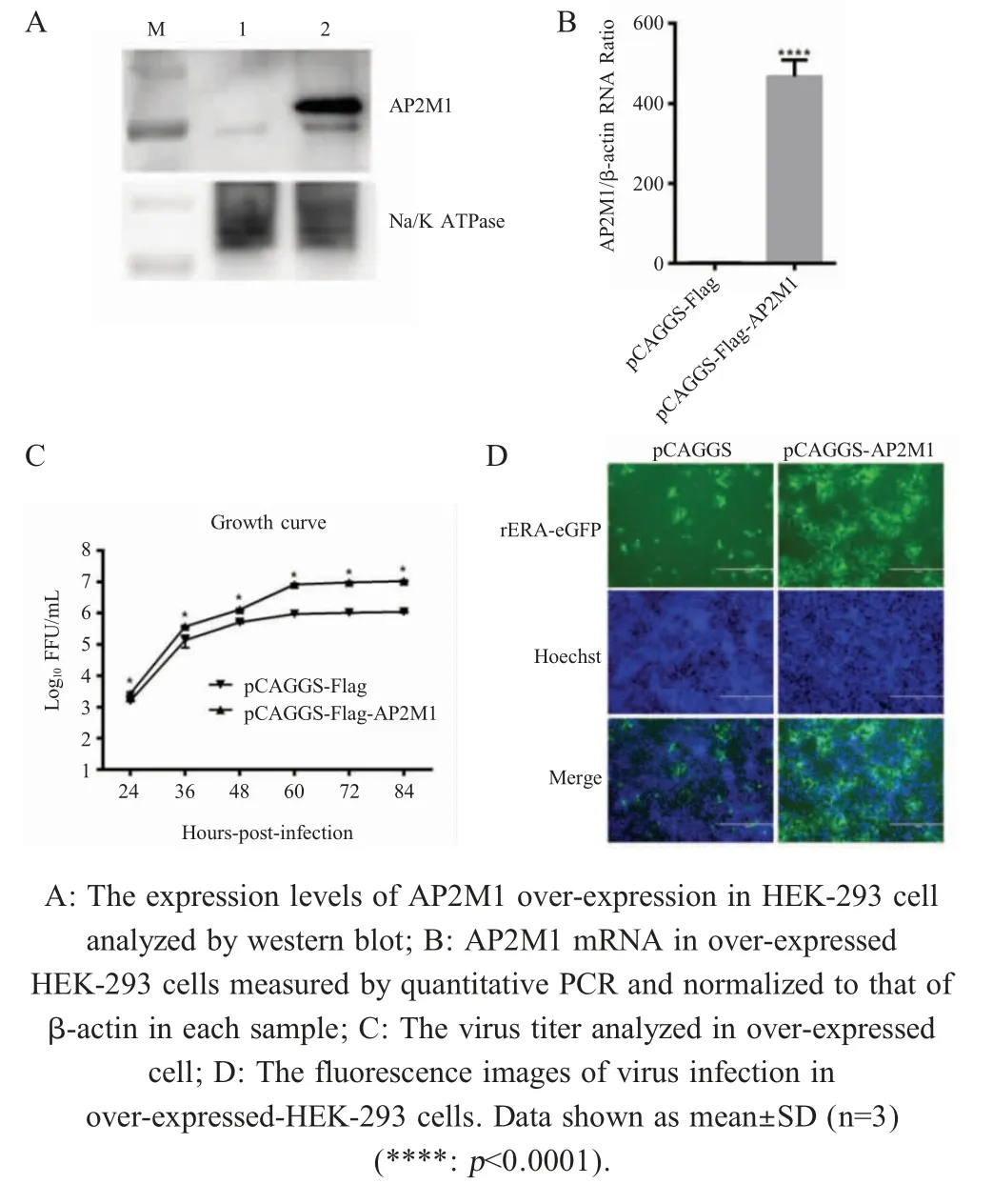
图2 AP2M1 过表达对RABV 感染率的影响Fig.2 Effects of AP2M1 over-expression on RABV infection
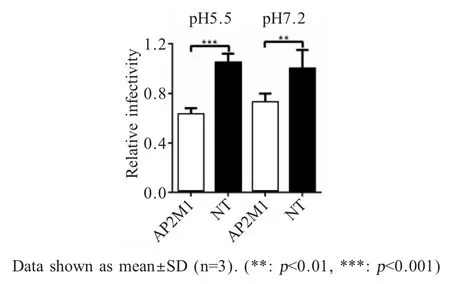
图3 不同pH 对RABV 感染率的影响Fig.3 The effect of different pH values on RABV infection
3 讨 论
对RABV 侵入细胞的机制不明确,是目前难以研究具有针对性的口服药物的原因之一。RABV G蛋白能够与宿主细胞膜上的受体相结合,介导其进入细胞内,在RABV 感染细胞早期与免疫中起着关键作用,但其具体调控机制目前还不清楚。通过本研究证实RABV 侵入细胞的新调控因子AP2M1 能够协助病毒侵入细胞,为寻找阻止RABV 感染的药物靶点研究提供实验数据。

图4 RABV G 蛋白与AP2M1 蛋白的激光共聚焦试验结果Fig.4 Laser confocal examination of RABV G protein and AP2M1 protein
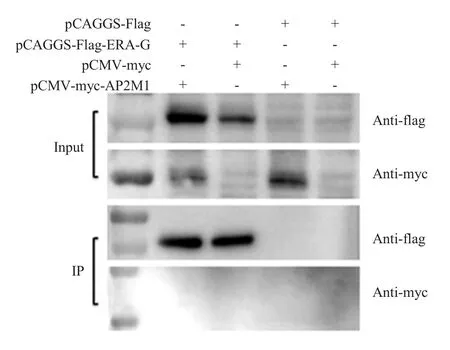
图5 RABV G 蛋白与AP2M1 蛋白的免疫共沉淀试验结果Fig.5 Immunoprecipitation assay of RABV G protein and AP2M1 protein
本实验通过转染AP2M1 siRNA 抑制AP2M1 基因,RABV 感染率下降;过表达AP2M1 基因,RABV 感染率上升,表明AP2M1 基因能够协助RABV 侵入宿主细胞。为进一步探究AP2M1 基因在RABV 侵入过程中作用的具体时期,本研究进行了酸绕过试验[7]。酸绕过试验是在病毒吸附细胞后,利用pH5.5 的PBS 缓冲液使病毒囊膜与细胞膜直接融合,该方法可使本应通过内吞作用进入细胞的病毒直接将病毒基因组释放至胞内进行复制,而NH4Cl 的加入保证病毒不能再次感染细胞[7-9]。酸绕过试验证明AP2M1 基因是在RABV 侵入过程中发挥作用,但具体作用时期,仍然需要继续研究。目前研究表明,RABV 主要通过G 蛋白与宿主细胞膜上的受体结合,诱导网格蛋白内吞进入细胞[10-11]。AP2M1 蛋白在此过程中是否发挥作用,目前还没有相关的研究。本研究通过免疫共沉淀和共定位试验证明AP2M1 蛋白与RABV G 蛋白无相互作用,表明AP2M1 并不是直接与RABV G 蛋白结合诱导RABV 进入细胞内的。AP2M1 与RABV 其它结构蛋白的相互作用及具体机理仍需要后续实验探究。Gregory 等人发现在HCV 侵入细胞中HCV 核心蛋白内的“YxxФ”基序和AP2M1 之间的相互作用有利于HCV 的进入和组装[8,10,12-13]。RABV 结构蛋白中也存在“YxxФ”基序,为进一步研究AP2M1 在RABV 侵入细胞的作用机制提供了一定的研究方向。
RABV 和水泡性口炎病毒(VSV)同属弹状病毒科,RABV 属于狂犬病毒属,VSV 属于水泡病毒属(Vesiculovirus),两者均具有子弹状形态,均是由网格蛋白介导侵入宿主细胞[9-10,13-14]。本实验室通过转染AP2M1 siRNA 沉默AP2M1 基因,感染VSV,VSV 感染率明显下降[15]。表明AP2M1 基因也能影响VSV 侵入细胞,表明AP2M1 对病毒的感染可能存在一定的广谱性。有研究表明AP2 相关的蛋白激酶(AAK1)是宿主激酶,其可以调节AP2M1 在细胞内吞和分泌途径中介导的运输[9,11,16-17]。研究AP2M1的上游调控基因AAK1 在RABV 侵入细胞中对AP2M1 的具体调控机制,寻找能够作用于AP2M1和AAK1 的主要药物作用位点,从而研制治疗狂犬病的广谱抗病毒口服药,将是下一步研究的重点。
本研究从AP2M1 对RABV 胞吞进入宿主细胞的影响入手,揭示了AP2M1 与RABV 侵入作用的关系。可以在本研究的基础上,深入研究AP2M1的上下游调控机制,从而对整个调控通路有更好的了解,同时可以借鉴本实验研究弹状病毒科其它病毒的生命周期中有无类似的侵入调节机制,为研究弹状病毒科病毒侵入细胞机制具有一定借鉴意义。
