通窍活血汤含药脑脊液对谷氨酸致PC12细胞损伤的保护作用
2019-04-01章亚兵
翟 燕, 汪 宁∗, 章亚兵, 王 艳
(1.安徽中医药大学,中药复方安徽省重点实验室,新安医学教育部重点实验室,安徽 合肥230012;2.安徽省中医药科学院中药药效与安全性评价研究所,安徽合肥230012)
脑卒中属于中医 “中风”范畴,其病机核心为气血逆乱及血溢脉外,而病变关键则为 “血瘀”,“活血化瘀”治则是临床上治疗中风的基本方法之一[1]。通窍活血汤为清代医家王清任所创立的活血化瘀的经典方,主要由麝香、桃仁、赤芍、川芎、红花等中药组成,可治头面四肢周身血管血瘀之证,临床上对中风 (包括脑梗死、血管性痴呆、脑供血不足等)、偏头痛、脑外伤性耳鸣耳聋、眩晕等疾病防治及症状改善有确切疗效[2-3]。课题组前期研究表明,含药脑脊液对脑缺血缺氧的大鼠、小鼠有显著保护作用[4-5],其机制与保护脑组织抗氧化酶活性、抑制脂质过氧化反应、减轻自由基对脑组织损伤、减轻脑水肿等有关[6];作用于谷氨酸损伤的PC12细胞时,对其有显著保护作用[7]。
由于血脑屏障的存在,脑脊液成分与血清成分无论在生理性或是药物成分上都存在显著差异,中药及复方的神经保护作用与其在体内的移行成分能否通过血脑屏障有很大联系。因此,以中药复方灌胃给与大鼠后获取的含药脑脊液代替血清,通过体外实验研究中药药理作用,可避免血清中复杂成分干扰,体现复方中效应成分的药理作用[8],本实验将从细胞水平探讨含药脑脊液对谷氨酸损伤的神经细胞保护作用。
1 材料
1.1 动物及细胞株 SPF级雄性SD大鼠,体质量(250±20)g,由安徽医科大学提供,动物许可证号SCXK(皖)20140009。PC12细胞株购自中国科学院上海细胞所。
1.3 仪器 CO2培养箱 (日本SANYO公司);洁净工作台 (苏净集团安泰公司);CK2型倒置显微镜 (日本Olympus公司);ELX800MV型酶联免疫检测仪、ELX800uv酶标仪 (美国Bio-Tek公司);流式细胞仪 (美国Beckman公司)。
1.4 试药 谷氨酸 (国药集团化学试剂有限公司,批号 20140108);0.25%胰蛋白酶 (美国Gibco公司, 批号 1546270);NO (批号20140817)、 LDH (批号 20140923)、 MDA (批号20140818)、SOD (批号 20140822)、 ATP酶 (批号20140821)、Annexin V-FITC双染细胞凋亡 (批号20140003)检测试剂盒 (南京建成生物工程研究所)。
2 方法
2.1 PC12细胞培养 将神经诱导因子分化过的PC12细胞接种于培养瓶中,培养基RP-1640(含20%胎牛血清、100 U/mL青霉素、100 mg/L链霉素),置于37℃、5%CO2培养箱中培养,细胞贴壁生长,待细胞长至80%密度时用0.25%胰蛋白酶消化传代,约4 d传代1次。
2.2 含药脑脊液制备[6,9]首先制备 10倍量汤剂,方法为称取桃仁90 g、赤芍30 g、川芎30 g、红花90 g、老葱30 g、大枣50 g于圆底烧瓶中,加入10倍量70%乙醇浸泡2 h,回流提取2 h,过滤,药材残渣加入8倍量70%乙醇回流提取1.5 h,过滤,滤液浓缩至无醇味,加入1.5 g人工麝香,加水定容,制成生药量2 g/mL的提取液,即得。再取大鼠 300只, 灌胃提取液 (0.5 g/mL), 剂量0.3 mL/100 g,早晚各1次,连续5 d。末次给药1.5 h后, 腹腔注射水合氯醛 (350 mg/kg) 麻醉,颈后部备皮,75%酒精消毒,颈部弯曲暴露枕骨,1 mL无菌注射器从枕骨大孔刺入延髓池,取出脑脊液,4℃离心 (3 000 r/min)10 min, 取上清,0.22 μm微孔滤膜过滤除菌,-20℃下冷冻保存备用。
2.3 模型建立[10]取对数生长期细胞,胰酶消化后接种于96孔板,密度为2×105/mL每孔100 μL,细胞贴壁 (约6 h)后换用无血清培养基饥饿12 h,加入 2.5、 5、 10、 15、 20、 25、 50 mmol/L 含谷氨酸空白培养基,37℃、5%CO2培养4 h后每孔加入5 mg/mL MTT染液20 μL, 继续培养4 h, 吸去孔内上清液并加入 150 μL DMSO,37℃性孵育10 min后置摇床上慢速振荡10 min,待孔内颗粒状物完全溶解,于490 nm波长处测定吸光度。
2.4 空白脑脊液对PC12细胞活性的影响 各组加入0、2.5%、5%、10%、20%、40%空白脑脊液,MTT法测定吸光度,确定脑脊液含有量。
2.5 分组 空白组:RPM-1640培养基+空白脑脊液 (5%、10%、20%),模型组:RPM-1640培养基+谷氨酸+空白脑脊液 (5%、10%、20%),通窍活血汤含药脑脊液组:RPM-1640培养基+谷氨酸+通窍活血汤 (5%、10%、20%)。各组加入不同浓度空白脑脊液或含药脑脊液,1 h后模型组、通窍活血汤含药脑脊液组加入12.5 mmol/L谷氨酸进行损伤,培养箱中培养24 h。
课程实验一般开学初制定好实验计划表,实验室是按计划进行相关实验的,平时不开放,按教学进度集中在某段时间实验,排得比较满,一个班接一个班。为了保证学生在有限的时间内顺利按时完成实验内容,实验过程中出现问题,由老师直接检查解决,实验老师人数多、老师能力强,实验做得就有保障。对于问题产生的原因和解决的方法,有学生问,老师才尽力讲解或先解决事后再解释,否则有可能影响后面的学生做实验,这样使得实验虽然做了,但达不到实验教学应有的效果。
2.6 含药脑脊液对PC12细胞形态的影响 各组培养、造模、给药后,细胞置于相差倒置显微镜下观察拍照。
2.7 含药脑脊液对PC12细胞增殖活性的影响 各组培养、造模、给药后,在490 nm波长下通过MTT法检测。
2.8 含药脑脊液对PC12细胞膜通透性的影响
2.8.1 台盼蓝染色 各组培养、造模、给药后,消化收集细胞,将各组细胞密度调整至1×105/mL,各取50 μL, 加入 0.4%台盼蓝溶液 5 μL染色,2 min时用细胞计数板在倒置显微镜下计数,死细胞因膜通透性增加被台盼蓝染色,活细胞细胞膜选择性通过功能存在而不被染色,分别记录染色、未染色细胞浓度,计算活细胞比率 (未染色细胞浓度/总细胞浓度×100%)。
2.8.2 LDH法 各组培养、造模、给药后,吸取每孔内的细胞培养上清液,按照相应试剂盒操作步骤检测上清液中LDH活性。
2.9 含药脑脊液对PC12细胞氧化应激与NO水平的影响
2.9.1 NO水平检测 各组培养、造模、给药后,吸取各孔细胞培养上清液,按照NO检测试剂盒操作步骤检测NO水平。
2.9.2 活性氧 (ROS)水平检测 各组培养、造模、给药后, 胰酶消化, 离心 (1 500 r/min)5 min后收集各组细胞。各组细胞分别悬浮于DCFH-DA终浓度为10 μmol/L的无血清培养基中,轻轻吹打混匀,孵育20 min,每隔3 min缓慢颠倒混匀,以使DCFH-DA和细胞充分接触反应,无血清细胞培养液洗涤细胞3次,洗净未进入细胞内的DCFH-DA,酶标仪于488 nm激发波长、525 nm发射波长处检测荧光强度。
2.9.3 SOD活性、MDA水平检测 各组培养、造模、给药后,收集各孔细胞,超声细胞破碎仪破碎,按相应试剂盒操作步骤检测。
2.10 含药脑脊液对PC12细胞能量代谢的影响
2.10.1 ATP酶活性检测 各组培养、造模、给药后,收集每孔内细胞,混悬于生理盐水中,超声细胞破碎仪破碎细胞,按ATP酶检测试剂盒操作步骤检测。
2.10.2 游离Ca2+水平检测 各组培养、造模、给药后,离心 (1 500 r/min)5 min,收集各组细胞,加入 Fura-2/AM 浓度为 2 μmol/L 的 Hepes 溶液1 mL,轻轻吹打混匀,置于37℃培养箱中培养45 min,荧光染料充分反应后再离心,去除上清液,Hepes轻轻吹打,洗净游离染料,再加入Hepes培养 1 h,酶标仪检测,激发波长 340、380 nm,发射波长510 nm。细胞破碎仪破碎细胞膜,振荡混匀后同法测定荧光强度,此时为Ca2+饱和时荧光强度,加入EGTA与细胞内钙充分反应,振荡混匀后测定荧光,此时为零Ca2+时荧光强度,计算 Ca2+水平, 公式为 [Ca2+] =Kd(F0/Fs)(RRmin) /(Rmax-R), 其中 Kd为 Fura-2 与 Ca2+反应的解离常数 (224 nmol/L), F0、 Fs分别为 Ca2+为0、饱和状态下的荧光强度,R为所检测荧光比值,Rmax、Rmin分别为最大、最小荧光比值。
2.11 含药脑脊液对PC12细胞凋亡率的影响 细胞药物作用后弃去培养液,冰冷PBS洗涤2次,用不含EDTA的胰酶消化,细胞计数后取1×105,离心 (4℃、1 000 r/min) 10 min, 弃上清, 加入1 mL冰冷PBS洗涤细胞2次,轻轻振荡使细胞悬浮, 离 心 (4 ℃、 1 000 r/min)。 细 胞 重 悬 于200 μL结合缓冲液中, 加入 5 μL Annexin V-FITC轻轻混匀,避光下室温反应15 min,加入200 μL结合缓冲液 (总反应体积 400 μL) 及 5 μL PI,1 h内上机检测。
2.12 统计学分析 通过SPSS 19.0软件进行处理,数据以 (±s)表示,多组间数据比较采用单因素方差分析,2组间数据比较采用LSD-t检验。P<0.05表示差异有统计学意义。
3 结果
3.1 谷氨酸对PC12细胞活性的影响 图1显示,谷氨酸对PC12细胞有显著损伤作用,并呈剂量依赖性 (P<0.05,P<0.01),细胞存活率 (实验组OD值/阴性对照OD值×100%)接近50%时,本实验选择其对应的浓度 (20 mmol/L)作为造模浓度。
3.2 空白脑脊液对PC12细胞增殖的影响 图2显示,空白脑脊液浓度在0~20%范围内对PC12细胞生长有显著促进作用 (P<0.05,P<0.01),而在40%时有所下降,故本实验将其设定为5%、10%、20%。
3.3 含药脑脊液对PC12细胞形态的影响 图3显示,与模型组比较,含药脑脊液组细胞存活率显著提高,活细胞数显著增加,类似神经突起的细胞轴突易见的细胞比例显著更多,细胞间联系较多,细胞漂浮显著降低,具折光性细胞显著增加,簇状生长细胞较多,离散单一的细胞数量较少。
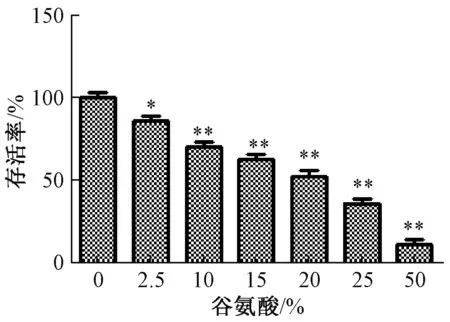
图1 谷氨酸对PC12细胞活性的影响 (±s, n=6)Fig.1 Effect of glutamic acid on PC12 cell viability(±s, n=6)
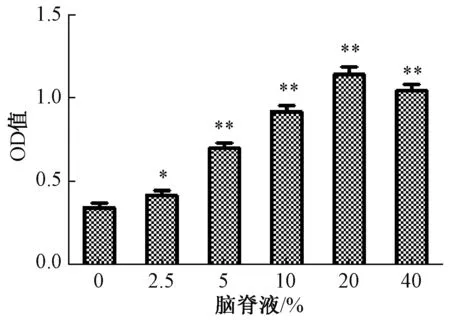
图2 空白脑脊液对PC12细胞增殖的影响 (±s, n=6)Fig.2 Effect of blank cerebrospinal fluid on PC12 cell proliferation(±s, n=6)
3.4 含药脑脊液对PC12细胞活性的影响 图4显示,与空白组比较,模型组OD值显著降低(P<0.05,P<0.01);与模型组相比,含药脑脊液组OD值显著提高 (P<0.05, P<0.01)。
3.5 含药脑脊液对PC12细胞膜通透性的影响
3.5.1 细胞存活率 图5显示,模型组细胞存活率显著低于空白组 (P<0.05,P<0.01),含药脑脊液组也显著高于模型组 (P<0.05,P<0.01)。
3.5.2 LDH活性 图6显示,与空白组比较,模型组LDH活性显著提高 (P<0.05,P<0.01);与模型组比较,含药脑脊液组其水平显著降低 (P<0.05, P<0.01)。
3.6 含药脑脊液对PC12细胞氧化应激与NO水平的影响
3.6.1 NO水平 图7显示,与空白组比较,模型组NO水平显著升高 (P<0.05,P<0.01);与模型组比较,含药脑脊液组其水平显著降低 (P<0.05,P<0.01)。
3.6.2 ROS水平 图8显示,与空白组比较,模型组ROS荧光强度显著增强 (P<0.05,P<0.01);与模型组比较,含药脑脊液组其荧光强度显著降低(P<0.05, P<0.01)。
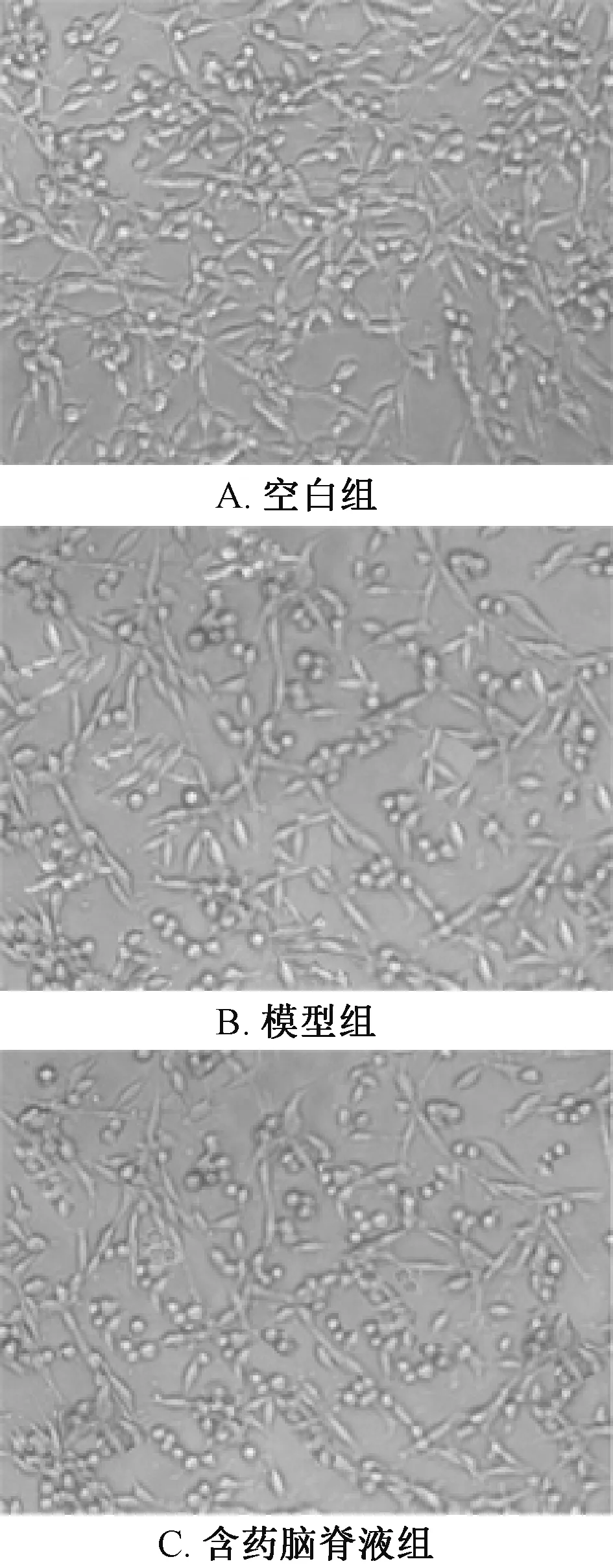
图3 PC12细胞形态变化 (×200)Fig.3 Morphological changes of PC12 cells(×200)

图4 含药脑脊液对PC12细胞活性的影响 (±s, n=6)Fig.4 Effect of medicated cerebrospinal fluid on PC12 cell viability(±s, n=6)
3.6.3 含药脑脊液对SOD活性、MDA水平的影响 图9~10显示,与空白组比较,模型组SOD活性显著降低,MDA水平显著升高 (P<0.05,P<0.01);与模型组比较,含药脑脊液组前者显著升高, 后者显著降低 (P<0.05, P<0.01)。
3.7 含药脑脊液对ATP酶活性的影响 图11显示,与空白组比较,模型组ATP酶活性显著降低(P<0.05,P<0.01);与模型组比较,含药脑脊液组中其水平显著升高 (P<0.05,P<0.01)。

图5 含药脑脊液对PC12细胞存活率的影响 (±s, n=6)Fig.5 Effect of medicated cerebrospinal fluid on PC12 cell survival rate(±s, n=6)

图6 含药脑脊液对LDH活性的影响 (±s, n=6)Fig.6 Effect of medicated cerebrospinal fluid on LDH activity(±s, n=6)
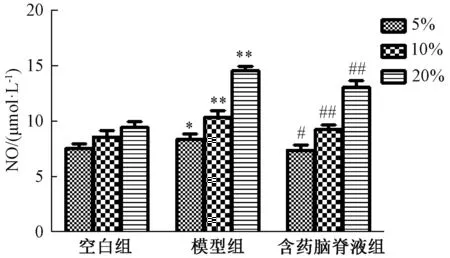
图7 含药脑脊液对NO水平的影响 (±s, n=6)Fig.7 Effect of medicated cerebrospinal fluid on NO level(±s, n=6)
3.8 含药脑脊液对游离Ca2+水平的影响 图12显示,与空白组比较,模型组游离Ca2+水平显著升高(P<0.05,P<0.01);与模型组比较,含药脑脊液组其水平显著降低 (P<0.05, P<0.01)。
3.9 含药脑脊液对PC12细胞凋亡的影响 图13显示,与空白组比较,模型组细胞凋亡数显著增加(P<0.05,P<0.01);与模型组比较,含药脑脊液组其凋亡数显著减少 (P<0.05,P<0.01)。

图8 含药脑脊液对ROS水平的影响 (±s, n=6)Fig.8 Effect of medicated cerebrospinal fluid on ROS level(±s, n=6)
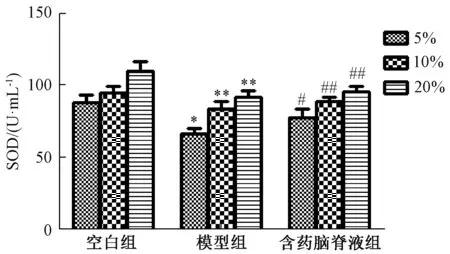
图9 含药脑脊液对SOD活性的影响 (±s, n=6)Fig.9 Effect of medicated cerebrospinal fluid on SOD activity(±s, n=6)

图10 含药脑脊液对MDA水平的影响 (±s, n=6)Fig.10 Effect of medicated cerebrospinal fluid on MDA level(±s, n=6)
4 讨论
PC12细胞为大鼠嗜铬细胞瘤细胞系,在形态、结构、功能上与神经元极其相似,与原代培养的神经细胞也具有高度一致性,并有着易于稳定培养的优点,已被广泛用于神经分泌模型建立和神经元损伤机制的研究[11]。

图11 含药脑脊液对ATP酶活性的影响 (±s, n=6)Fig.11 Effect of medicated cerebrospinal fluid on ATPase activity(±s, n=6)

图12 含药脑脊液对游离Ca2+水平的影响 (±s, n=6)Fig.12 Effect of medicated cerebrospinal fluid on free Ca2+level (±s, n=6)
谷氨酸广泛存在于许多神经元轴突中,在神经元分化、生长过程中发挥重要作用。当机体中谷氨酸浓度过高时,会对PC12细胞产生毒害,导致其受体NMDA功能活跃,Na+、Ca2+内流,细胞膜电位失衡,导致凋亡信号转导途径被激活,引起细胞凋亡。凋亡过程中,线粒体中含有大量摄取内流的Ca2+,导致其浓度过高,降低ATP酶活性,同时激活NO合成酶,最终导致细胞死亡[12-13]。本实验发现,通窍活血汤含药脑脊液可增加SOD、ATP酶活性,同时降低MDA水平。谷氨酸致PC12细胞损伤时,可引起氧化应激反应、ATP衰竭、Ca2+内流,导致细胞凋亡[14-17],本实验发现20 mmol/L谷氨酸可造成PC12细胞钙超载,而通窍活血汤可降低该现象,减轻凋亡发生。
中药脑脊液药理学是中枢神经系统中药及复方的一种研究方法,其研究对象是通过脑血管障壁选择性吸收后的含药脑脊液,所得结果在神经科学方面比其他药理学方法更准确可靠。本实验以含药脑脊液代替含药血清,观察作用于中枢神经系统药物(特别是中药复方),可避免血清中复杂成分干扰,更能体现有效成分药理作用,增加相关研究的针对性[18-19]。
综上所述,通窍活血汤含药脑脊液可通过降低NO、MDA水平,增强 SOD、ATP酶活性,降低ROS生成,减轻钙超载程度,继而减轻谷氨酸对PC12细胞的损伤程度,具有一定保护作用。

图13 含药脑脊液对PC12细胞凋亡的影响 (±s, n=6)
Fig.13 Effect of medicated cerebrospinal fluid on PC12 cell apoptosis(±s, n=6)
注: 与空白组比较,∗P<0.05,∗∗P<0.01; 与模型组比较,#P<0.05,##P<0.01
[15] Phillis J W, Ren J, O’ Regan M H.Transporter reversal as a mechanism of glutamate release from the ischemic rat cerebral cortex: studies with DL-threo-β-benzyloxyaspartate[J].Brain Res, 2000, 880(1-2): 224.
[16] Li N, Liu B, Dluzen D E, et al.Protective effects of ginsenoside Rg2 against glutamate-induced neurotoxicity in PC12 cells[J].J Ethnopharmacol, 2007, 111(3): 458-463.
[17] Lv M M, Cheng Y C, Xiao Z B, et al.Down-regulation of Homer1b/c attenuates groupⅠmetabotropic glutamate receptors dependentCa2+signaling through regulating endoplasmic reticulum Ca2+release in PC12 cells[J].Biochem Biophys Res Commun, 2014, 450(4): 1568-1574.
[18] 顾利强,章 媛,徐晓珍,等.大鼠脑脊液多次采集改良模型的建立[J].中国现代应用药学, 2018, 35(3):311-313.
[19] 秦秀德,郭家奎,韩舰华,等.中药脑脊液药理学应用研究进展[J].中华中医药杂志, 2013, 28(8):2377-2381.
