两种黄酮类铜(II)配合物的 制备及体外抗氧化活性
2019-03-28,,,,,
,,,,,
(华南农业大学材料与能源学院,广东广州 510642)
天然黄酮化合物是自然界中一类重要的微量营养物。这类化合物以黄酮母核为结构基础,通过在环(A,B和C环)上不同位置发生羟基等活性基团取代而形成一系列结构相似的衍生物[1]。黄酮化合物因具有清除体内自由基、抗癌、抗病毒、抗菌、消炎等活性而具有重要的药用价值,尤其是作为天然抗氧化剂,可将活泼、有害的自由基还原成稳定、无害的物质[2-3]。
金雀异黄酮和山奈酚作为常见的黄酮类化合物,因具备丰富的生物活性而被广泛使用,但在实际的工业生产中仍然存在许多不足,比如作用位点较多、选择性和稳定性不强、溶解度和生物利用度低等,这些缺点严重限制了此类黄酮化合物的高效利用。人们为了提高黄酮化合物的生物活性,改善其溶解性和生物利用度,通常采用酯化、甲基化或引用亲水基团等进行结构修饰[4],或者是利用黄酮化合物中含有孤对电子的羟基氧和羰基氧与金属离子配位形成金属配合物[5],从而增强配体的生物活性或产生新功能[6]。
1 材料与方法
1.1 材料与仪器
金雀异黄酮 分析纯,阿拉丁试剂有限公司;山奈酚 分析纯,上海迈瑞尔化学技术有限公司;无水乙醇、双氧水、乙二胺四乙酸 分析纯,广州化学试剂厂;二甲基亚砜(DMSO) 分析纯,天津市博迪化工有限公司;氯化铜、水杨酸、四甲基乙二胺、高氯酸、六次甲基四胺 分析纯,国药集团化学试剂有限公司;氢氧化钠 分析纯,天津市大茂化学试剂厂;硫酸亚铁 分析纯,天津市科密欧化学试剂有限公司;抗坏血酸、氯化硝基四氮唑蓝(NBT) 生物试剂,国药集团化学试剂有限公司;核黄素 生物试剂,上海伯奥生物科技有限公司。
78HW-1磁力搅拌器 金坛市江南仪器厂;FE20实验室pH计 Mettler Toledo有限公司;ACATAR 360 FT-IR型红外光谱仪(KBr压片) 美国Nnicolet公司;Pharmacia UV-2550紫外-可见分光光度计 日本Shimadzu公司;Vario EL元素分析仪 德国Elementar公司;STA 409 PC/PG 热分析仪 德国Netzsch公司;721型分光光度计 上海精密科学仪器有限公司;HK-1D超级恒温水槽 南京大学物理研究所;SYC-15B超级恒温水浴 南京桑力电子设备厂;SXL-1008程控式电炉 上海精宏实验设备有限公司。
1.2 实验方法
1.2.1 两种配合物的合成 参考文献方法[7],分别称取0.0676 g金雀异黄酮和0.0716 g山奈酚并置于2个150 mL圆底烧瓶中,各加入10 mL无水乙醇,用磁力搅拌器40 ℃下加热搅拌,使固体完全溶解,然后分别加入等物质的量的氢氧化钠,继续搅拌30 min;再向溶液中滴加0.5 mL 0.5 mol/L的氯化铜溶液,并加入去离子水至溶液总体积为20 mL,60 ℃下搅拌4 h。溶液静置12 h,分别有黄绿色和深褐色沉淀生成,过滤,固体产物分别经水和无水乙醇洗涤数次,将其置于真空干燥器中室温干燥2 d,样品管密封保存备用。
1.2.2 配合物中的元素含量分析 配合物1和2中的C、H元素含量采用德国元素分析仪测定。铜离子含量利用EDTA络合滴定法测定[8]:称取0.2 g配合物于坩埚中,900 ℃下灼烧至完全分解,用HClO4溶解灼烧残留物并定容至100 mL,加入六次甲基四胺调节溶液的pH至5~5.5,以二甲酚橙为指示剂,用0.0100 mol/L EDTA标准溶液滴定,实验平行三次。铜离子含量的计算公式为:
式(1)
式中:CEDTA为EDTA标准溶液的物质的量浓度,mol/L;VEDTA为滴定过程中所用的EDTA标准溶液体积,mL;MCu=63.55,为铜的相对原子质量。
1.2.3 配体及配合物的红外光谱测定 采用KBr压片法,在400~4000 cm-1范围内,运用红外光谱仪测定了配体金雀异黄酮、山奈酚和配合物1和2的红外光谱。
1.2.4 配体及配合物的电子吸收光谱测定 在200~600 nm内,运用紫外可见分光光度计分别测定了金雀异黄酮、山奈酚以及配合物1和2的电子吸收光谱。
1.2.5 配合物的热重分析 采用热分析仪,在氩气保护下,分别测定了配合物1和2的热分解,温度工作范围为25~750 ℃,升温速率为10 ℃/min。
1.2.6 配合物的抗氧化活性测定
空白反应液的配制:称取0.0381 g NBT溶于10 mL PBS缓冲溶液(5.800 g十二水合磷酸氢二钠和0.593 g二水合磷酸二氢钠溶解于水中,定容至100 mL,pH为7.4)中,得到溶液a;准确称取0.0032 g核黄素(VB2)溶于100 mL PBS缓冲溶液中,得到溶液b;取1 mL四甲基乙二胺用PBS缓冲溶液定容至100 mL,得到溶液c。取20 mL溶液b和382 μL溶液c于500 mL容量瓶中,加入5 mL溶液a混合定容,得空白反应液,避光保存。
1.2.6.2 水杨酸法测定配合物清除·OH活性 参考文献[10],根据经典的Fenton反应体系,准确配制9.0 mmol/L硫酸亚铁溶液,9.0 mmol/L水杨酸-乙醇溶液,8.8 mmol/L过氧化氢储备溶液。分别移取0.1、0.2、0.3、0.4、0.5和1 mL的铜(II)配合物溶液于(溶液浓度为1.0×10-3mol/L)比色管中,然后依次加入0.5 mL硫酸亚铁溶液,0.5 mL水杨酸-乙醇溶液,0.5 mL双氧水溶液,1 mL DMSO,总体积用去离子水定容至5.0 mL,配合物的最终浓度梯度为2×10-5、4×10-5、6×10-5、8×10-5、1×10-4和2×10-4mol/L。充分混匀后于37 ℃水浴中恒温30 min。在510 nm处测定反应体系的吸光度值,测定重复三次。清除率计算公式为:
式(2)
式中:A0为空白对照溶液的吸光度,Ax为加样品后溶液的吸光度,Ax0为不加 H2O2的溶液的吸光度。
1.3 数据处理
2 结果与分析
2.1 配合物的元素分析结果
配合物1和2的元素分析结果见表1。根据实验结果,推测出金雀异黄酮和山奈酚与氯化铜均以2∶1的摩尔比形成目标配合物。配合物1可能的分子式为C30H28O15Cu,C、H含量测定结果分别为C:52.23%(52.06%,理论值),H:3.84%(4.08%,理论值),铜离子含量为9.42%(9.19%,理论值);配合物2可能的分子式为C30H25O15.5Cu,C、H含量测定结果分别为C:51.81%(51.69%,理论值),H:3.92%(3.62%,理论值),铜离子含量为9.33%(9.12%,理论值)。

表1 配合物1和2的组成及元素分析Table 1 Elemental analysis of complexes 1 and 2
2.2 配合物的红外光谱分析
配体及配合物1和2的红外光谱如图1所示,主要红外数据列于表2。配体和配合物在3300~3500 cm-1均出现了一个宽峰,归属为黄酮母核上羟基的伸缩振动。在1600~1700 cm-1,配合物1和2均出现了羰基伸缩振动峰,相对于对应的配体,配合物中的羰基伸缩振动峰向低波数移动,原因是羰基上的氧原子与铜(II)配位后,使得羰基成键电子密度更加偏向氧原子,造成C=O键电子云密度下降,从而降低了羰基的双键性[11],这说明黄酮母核C环上的4位羰基氧与铜(II)配位。配体黄酮母核C环上的C=C的伸缩振动峰在1500~1650 cm-1,而在配合物中C=C伸缩振动峰向低波数移动了10~20 cm-1,归因于铜(II)与羰基配位后扩大了C环的π键离域范围。在1200~1300 cm-1,羟基峰的强度明显减弱,并且伴有蓝移,再次证明配合物中羟基数目减少,有部分羟基参与了配位。另外,在613、630 cm-1处出现了Cu-O键的伸缩振动吸收[12]。

表2 配体及配合物1和2的主要红外数据(cm-1)Table 2 IR spectra(cm-1)of the ligands and complexes 1 and 2
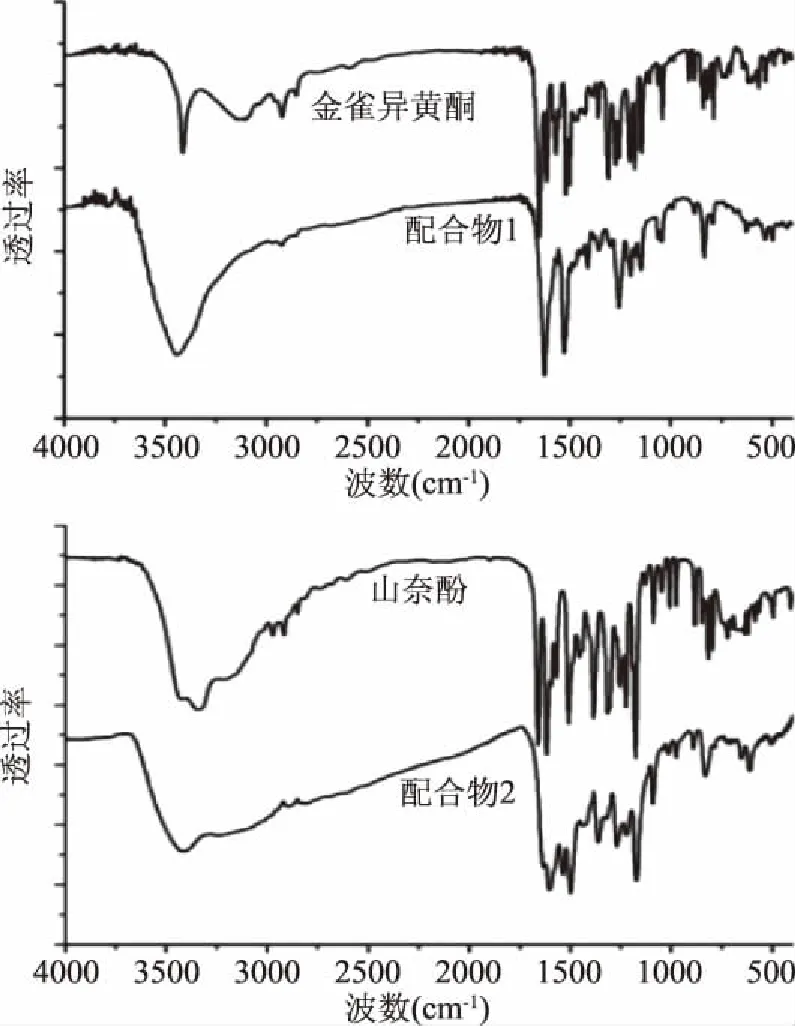
图1 配体及配合物的红外图谱Fig.1 IR spectra of the ligands and complexes
2.3 配合物的电子吸收光谱分析
配体及配合物的电子吸收光谱如图2所示。在配体和配合物1和2的电子吸收光谱中,均有两个主要的特征谱带Band Ⅰ和Band Ⅱ,其中,Band Ⅰ归属为黄酮母核B环上的π→π*电子跃迁,Band Ⅱ归属为A环上的π→π*电子跃迁[13]。通过与配体的谱带进行对比,目标配合物的两条谱带均发生了不同程度的红移。在金雀异黄酮和配合物1中,Band Ⅰ由332 nm红移至389 nm,Band Ⅱ由262 nm红移至266 nm;在山奈酚和配合物2中,Band Ⅰ由367 nm红移至417 nm,Band Ⅱ由267 nm红移至280 nm。这些谱带的红移主要是因为形成的新螯合环使得整个分子的离域体系重新进行电子分布,形成能量更低,范围更广的π电子离域系统[14]。
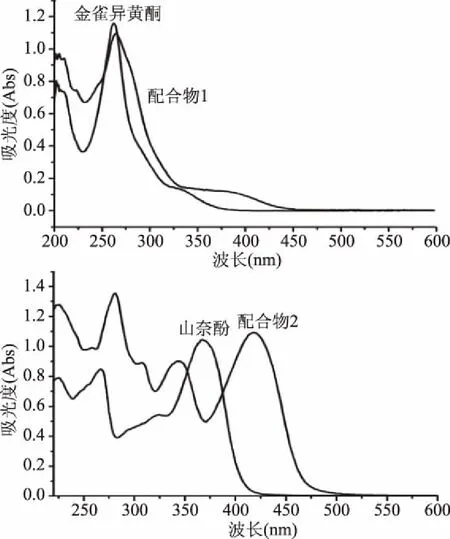
图2 配体及配合物的电子吸收光谱Fig.2 Electronic absorption spectra of the ligands and complexes
2.4 配合物的热重分析
配合物的热重分析如图3所示。结果表明,在配合物1中,从室温到315 ℃共有2个明显的失重过程,分别对应于结晶水和配位水的失重,其中第一个失重过程的失重率为8.45%,推测配合物1含有3个结晶水(理论值为7.81%);第二个失重过程的失重率为5.35%,推测含有2个配位水(理论值为5.65%);315 ℃以后,配体金雀异黄酮开始逐步分解,最终残留物为氧化铜和部分碳的混合固体。配合物2与配合物1发生了类似的热分解过程。在配合物2中,从室温到327 ℃同样有2个明显的失重过程,分别对应于结晶水和配位水的失重,其中结晶水的失重率为3.65%,推测含有1.5个结晶水(理论值为3.88%);配位水的失重率为5.15%,推测含有2个配位水(理论值为5.38%);327 ℃以后,配体山奈酚开始逐步分解,最终残留物为氧化铜和部分碳的混合固体。
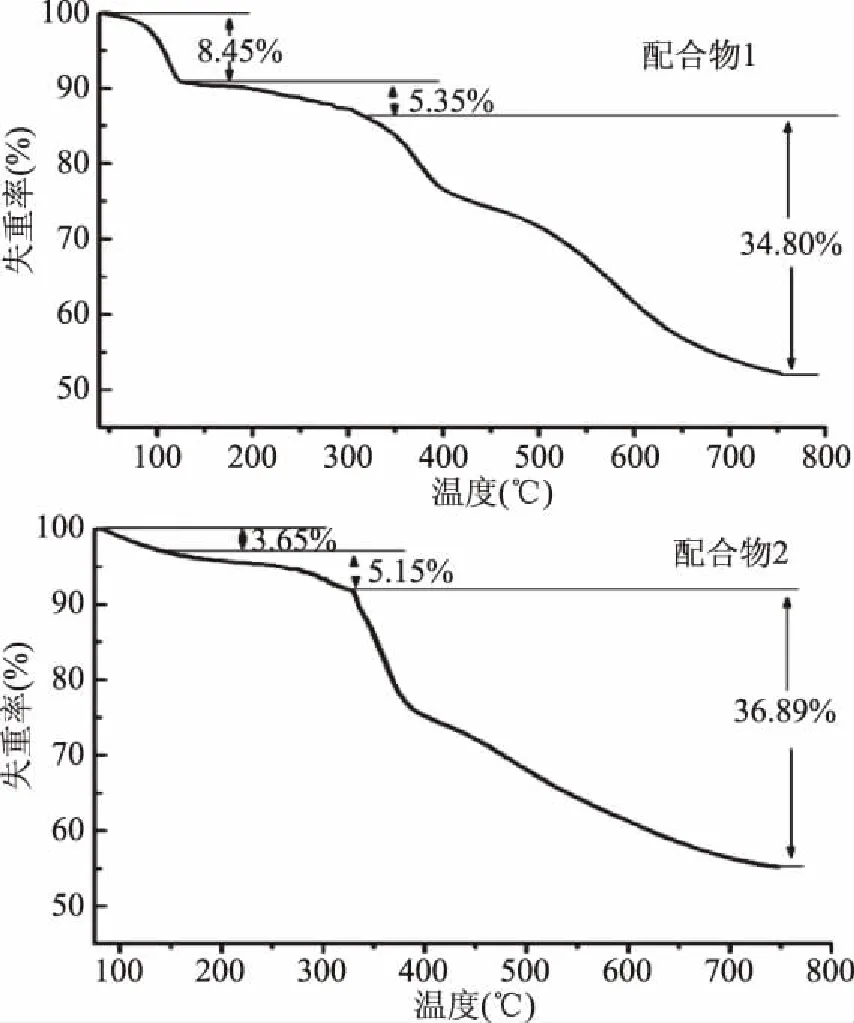
图3 配合物的热重分析Fig.3 Thermogravimetric analysis of the complexes
综合上述配合物的元素分析、红外光谱、电子吸收光谱和热重分析测定结果,结合参考文献[15-16],可推测配合物1和2的分子式分别为[Cu(Gen)2(H2O)2]·3H2O(1)和[Cu(Kae)2(H2O)2]·1.5H2O(2),可能的分子结构如图4所示。

图4 配合物可能的分子结构Fig.4 The possible molecular structure of the complexes
2.5 配合物的抗氧化活性分析
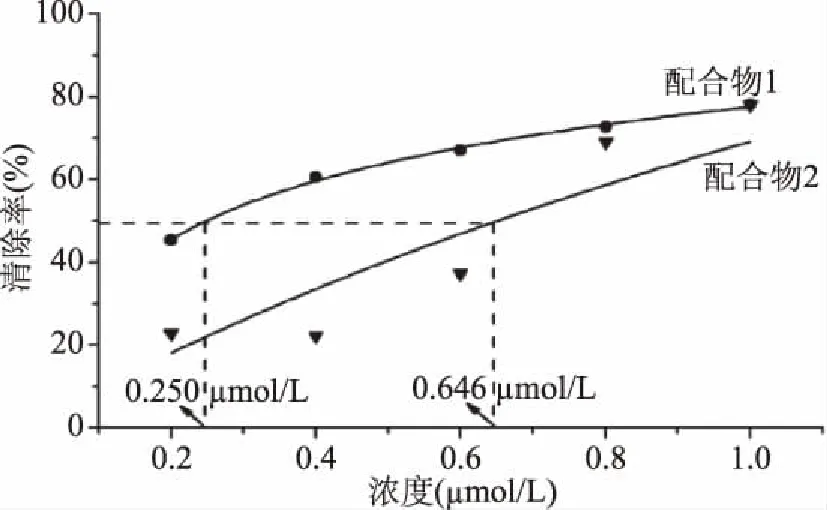
图5 配合物对的清除率Fig.5 The scavenging ratios of the complexes to superoxide anion radicals
2.5.2 水杨酸法测定配合物清除·OH活性 ·OH是最活跃、进攻性最强的活性氧(ROS)自由基之一,具有存在时间短、攻击性强、破坏性大等特点,生物体内多余的·OH会对机体健康产生非常严重的影响。
根据经典的水杨酸法,测定了Fenton反应中配合物清除·OH的能力,实验结果如图6所示。从图中可以看出,金雀异黄酮、山奈酚和配合物1和2清除·OH的能力均随着浓度的增大而增强,并且在相同浓度下,山奈酚比金雀异黄酮清除·OH的能力强,主要是因为山奈酚拥有更多的取代羟基,能提供更多的羟基质子。
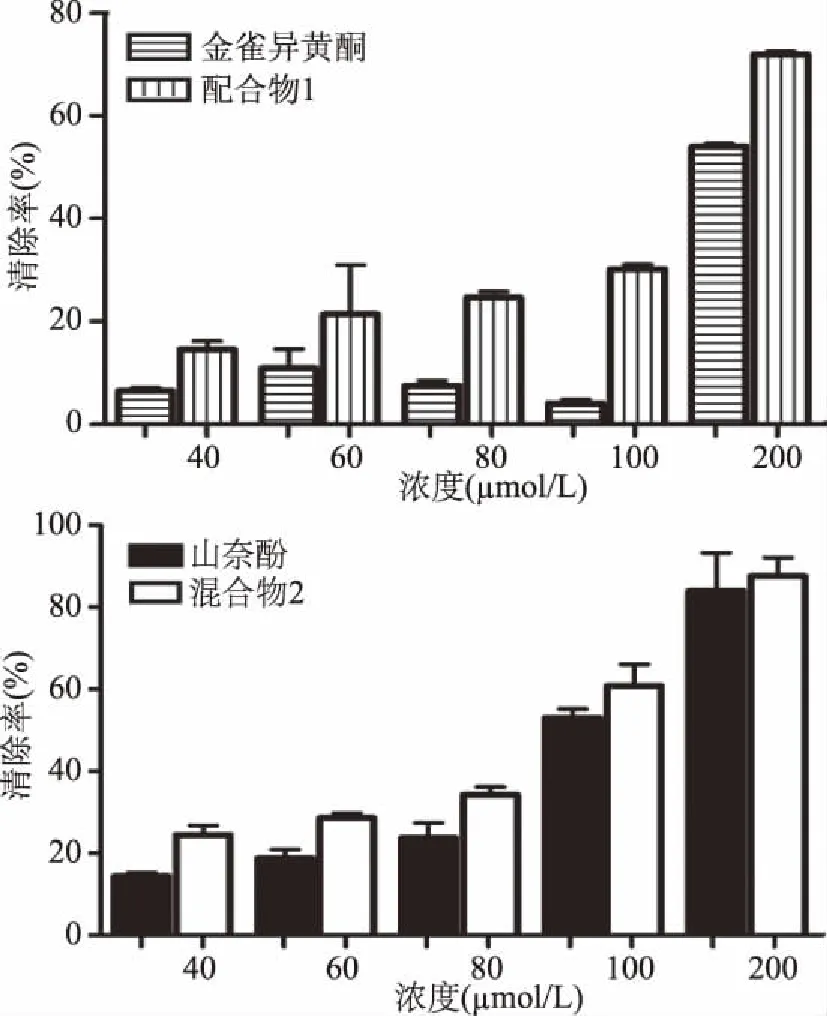
图6 黄酮配体和配合物对·OH清除率的影响Fig.6 The scavenging rates of the ligands and complexes to hydroxyl radicals
相对于黄酮配体,配合物清除·OH的能力都进一步增强,表明黄酮化合物与铜(II)之间存在的正协同作用。推测主要有以下原因:首先,当铜(II)与配体的C4位羰基氧和C3或者C5位羟基氧双齿配位形成超共轭结构后,整个黄酮母核的共轭体系增大,电子的离域程度增加,使得配合物更容易提供电子,便于与·OH结合终止自由基的链式反应。其次,黄酮配体与铜(II)形成配合物以后,母环中的C—C、C—H键的键长会增加,整个分子的稳定性降低,抗氧化活性会增加[17]。另外,配合物中的中心铜(II)所带正电荷的离域作用会影响配体中羟基质子的正电荷,并且中心铜(II)由于带有较大的正电荷,呈现出较强的成键能力,在一定程度上增强了配合物的抗氧化活性。配合物1清除·OH的IC50(158 μmol/L)小于配合物2的IC50(129 μmol/L)(图7),这一顺序与金雀异黄酮、山奈酚清除·OH的活性大小顺序一致,说明在清除·OH的过程中,黄酮配体起主要作用。
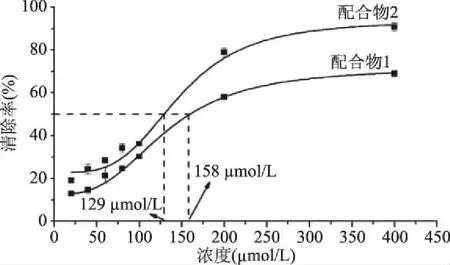
图7 配合物清除·OH的IC50值Fig.7 IC50 values of the complexes to hydroxyl radicals
3 结论
本文在无水乙醇-水混合溶剂中,分别以金雀异黄酮和山奈酚为配体,合成了2个铜(II)配合物:[Cu(Gen)2(H2O)2]·3H2O(1)、[Cu(Kae)2(H2O)2]·1.5H2O(2)并且进行了表征。在配合物中,金雀异黄酮和山奈酚均以二齿配位的方式与中心铜离子配位,摩尔比为2∶1。
