育麟方改善老龄雌性小鼠超促排卵作用的机制研究
2019-03-27马景张驰章勤何嘉琳刘晓昱缪晨韵
马景张驰章勤何嘉琳刘晓昱缪晨韵
1.杭州市中医院 杭州 310007 2.浙江中医药大学 3.温州市中医院
近三十年,随着生殖医学临床研究和生殖生物学基础研究的不断创新和进步[1],以体外受精-胚胎移植为代表的辅助生育技术已成为不孕症患者的常规治疗方式,并已取得明确疗效。通过辅助生殖技术诞生的婴儿数量急剧上升,大约占据发达国家新生儿数量的2%~5%[2]。体外受精-胚胎移植成功的重要前提是获得适量且高质量的卵母细胞,但38周岁以上的高龄女性容易出现卵巢储备功能下降(diminished ovarian reserve,DOR),卵巢内可利用的卵母细胞数量和质量均下降,控制性超促排卵常表现为卵巢反应低下、获卵少且质量不佳,从而导致妊娠率和活产率降低[3]。虽然有研究认为补充脱氢表雄酮(dehydroepiandrosterone,DHEA)可以延缓卵巢衰老,改善卵子质量[4],但这一结果仍存有争议[5]。因此,寻求安全、有效的药物改善高龄女性卵巢储备功能,是提高体外受精-胚胎移植成功率的关键所在[6]。
育麟方是浙江何氏妇科调经助孕的经验方,以“补肾益精养血”立法,治疗不孕症疗效显著。临床研究表明该方具有改善卵巢储备功能的作用[7],但具体机制仍尚未明确。本研究在前期实验[8-9]的基础上,以6~7月龄的C57BL/6J老龄雌性小鼠为对象,探究育麟方对老龄女性超促排卵的影响及相关作用机制。
1 材料和方法
1.1 实验动物 SPF级C57BL/6J健康雌性小鼠70只,6~7 月龄,体质量(29.27±0.91)g;SPF 级 C57BL/6J健康性成熟小鼠28只,6~8周龄,雌、雄各14只,体质量(18.09±0.17)g,均由北京维通利华实验动物技术有限公司提供 [实验动物生产许可证号:SCXK(京)2012-0001]。所有小鼠均饲养于浙江中医药大学动物中心SPF级动物房 [实验动物使用许可证号:SYXK(浙)2013-0184],均分笼饲养,每笼4~5只。自动控制12h/12h光/暗循环,相对湿度40%~50%,室温20~25℃。普通饲料喂养,自由摄食,充分给水,适应性饲养1周后用于实验。
1.2 实验药物与试剂 育麟方组成为菟丝子30g、枸杞子 12g、当归 10g、川芎 10g、熟地 10g、巴戟天 10g、肉苁蓉10g、仙灵脾15g、蛇床子6g、覆盆子15g、党参15g、炙甘草3g,以上药物均购自杭州市中医院。DHEA购自美国GNC公司(批号:54972B16);注射用人绒毛膜促性腺激素(human choionic gonadotophin,HCG)、注射用孕马血清促性腺激素(pregnant mare serum gonadotropin,PMSG)均购自宁波市三生药业有限公司(批号:B160702、S160907);改良人类输卵管液(modified human tubal fluid medium,mHTF)、人类输卵管液(human tubal fluid medium,HTF)、Serum Substitute Supplement(SSS;3S)均购于 Irvine Scientific 公司 (批号:90126170602、90125180920、99193);透明质酸酶购自 Sigma公司(批号:H4272);抗β-catenin抗体、抗Wnt4抗体均购于Abcam公司(批号:ab32572、ab91226);GAPDH(14C10)Rabbit mAb购于Cell Signaling Technology公司(批号:2118S)。
1.3 方法
1.3.1 动物分组 小鼠适应性饲养1周后采用“阴道脱落细胞涂片法”观察动情周期15d,参考缪晨韵等[10]的方法,采用随机数字表法将6~7月龄C57BL/6J雌性小鼠分为育麟方高剂量组、育麟方中剂量组、育麟方低剂量组、DHEA组、老龄对照组,另选择6~8周龄C57BL/6J雌性小鼠为青年对照组。每组小鼠14只,其中7只用于卵母细胞实验,余下7只用于体外受精实验。6~8周龄C57BL/6J雄性小鼠单独饲养,用于体外受精实验。
1.3.2 实验药物制备 育麟方浓缩液:取育麟方8剂(药材总重1 168g)加蒸馏水7 000mL,煎煮1h后过滤,药渣再加水7 000mL煎煮1h后过滤,合并两次滤液,加热挥发去多余水分,浓缩至700mL,冷却12h后分装至12支离心管,4 000r/min离心7min。取上层药液定容为 630mL,药物浓度为 1.85g·mL-1,4℃储存备用。1 000U PMSG溶于0.9%氯化钠溶液10mL中,配成浓度为100U·mL-1的PMSG溶液。1 000U HCG溶于0.9%氯化钠溶液10mL中,配成浓度为100U·mL-1的HCG溶液。mTHF与SSS以9:1的比例混合配成HEPES缓冲液。
1.3.3 给药与实验方法 根据魏伟等[11]所著《药理实验方法学》中“人和动物体表面积折算的等效剂量比率表”,计算育麟方的小鼠临床等效剂量。DHEA组根据成人口服剂量,予10.2mg/kg·d灌胃[12];育麟方高、中、低剂量组分别予成临床成人用药剂量的2、1、0.5倍,即生药 25.0g/kg·d、12.0g/kg·d、6.0g/kg·d 灌胃;青年对照组、老龄对照组均用蒸馏水0.2mL/10g·d灌胃,各组均连续灌胃40d。
所有小鼠灌胃第38天17:00腹腔注射10U PMSG,48h后腹腔注射10U HCG,16h后处死小鼠进行后续实验。
1.3.4 小鼠卵母细胞收集及计数 小鼠颈椎脱臼处死后,置于覆盖有干燥吸水纸的恒温板上。打开腹腔,充分暴露子宫、输卵管和卵巢后,分离双侧输卵管壶腹部,置于含HEPES缓冲液的无菌培养皿中备用。在体式显微镜下,以1mL注射器的针头轻轻划开输卵管壶腹部隆起处,暴露卵丘团。以200μL移液枪将卵丘团置入含有0.2%透明质酸酶的HEPES缓冲液中进行消化,5~10min后显微镜下计数消化好的卵母细胞数量。
1.3.5 小鼠体外受精与胚胎培养
1.3.5.1 备盘 实验前1d预先解冻HTF。准备好受精盘、培养盘,并放入恒温箱平衡。
1.3.5.2 雄鼠精子分离及活性观测 7只C57BL/6J雄性小鼠颈椎脱臼处死后开腹摘除附睾,清理干净后放入含有HTF的EP管,在培养箱中放置10min。用移液枪吸取EP管上1/3的液体,滴在培养皿盖子上,在倒置显微镜下观察精子密度和活力。取密度适中、活力佳的精子用于体外受精实验。
1.3.5.3 卵丘卵母细胞复合体(cumulus oocyte complex,COCs)获得 雌性小鼠处死后,开腹剥离卵巢与输卵管,剪下输卵管壶腹后用1mL注射器针头轻轻划开输卵管壶腹部隆起处,暴露白色絮状COCs。以200μL移液枪将COCs转移至受精盘中。
1.3.5.4 体外受精 取密度适中、活力佳的精子10μL,加入含有COCs的HTF受精滴中,置于37℃、5%CO2的胚胎培养箱中培养。6h后在体式显微镜下用口吸管捡卵,每个受精卵洗涤3遍后观察2原核。
1.3.6 小鼠卵巢的处理 将小鼠颈椎脱臼处死后打开腹腔,充分暴露子宫、输卵管和卵巢,摘取双侧卵巢,称重后放入干净灭菌的EP管中,-80℃保存,用于Western blot检测。
1.3.7 小鼠卵巢指数、成熟卵率、受精率计算 卵巢指数(%)=小鼠卵巢质量/体质量×100%。成熟卵率(%)=成熟卵数/卵母细胞数×100%;受精率(%)=受精卵数/成熟卵数×100%。
1.3.8 Western blot检测卵巢组织中Wnt4、β-catenin的蛋白表达 提取小鼠卵巢组织总蛋白,BCA法测蛋白浓度,变性后取30μg蛋白行SDS-PAGE凝胶电泳,湿法转膜,封闭 1h后加入一抗(1:1 000),4℃过夜。TBST洗膜3次后,加入二抗(1:5 000)室温孵育1h,TBST洗膜3次,ECL化学发光法曝光。以GAPDH(1:1 000)为内参,通过Image J软件分析光密度,计算目标蛋白与内参蛋白的灰度比值,进行半定量分析。
1.4 统计学分析 应用SPSS 22.0统计软件进行统计学分析,服从正态分布的计量资料以±s表示,满足方差齐性者,多组间采用One-way ANOVA检验;不服从正态分布采用 Kruskal-Wallis检验。计数资料组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠卵巢指数比较 与青年对照组比较,其余各组卵巢指数明显下降,差异具有统计学意义(P<0.01);与老龄对照组比较,育麟方高、中剂量组、DHEA组卵巢指数明显升高,差异具有统计学意义(P<0.05,P<0.01);与育麟方高剂量组比较,育麟方中、低剂量组、DHEA组明显降低,差异具有统计学意义(P<0.01)。见表 1。
表1 各组小鼠卵巢指数比较(±s)Tab.1 Comparison of ovarian indexes of mice in each group(±s)

表1 各组小鼠卵巢指数比较(±s)Tab.1 Comparison of ovarian indexes of mice in each group(±s)
注:与青年对照组比较,**P<0.01;与老龄对照组比较,▲P<0.05,▲▲P<0.01;与育麟方高剂量组比较,##P<0.01Note:Compared with young control group,**P<0.01;compared with aged control group,▲P<0.05,▲▲P<0.01;compared with Yulin formula high dose group,##P<0.01
7.80±0.56 2.97±0.42**3.68±0.21**▲▲##3.40±0.16**##3.48±0.51**▲##4.78±0.44**▲▲组别 n 小鼠体重(g) 卵巢重量(mg) 卵巢指数(%)青年对照组老龄对照组DHEA组育麟方低剂量组育麟方中剂量组育麟方高剂量组7 7 7 7 7 7 20.16±0.48 30.13±0.64 29.90±1.08 29.66±0.98 30.09±0.97 30.23±1.01 15.70±0.81 8.93±1.09 10.99±0.60 10.07±0.55 10.47±1.49 14.44±1.32
2.2 各组小鼠卵母细胞数量比较 与青年对照组比较,其余各组卵母细胞数量显著减少,差异具有统计学意义(P<0.01);与老龄对照组比较,育麟方高、中、低剂量组、DHEA组卵母细胞数量显著增多,差异具有统计学意义(P<0.05,P<0.01);与育麟方高剂量组比较,育麟方中、低剂量组、DHEA组卵母细胞数量均显著减少,差异具有统计学意义(P<0.05,P<0.01)。见表2。
2.3 各组小鼠成熟卵率与受精率比较 与青年对照组比较,其余各组小鼠成熟卵率显著降低,差异具有统计学意义(P<0.01);与老龄对照组比较,育麟方高剂量组小鼠成熟卵率增高,差异有统计学意义(P<0.05);与育麟方高剂量组比较,育麟方低剂量组成熟卵率降低,差异有统计学意义(P<0.05)。与青年对照组比较,其余各组受精率均显著降低,差异具有统计学意义(P<0.01);其余各组间比较,差异无统计学意义(P>0.05)。见表 3。
表2 各组小鼠卵母细胞数量比较(±s,个)Tab.2 Comparison of oocyte number of mice in each group(±s,number)
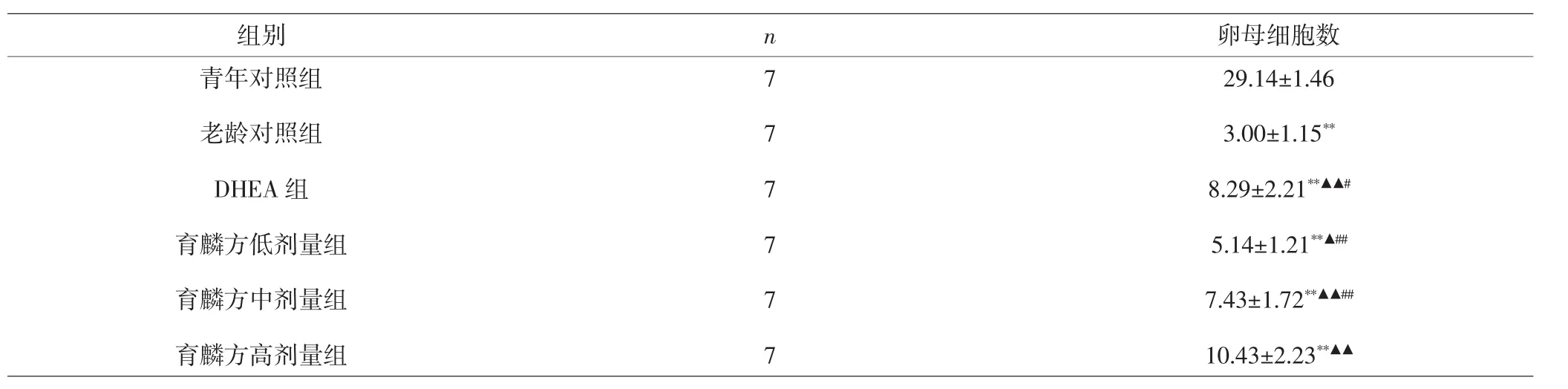
表2 各组小鼠卵母细胞数量比较(±s,个)Tab.2 Comparison of oocyte number of mice in each group(±s,number)
注:与青年对照组比较,**P<0.01;与老龄对照组比较,▲P<0.05,▲▲P<0.01;与育麟方高剂量组比较,#P<0.05,##P<0.01Note:Compared with young control group,**P<0.01;compared with aged control group,▲P<0.05,▲▲P<0.01;compared with Yulin formula high dose group,#P<0.05,##P<0.01
组别n 卵母细胞数29.14±1.46 3.00±1.15**8.29±2.21**▲▲#5.14±1.21**▲##7.43±1.72**▲▲##10.43±2.23**▲▲青年对照组老龄对照组DHEA组育麟方低剂量组育麟方中剂量组育麟方高剂量组7 7 7 7 7 7
2.4 各组小鼠卵巢β-catenin蛋白表达比较 与青年对照组比较,老龄对照组、育麟方中、低剂量组、DHEA组β-catenin表达明显下降,差异有统计学意义(P<0.01),育麟方高剂量组β-catenin表达则无统计学差异(P>0.05);与老龄对照组比较,育麟方高剂量组表达水平升高,差异有统计学意义(P<0.05);与育麟方高剂量组比较,育麟方中、低剂量组、DHEA组β-catenin表达均下降,差异有统计学意义(P<0.01,P<0.05)。见图 1。
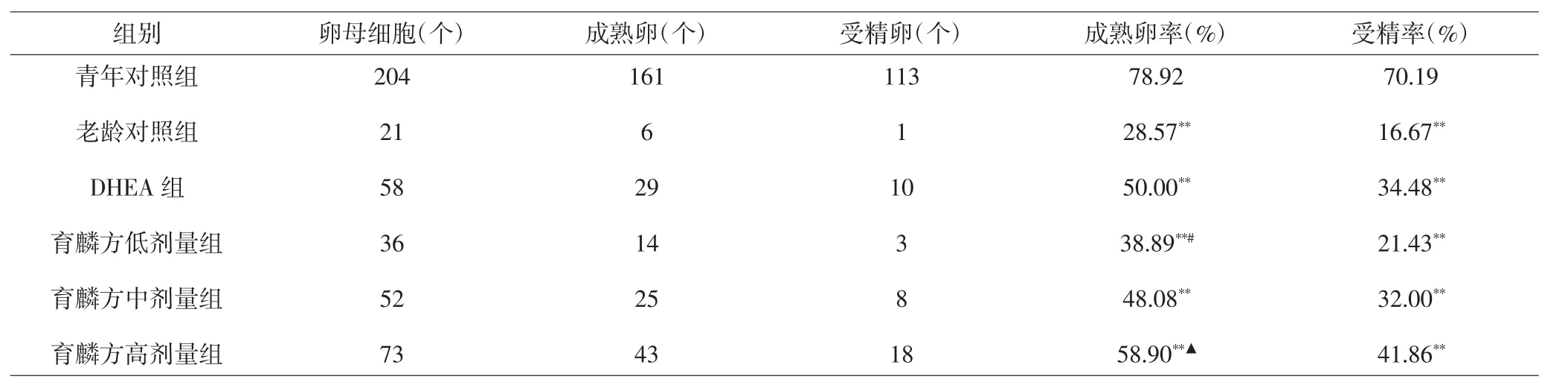
表3 各组小鼠成熟卵率与受精率比较Tab.3 Comparison of mature egg rate and fertilization rate of mice in each group
2.5 各组小鼠卵巢Wnt4蛋白表达比较 老龄对照组小鼠卵巢Wnt4蛋白表达略低于青年对照组,但差异无统计学意义(P>0.05),各组间比较,Wnt4蛋白表达差异无统计学意义(P>0.05)。见图2。
3 讨论
女性的年龄、移植胚胎阶段和数量是影响体外受精活产率的主要因素[13]。随着年龄的增长,女性卵巢储备功能逐渐下降,表现为月经周期紊乱伴随生育能力下降。即使采用体外受精治疗,也常表现为卵巢低反应[14],同时周期取消率高、临床妊娠率低、活产率更低。Devesa等[3]研究表明,38岁以后女性体外受精累积活产率显著下降,38~39岁为 25.9%、40~41岁为16.4%、42~43岁为 7%、44岁及以上为 1.2%[3]。DOR主要表现为卵子数量和质量的双重下降,因此,如何改善老龄女性的DOR,提高卵母细胞数量和质量是目前生殖医学领域研究热点。
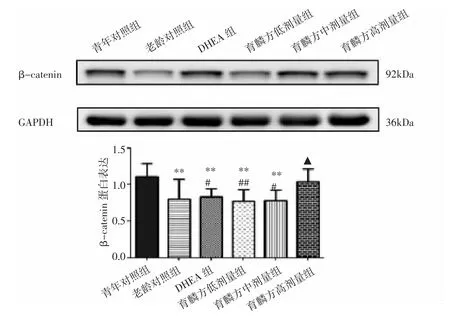
图1 各组小鼠卵巢β-catenin蛋白表达比较Fig.1 Comparison of expression of β-catenin protein in ovaries of mice in each group

图2 各组小鼠卵巢Wnt4蛋白表达比较Fig.2 Comparison of expression of Wnt4 protein in ovaries of mice in each group
本研究采用的C57BL/6J小鼠是1975年我国从日本国立肿瘤研究所引进的近交系动物,青年C57BL/6J雌性小鼠单次产仔数为 6~7只,12月龄就不再产仔,其生育能力较其他品系小鼠低下[15],因此常被用于DOR、卵巢早衰(premature ovarian failure,POF)等生殖功能相关研究。前期实验发现6~7月龄C57BL/6J雌性小鼠不但表现为动情周期延长、动情频率下降,而且血清抗苗勒管激素水平下降,卵巢石蜡染色切片表现为卵巢萎缩,髓质组织多,卵泡数目少,颗粒细胞层数减少,排列稀疏且闭锁卵泡较多[10]。本实验中,老龄对照组小鼠卵巢指数显著低于青年对照组,每只小鼠获得卵母细胞数量也显著少于青年对照组。根据卵周隙与第一极体形态建立的评价体系是目前公认的卵母细胞质量评价指标[16]。根据该方法,本研究中形态学观察提示,老龄对照组卵母细胞中未成熟卵、碎卵明显增多,成熟卵率显著低于青年对照组小鼠,直接导致受精率显著降低。
DOR表现为月经周期紊乱、生育能力下降,其临床表现隶属于中医“月经失调”“不孕症”等范畴。肾为先天之本,主生殖,是女性“肾-天癸-冲任-胞宫生殖轴”的基础,因此,补肾填精是治疗DOR的主要治则。育麟方是何氏妇科经验方,由武之望[17]所著的《济阴纲目》中苁蓉菟丝丸加减化裁而成,方以菟丝子、仙灵脾为君,补肾填精、温补肾阳;枸杞子、覆盆子、肉苁蓉、巴戟天为臣,补肝肾、益精血;当归、川芎、熟地、蛇床子为佐药,取其“四物汤”之意,补血调血。全方以补肾填精、健脾养血为主,临床研究表明具有改善卵巢功能的作用[7]。动物实验证实,高剂量育麟方可以显著改善老龄小鼠动情周期,提高血清抗苗勒管激素水平,增加卵巢内初级卵泡及总卵泡数[10]。DHEA由肾上腺皮质和卵巢合成,是多种激素的前体物质,具有多向性的激素缓冲作用,能双向调节女性生殖内分泌水平,改善卵巢微环境。研究表明,在体外受精前以DHEA预处理,可以提高DOR患者卵泡微环境中抗苗勒管激素等物质水平,从而提高优质胚胎率,改善妊娠率[18-19]。本实验发现,高剂量育麟方可提高老龄小鼠卵巢指数,增加卵母细胞数量和成熟卵率,疗效优于DHEA。由于老龄小鼠在促排卵后所获卵母细胞数量极少,虽然育麟方治疗后老龄对照组小鼠受精率有上升的趋势,但各治疗组间无统计学差异。若能进一步扩大实验小鼠数量,或者统一各组间成熟卵数后进行体外受精率比较结果可能更理想。
β-连环蛋白(β-catenin)作为 Wnt/β-catenin信号通路的核心成分,具有参与黏附连接形成,促进细胞迁移和细胞间交流,促进细胞增殖、分化、凋亡等作用。在小鼠始基卵泡、初级卵泡、次级卵泡、小窦状卵泡、闭锁卵泡中都有不同程度的表达[20]。Prunskaitehyyryl inen等[21]研究认为,β-catenin通过促进颗粒细胞增殖等方式参与卵泡的生长发育。本研究发现,βcatenin在老龄小鼠卵巢中表达显著降低,而育麟方可以提高β-catenin的蛋白表达,且呈浓度相关性,表明育麟方可能通过调节β-catenin表达影响卵泡生长发育。有研究表明Wnt信号通路与女性生殖功能密切相关[22],影响性腺细胞增殖和分化[23];Wnt4在卵巢颗粒细胞中显著表达,参与苗勒管发育和卵巢激素生物合成的调节[24]。尽管有证据表明Wnt信号通路通过β-catenin在人类的卵泡形成和发育过程中起作用,但原始卵泡与优势卵泡中Wnt4蛋白表达并无明显差异[25],敲除Wnt4基因也并不影响成年小鼠卵巢中原始、初级、次级、小窦状卵泡的数量以及排卵率[26]。本研究也显示各组小鼠卵巢组织Wnt4蛋白表达无统计学差异,与上述研究结果一致。因此,本研究虽然证实育麟方通过影响β-catenin表达参与卵泡生长发育的调控,但其上游影响位点有待进一步研究。
中医药在辅助生殖中的应用已取得较好的临床疗效,但具体作用机制仍未阐释清楚。本实验提示育麟方通过影响卵巢内β-catenin表达,参与调控卵泡生长发育,从而改善卵巢生殖功能,对于老龄小鼠可以提高促排卵获卵数量和质量,进而提高体外受精率,但具体作用途径有待进一步研究。
