基于Wnt/β-catenin信号通路探讨复方土贝母对裸鼠乳腺癌移植瘤的影响
2019-03-27董晶王邦才施航凌仕良史国军王泽时指导
董晶王邦才施航凌仕良史国军王泽时(指导)
1.浙江中医药大学附属宁波市中医院 宁波 315010 2.浙江中医药大学
乳腺癌近年来发病率呈升高趋势,且逐渐年轻化[1],乳腺癌内科治疗包括化疗、内分泌治疗、分子靶向治疗等,虽治疗方法众多,但复发转移仍是影响患者长期生存的最不利因素[2],因此深入了解乳腺癌复发转移的相关分子机制是提高患者长期生存率的关键。复方土贝母是我科的经验方,我科将该方联合化疗应用于晚期三阴性乳腺癌及晚期内分泌耐药乳腺癌并开展了临床试验,结果证明对防治乳腺癌复发转移具有良好疗效,相关数据已统计并拟发表。Wnt/βcatenin信号通路是近年来研究的热门领域[3-4],研究证实其与肝癌、胃癌、胰腺癌、结直肠癌、前列腺癌等多种恶性肿瘤的发生、侵袭转移及预后密切相关[5-6],但对乳腺癌的相关研究报道较少[7],本实验从Wnt/βcatenin信号通路角度研究复方土贝母抑制乳腺癌细胞生长的机制,以期为中医药防治乳腺癌复发转移提供新的思路。
1 材料和方法
1.1 细胞株和实验动物 人乳腺癌细胞株MCF-7由浙江中医药大学动物实验中心提供。4~5周龄SPF级BALB/C雌性裸鼠40只,体质量18~20g/只,购于上海西普尔-必凯实验动物有限公司 [实验动物生产许可证号:SCXK(沪)2013-0016]。所有动物均饲养于浙江中医药大学动物实验中心[实验动物使用许可证号:SYXK(浙)2013-0184]SPF级层流架中,笼具、垫料、饮水、饲料均经灭菌处理,饲养和实验处理按照无菌操作规范操作,正式实验前适应性饲养3d。
1.2 实验用药 复方土贝母原方:土贝母30g,冬凌草 30g,苦参 10g,薏苡仁 30g,党参 20g,白术 20g,药物购自浙江中医药大学附属宁波市中医院中药房,并由医院制剂室制取。上述药物加入10倍药量的水煎煮2次,时间分别为2、1.5h,合并2次滤液,浓缩至 0.5、1.0、2.0g·mL-1,灭菌后 4℃储存备用。
1.3 主要试剂 RPMI 1640培养基、高糖DMEM培养基、胰蛋白酶购于美国Gibco公司(批号:1803280506、1712210608、1802040106);新生牛血清为杭州四季青生物工程有限公司产品(批号:22011-861218030302);PBS缓冲液购于杭州科易生物技术有限公司(批号:20180303-0515);RNA提取试剂盒、逆转录试剂盒、SYBR Green荧光定量PCR染料均购于 TaKaRa公司(批号:AK1401、AK5101、AK9802);蛋白提取试剂盒购于南京凯基生物公司(批号:20180317);预染蛋白marker购于Thermo公司(批号:00580081);近红外染料标记的二抗购于Li-COR公司(批号:C70426-05);β-catening一抗购于 Proteintech公司(批号 51067-2-AP);E-cadherin(4A2)一抗、Vimentin(D21H3)均购于 CST 公司(批号:13、3)。
1.4 主要仪器设备 Forma 3111型细胞培养箱购于Thermo公司;Axiovert 200型荧光倒置显微镜为德国蔡司公司产品;FRESCO 17型冷冻高速离心机购于Thermo scientific公司;StepOne Plus荧光定量PCR仪为ABI公司产品;NanoDrop 2000微量核酸测定仪购于Thermo公司;Odyssey Clx近红外双色激光成像系统为美国LI-COR公司产品。
1.5 方法
1.5.1 建立裸鼠MCF-7移植瘤模型 MCF-7细胞株以DMEM高糖培养基于CO2培养箱中传代培养,隔天换液。传代3次后,将对数生长期的细胞以胰蛋白酶消化,PBS洗涤后制成1×107/mL单细胞悬液,无菌条件下接种于40只雌性BALB/C裸鼠背部皮下,接种剂量0.2mL/只。
1.5.2 实验分组及给药 将造模后的BALB/C裸鼠随机分为4组,即荷瘤对照组、复方土贝母低、中、高剂量组。所有小鼠均从造模当天开始连续灌胃30d,荷瘤对照组每天以0.9%氯化钠溶液灌胃,复方土贝母各剂量组予相应浓度复方土贝母灌胃。灌胃容积均为0.6mL/20g。人与20g小鼠等效剂量换算系数取0.0026,即低、中、高剂量组分别相当于人的等效剂量的 1、2、4 倍[8],具体剂量为 0.5、1.0、2.0g·mL-1。
1.5.3 移植瘤体积及抑瘤率的测算 所有裸鼠第30天以颈椎脱臼法处死,完整剥取瘤体。用游标卡尺测量肿瘤最长径(D)和垂直方向的最大横径(d),通过公式计算移植瘤体积,移植瘤体积 V(mm3)=d2×D/2[9]。抑瘤率=(荷瘤对照组平均移植瘤体积-土贝母各剂量组平均移植瘤体积)/荷瘤对照组平均移植瘤体积×100%。
1.5.4 实时荧光定量PCR检测瘤体β-catenin、E-cadherin、Vimentin的mRNA表达 将各组瘤体组织碾磨匀浆,RNA提取试剂提取总RNA后,按逆转录试剂盒说明书操作,逆转录为cDNA,用ABI 7500 Fast PCR仪进行扩增反应。反应条件如下:预变性:95℃30s;PCR 反应:83.6℃ 5s,83.75℃ 30s,共 40 个循环。采用GAPDH作为内参,以荷瘤对照组作为基准,根据2-△△Ct法计算获得各组基因相对表达量。引物购自美国invitrogen公司。序列见表1。
1.5.5 Western blot检测瘤体 β-catenin、E-cadherin、Vimentin蛋白表达 将各组瘤体组织碾磨匀浆,提取总蛋白,以Bradford法检测蛋白浓度,行聚丙烯酰胺凝胶电泳(80V 20min,120V 90min),200mA 电转膜2h,一抗、二抗孵育后,使用ECL发光液显色,X线定影后,对胶片进行扫描,用Image-Pro Plus 6.0图像处理软件分析目的蛋白条带及β-actin内参条带的平均光密度值,以两者比值代表蛋白的相对表达量。

表1 引物序列Tab.1 Primer sequences
1.5.6 免疫组化检测瘤体β-catenin、E-cadherin、Vimentin蛋白表达 将瘤体组织取材、固定、脱水、浸蜡、包埋、切片后,将切片于60℃烤片2h,二甲苯脱蜡,100%、95%、80%梯度乙醇脱水。在切片上滴加3%的H2O2避光孵育20min,PBS洗涤3次。切片上滴加一抗,37℃孵育60min,弃去一抗,PBS洗涤5min×3次。滴加二抗,室温孵育2h后弃去二抗。PBS漂洗后,DAB显色1~2min,复染、透明后封片。共40张切片,每张切片选择代表性的区域,在400倍视野下观察拍照,共计5个视野,采用半定量法判定蛋白表达等级并取其平均值。即分别对镜下阳性细胞的百分比和染色强度评分。阳性细胞百分比:0%计为0分,1%~25%计为1分,26%~50%计为2分,51%~75%计为3分,76%~100%计为4分;染色强度:无色计为0分,淡黄色计为1分,棕黄色计为2分,棕褐色计为3分。两者计分相乘即为表达等级:0~4分为低表达,5~12分为高表达。计算各组高表达和低表达比例。
1.6 统计学分析 应用SPSS 21.0统计软件进行统计学分析。计数资料组间比较采用χ2检验;计量资料以±s表示,多样本均数组间比较采用单因素方差分析,方差齐时,采用 LSD-t法;方差不齐时采用 Dunnettt’s T3法。以P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠移植瘤体积及抑瘤率比较 MCF-7细胞接种后的第6天,小鼠背部皮下可以触摸到移植瘤体,实验过程中见复方土贝母中、高剂量组裸鼠移植瘤体生长相对缓慢。给药30d后,复方土贝母中、高剂量组平均移植瘤体积小于荷瘤对照组,差异有统计学意义(P<0.05),低剂量组平均移植瘤体积也小于荷瘤对照组,但差异无统计学意义(P>0.05),高剂量组平均移植瘤体积与中剂量组比较,差异无统计学意义(P>0.05)。中、高剂量组抑瘤率高于低剂量组。见表2。
2.2 各组小鼠瘤组织中 β-catenin、E-cadherin、Vimentin mRNA相对表达量比较 复方土贝母低、中、高剂量组β-catenin、Vimentin mRNA相对表达量较荷瘤对照组显著降低,E-cadherin mRNA相对表达量较荷瘤对照组显著提高,差异有统计学意义(P<0.05)。复方土贝母各剂量组间比较,3种mRNA相对表达量差异无统计学意义(P>0.05)。见表3。
表2 各组小鼠移植瘤体积和抑瘤率比较(±s)Tab.2 Comparison of the tumor volumes and inhibition rates in each group(±s)

表2 各组小鼠移植瘤体积和抑瘤率比较(±s)Tab.2 Comparison of the tumor volumes and inhibition rates in each group(±s)
注:与荷瘤对照组比较,*P<0.05Note:Compared with tumor control group,*P<0.05
组别 n 移植瘤体积(mm3) 抑瘤率(%)复方土贝母低剂量组复方土贝母中剂量组复方土贝母高剂量组荷瘤对照组10 10 10 10 2 993.97±1 408.36 2 106.79±799.47*2 237.25±1 002.86*3 347.49±1 443.22 10.56 37.06 33.17-
2.3 各组小鼠瘤组织中 β-catenin、E-cadherin、Vi-mentin蛋白表达比较 复方土贝母中、高剂量组βcatenin、Vimentin蛋白表达量低于荷瘤对照组,差异有统计学意义(P<0.05),提示该组瘤组织中β-catenin、Vimentin蛋白表达减弱;低剂量组β-catenin、Vimentin蛋白表达量与荷瘤对照组比较,差异无统计学意义(P>0.05)。复方土贝母中、高剂量组E-cadherin蛋白表达量高于荷瘤对照组,差异有统计学意义(P<0.05),提示该组瘤组织中E-cadherin蛋白表达增强;低剂量组E-cadherin蛋白表达量与荷瘤对照组比较,差异无统计学意义(P>0.05)。中、高剂量组间比较,3种蛋白表达差异均无统计学意义(P>0.05)。见表 4、图 1。
2.4 各组小鼠瘤体β-catenin、E-cadherin、Vimentin蛋白表达 荷瘤对照组β-catenin高表达比例100%,复方土贝母低剂量组高表达比例为90%,中剂量组为50%,高剂量组为40%。与荷瘤对照组比较,复方土贝母中、高剂量组β-catenin高表达比例明显减低,差异有统计学意义(P<0.05),而低剂量组高表达比例差异无统计学意义(P>0.05)。荷瘤对照组E-cadherin高表达比例10%,复方土贝母低剂量组高表达比例为30%,中剂量组为80%,高剂量组为90%。与荷瘤对照组比较,复方土贝母中、高剂量组E-cadherin高表达比例明显增高,差异有统计学意义(P<0.05),而低剂量组高表达比例差异无统计学意义(P>0.05)。荷瘤对照组Vimentin高表达比例100%,复方土贝母低剂量组高表达比例为80%,中剂量组为30%,高剂量组为20%。与荷瘤对照组比较,复方土贝母中、高剂量组Vimentin高表达比例明显减低,差异有统计学意义(P<0.05),而低剂量组高表达比例差异无统计学意义(P>0.05)。见图2-4。
表3 各组小鼠瘤组织β-catenin、E-cadherin、Vimentin mRNA相对表达量比较(±s)Tab.3 Comparison of relative expression of β-catenin,E-cadherin,Vimentin mRNA in each group(±s)
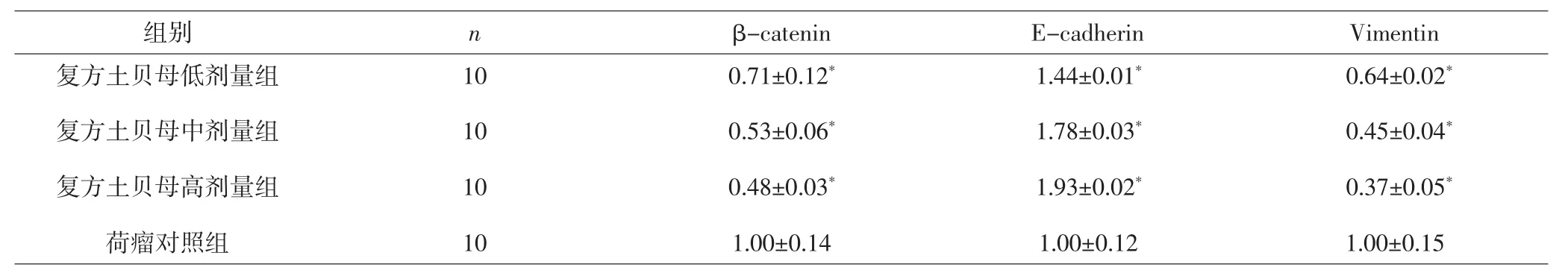
表3 各组小鼠瘤组织β-catenin、E-cadherin、Vimentin mRNA相对表达量比较(±s)Tab.3 Comparison of relative expression of β-catenin,E-cadherin,Vimentin mRNA in each group(±s)
注:与荷瘤对照组比较,*P<0.05Note:Compared with tumor control group,*P<0.05
组别 n β-catenin E-cadherin Vimentin复方土贝母低剂量组复方土贝母中剂量组复方土贝母高剂量组荷瘤对照组0.64±0.02*0.45±0.04*0.37±0.05*1.00±0.15 10 10 10 10 0.71±0.12*0.53±0.06*0.48±0.03*1.00±0.14 1.44±0.01*1.78±0.03*1.93±0.02*1.00±0.12
表4 各组小鼠瘤组织中β-catenin、E-cadherin、Vimentin蛋白表达比较(±s)Tab.4 Comparison expression of β-catenin,E-cadherin,Vimentin protein in each group(±s)
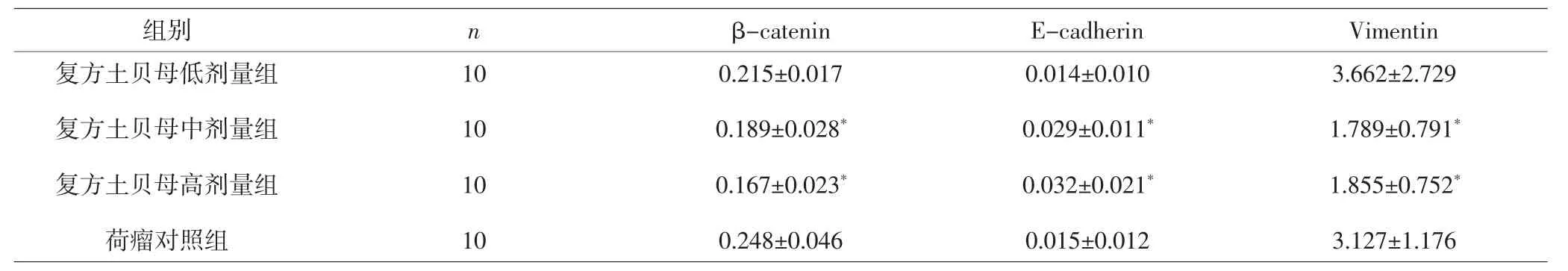
表4 各组小鼠瘤组织中β-catenin、E-cadherin、Vimentin蛋白表达比较(±s)Tab.4 Comparison expression of β-catenin,E-cadherin,Vimentin protein in each group(±s)
注:与荷瘤对照组比较,*P<0.05Note:Compared with tumor control group,*P<0.05
组别 n β-catenin E-cadherin Vimentin复方土贝母低剂量组复方土贝母中剂量组复方土贝母高剂量组荷瘤对照组3.662±2.729 1.789±0.791*1.855±0.752*3.127±1.176 10 10 10 10 0.215±0.017 0.189±0.028*0.167±0.023*0.248±0.046 0.014±0.010 0.029±0.011*0.032±0.021*0.015±0.012
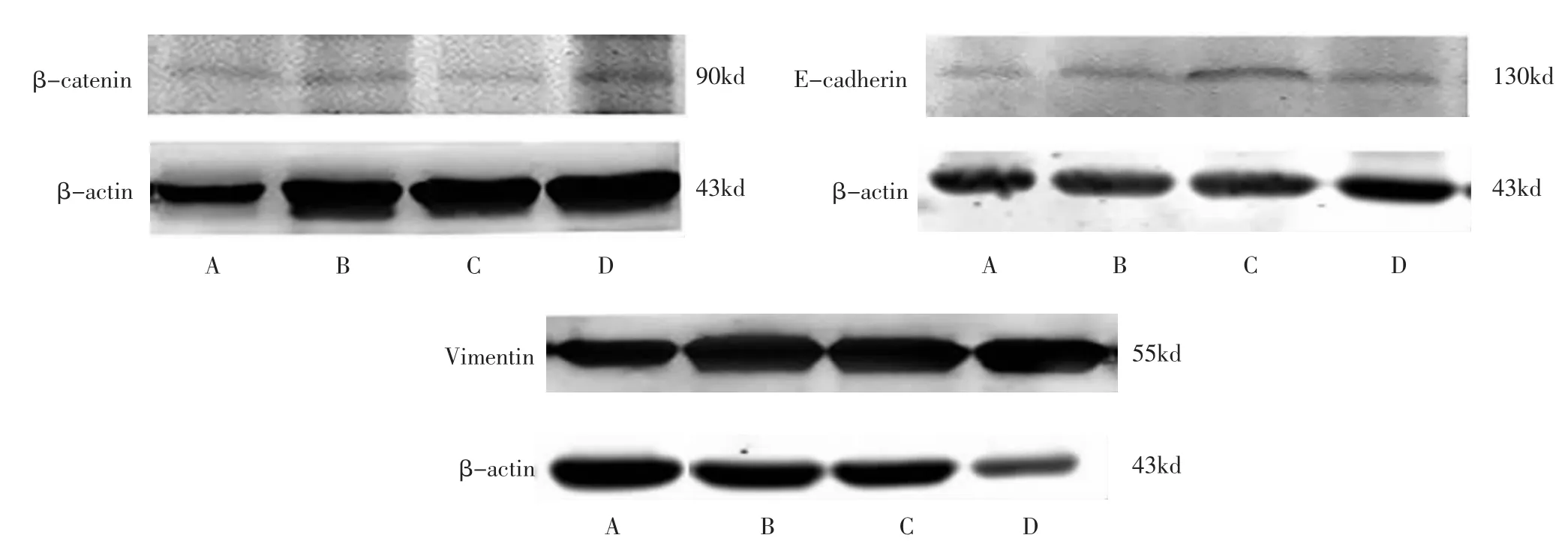
图1 各组小鼠瘤组织中β-catenin、E-cadherin、Vimentin蛋白表达比较Fig.1 Comparison of expression of β-catenin,E-cadherin,Vimentin protein in each group
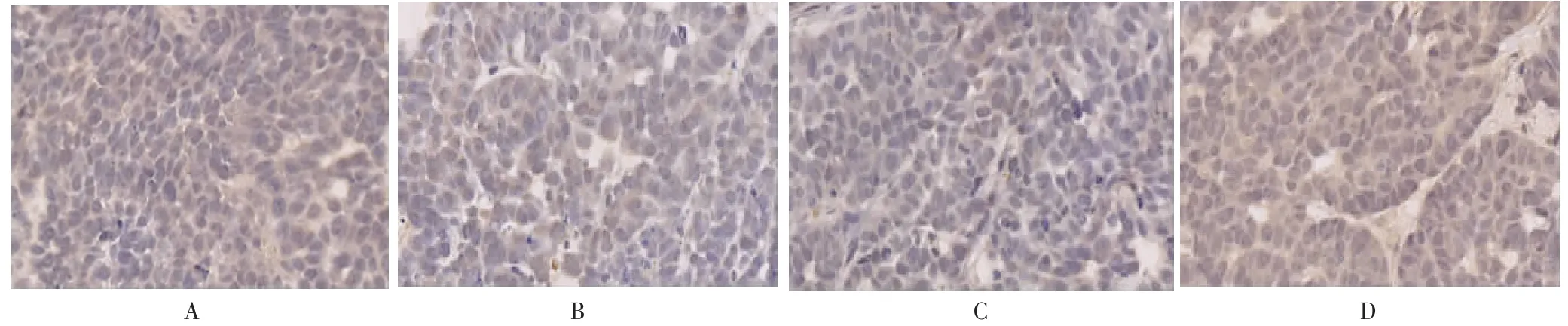
图2 各组小鼠瘤体中β-catenin蛋白的表达(400×)Fig.2 Expression of β-catenin protein in each group(400×)
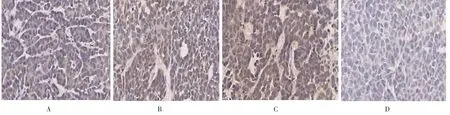
图3 各组小鼠瘤体中E-cadherin蛋白的表达(400×)Fig.3 Expression of E-cadherin protein in each group(400×)
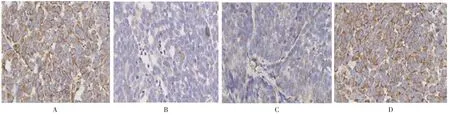
图4 各组瘤体中Vimentin蛋白的表达(400×)Fig.4 Expression of Vimentin protein in each group(400×)
3 讨论
乳腺癌属于中医学“乳岩”“乳石痈”范畴。《诸病源候论·石痈候》云:“有下于乳者,其经虚,为风寒阿气客之,则血涩结成痈肿,但结核如石,谓之石痈。”[10]《外科正宗》云:“忧郁伤肝,思虑伤脾,积想在心,所愿不得者,致经络痞涩,聚结成核。”[11]说明在正气不足的情况下,外邪可客于乳络,或由于情志内伤导致肝郁脾虚、气滞痰凝、邪毒内蕴而发病,因此,“扶正祛邪”法应贯穿乳腺癌治疗的始终。复方土贝母是我院肿瘤科治疗乳腺癌的经验方,由土贝母、冬凌草、苦参、薏苡仁、党参、白术组成,其中土贝母、冬凌草化痰解毒抗癌为君,苦参、薏苡仁清热利湿为臣,党参、白术健脾益气为佐,诸药配伍紧扣“健脾益气、化痰解毒”的中医治则。该方中土贝母皂苷具有抑制乳腺癌细胞增殖的作用[12];冬凌草甲素能诱导肿瘤细胞凋亡,降低端粒酶活性,抑制肿瘤细胞DNA、RNA和蛋白质合成等[13],还能下调 MCF-7 细胞 Wnt4、GSK3β、βcatenin表达量[14];苦参碱能干扰细胞周期,下调血管内皮生长因子(vascular endothelial growth factor,VEGF)和VEGFR-2表达[15];薏苡仁中多糖葡聚糖混合物及酸性多糖Ⅱa-1、2、3,Ⅱb部分均显示抗补体活性[16]1285;党参、白术有增强体液、细胞免疫功能,提高巨噬细胞吞噬能力及自然杀伤细胞活性[16]1031,447。
上皮-间充质转化(epithelial-mesenchymal transition,EMT)与肿瘤增殖转移密切相关[17],该过程能诱导肿瘤细胞干细胞化[18],引起肿瘤化疗抵抗[19]。EMT主要分子特征有细胞上皮表型如E-cadherin、密封蛋白(occludin)表达下降或缺失,间质表型如Vimentin、N-钙粘蛋白(N-cadherin)表达增强[20]。研究发现,E-cadherin介导细胞间黏附,维持细胞结构和形态稳定,其缺失是上皮肿瘤细胞侵袭的前提条件;E-cadherin表达降低引起细胞间粘附性下降,继而细胞脱落扩散,造成肿瘤细胞转移[17]。Vimentin存在于间充质细胞中,作为细胞骨架支撑维持细胞形态,在肿瘤细胞迁移黏附中发挥作用[20]。
Wnt/β-catenin信号通路是EMT最主要诱因之一[21]。此通路中β-catenin是关键蛋白,其表达增加可抑制E-cadherin表达,增加Vimentin表达,最终介导肿瘤细胞EMT[20]。当β-catenin积累到一定水平后可直接进入细胞核,与细胞核内转录因子T细胞生长因子 4(T cell factor4,TCF4)/淋巴增强因子(lymphoid enhancer-binding factors,LEFs) 结 合 , 激 活 下 游CD44、c-myc、细胞周期蛋白Cyclin D1等基因表达和转录,导致细胞异常增殖[20-21]。有研究证实,中药可影响Wnt/β-catenin信号通路中相关蛋白的表达[22]。
本研究结果表明,复方土贝母中、高剂量组移植瘤体积小于荷瘤对照组。各剂量组瘤体中β-catenin、Vimentin mRNA表达也低于荷瘤对照组,E-cadherin mRNA表达高于荷瘤对照组,差异均有统计学意义,证明复方土贝母各剂量组均能抑制β-catenin、Vimentin mRNA表达,促进E-cadherin mRNA表达。中、高剂量组E-cadherin蛋白表达高于荷瘤对照组,而β-catenin、Vimentin蛋白表达低于荷瘤对照组,证明中、高剂量组上调了E-cadherin蛋白表达,下调了β-catenin、Vimentin蛋白表达。分子层面微观结果符合宏观所见抑瘤效果,提示复方土贝母能通过调节Wnt/β-catenin信号通路而抑制肿瘤增殖。值得注意的是,复方土贝母低剂量组β-catenin、Vimentin mRNA表达低于荷瘤对照组,E-cadherin的mRNA表达高于荷瘤对照组,而三者蛋白表达与荷瘤对照组无统计学差异,可能由于实验方法对mRNA含量敏感度更高所致。关于复方土贝母浓度与疗效的相关性,尚需进一步临床实验证实。
本研究为复方土贝母的临床应用提供了一定的实验基础,不足之处在于实验动物数量较少,在后续研究中将扩大样本量,并进一步行体外实验印证结果;在临床研究方面,拟与化疗药物联用,从更多角度评价其疗效。
