急诊抢救脑桥外髓鞘溶解症1例
2019-03-26焦清海
李 丹 焦清海 苏 伟
邯郸市第一医院急危重症病区,河北 邯郸 056000
脑桥中央髓鞘溶解症(centralpontine myelinolysis,CPM)是颅脑渗透压迅速改变导致脑桥基底部对称性脱髓鞘病变的中枢神经系统疾病,主要病理特征为脑桥髓鞘溶解,累及脑桥中央即为CPM,累及丘脑、基底节、大小脑的灰白质联合等脑桥以外区域称为脑桥外髓鞘溶解(extrapontine myelinolysis,EPM)。1950年ADAMS 和VICTOR[1]首次报道脑桥中央髓鞘溶解症( central pontine myelinolysis,CPM)。CPM/EPM病理特征为脑桥/桥外部的神经纤维脱髓鞘,神经细胞和轴索相对完好,不伴炎症反应,与多发性硬化等脱髓鞘病理基础不同。CPM/EPM不单纯属于神经内科领域治疗范畴,后期并发症处理,肠内/外营养支持,高级生命支持,如气管插管、呼吸机、床旁血浆置换,均涉及到ICU治疗。关于严重低钠血症精准补钠速度方面的研究需要更多的循证医学证据。本文报告1例因严重低钠血症导致的EPM,并进行文献复习。
1 临床资料
患者 男,59岁,主因“周身无力7 d,加重伴意识不清1 d”于2018-01-21就诊邯郸市第一医院急诊科,既往有“慢性肾炎”病史5 a,间断口服中药治疗。入院前7 d患者劳累后出现周身乏力,言语不清,行走不稳,进食减少,无头痛、恶心、呕吐,于2018-01-16就诊当地县医院,行颅脑CT 检查未见明显异常,查电解质:钾2.44mmol/L,钠100.30 mmol/L,氯63.8 mmol/L;诊断:电解质紊乱 低钾低钠低氯血症。给予补充电解质治疗(具体情况不详)后,电解质较前恢复,1 d前患者突发四肢全瘫,言语不能,伴发热,体温波动在37.5~38 ℃,无口吐白沫及肢体抽搐,近期进食差,神志恍惚,意识不清,120送至我院EICU,院前急救时检查:T 37 ℃,P 97次/min,R 21次/min,Bp 134/81 mmHg,神志模糊,言语不能,伸舌不能,眼球固定,未见各方向自主运动,双侧瞳孔直径均为3 mm,对光反射灵敏,双眼睑闭合力弱,胸廓畸形伴脊柱侧弯,双肺呼吸音粗,可闻及痰鸣音,心率97次/min,心律不齐(房早),各瓣膜听诊区未闻及明显杂音,腹平软,按压无痛苦表情,肠鸣音弱。四肢肌张力低,四肢肌力体格检查不能配合,四肢疼痛刺激未见回缩,双Babinski征阴性。深、浅感觉及共济运动不能查(Glasgow评分3分)。入院前患者电解质变化情况见表1。
2 诊治经过
2018-01-21患者入院时完善相关实验室检查,寻找意识不清原因,急查心电图(2018-01-21):窦性心动过速,偶发房早。入院时动脉血气分析(2018-01-21):pH 7.38,PCO247 mmHg,PO260 mmHg,Lac 0.5 mmol/L,BE 2.7 mmol/L。肝功能+电解质:钾:3.39 mmol/L,钠132.7 mmol/L,氯103.2 mmol/L,钙1.58 mmol/L,总蛋白31.3 g/L,白蛋白22.0 g/L。再次复查颅脑CT未见出血。结合患者入院前血钠变化情况,脑桥脱髓鞘待除外。患者血钾钠氯钙低水平,给予适当补充。经验性给予补钠治疗,补钠速度1 h不超过1 mmol/L,24 h不超过10 mmol/L。2018-01-22患者出现持续呻吟状态,无法言语,可见眼球少量活动,四肢未见自主活动,再次查血气分析大致正常,血常规:白细胞 11.68×109个/L,红细胞3.24×109个/L,血红蛋白94.00×109个/L,血小板286.00×109个/L,C反应蛋白44.95 mg/L。降钙素原PCT:0.13 ng/mL,正常。甲八项:抗甲状腺球蛋白抗体,正常;抗甲状腺过氧化物酶抗体,正常;游离三碘甲状腺素<1.00 pg/mL;游离甲状腺素0.4 ng/dL↓;总T3<0.25 ng/mL↓;总T4 3.07 μg/dL↓;促甲状腺素,正常;反三碘甲状腺原氨酸0.17 ng/mL↓。肿瘤系列:癌胚抗原7.13 ng/mL;血清CA12-5 241.5 U/mL;血清铁蛋白337.84 ng/mL。患者胸廓畸形伴脊柱侧弯,行腰穿穿刺点定位于胸椎侧弯曲度下缘第3~4个椎间隙,脑脊液清亮,测压160 cmH2O,脑脊液常规未见异常。脑脊液生化:Glu 5.16 mmol/L,谷草转氨酶30 U/L,微量蛋白0.1 g/L,腺苷转氨酶10.9 U/L。脑脊液免疫球蛋白:Ig-G<9.26 mg/L,Ig-A 1.03 mg/L,Ig-M 1.12 mg/L,均在正常范围。患者意识不清,仅有眼球少量活动,临床表现闭锁综合征特点。结合脑脊液实验室检查暂排除中枢神经系统感染可能。2018-01-23患者出现明显喘息,有痰,不能自行咳出,呼吸费力,给予保护性经口气管插管,引出大量白色黏痰,间断给予呼吸机辅助呼吸,呼吸机模式为自主呼吸模式,后患者喘息症状好转。2018-01-24患者呼之睁眼,可遵循医嘱眼球仅能向上运动,可完成闭眼动作,体温38.5 ℃,考虑深部痰液引流不畅所致,四肢软瘫状态,疼痛刺激仍未见回缩。颅脑MRI报告结果(图1):两侧尾状核头及两侧壳核呈对称性等T1稍长T2信号,DWI呈稍高信号。两侧尾状核头部及两侧壳核对称性稍高信号,结合临床考虑脑桥外髓鞘溶解症。肌电图:双上肢周围神经异常(感觉及运动神经均受损,轴索损伤为主),双下肢未见明显异常,F波引发频率降低,乃至完全脱失。脑干听觉诱发电位:双侧外周段未见异常,中枢段未见明显异常。分别请我院神经内科及解放军总医院吴卫平主任医师远程会诊后,考虑脑桥外髓鞘溶解综合征,需复查脑脊液除外吉兰-巴雷综合征。给予患者对症支持治疗4 d后,患者意识清楚,能完成闭眼动作及眼球上下运动,由于经济原因2018-01-25自动出院,于2018-01-28死亡。

表1 入院前患者电解质变化情况 (mmol/L)
注:2018-01-20—2018-01-21血钠水平升高幅度为8.2 mmol/L,两次测量时间间隔<24 h
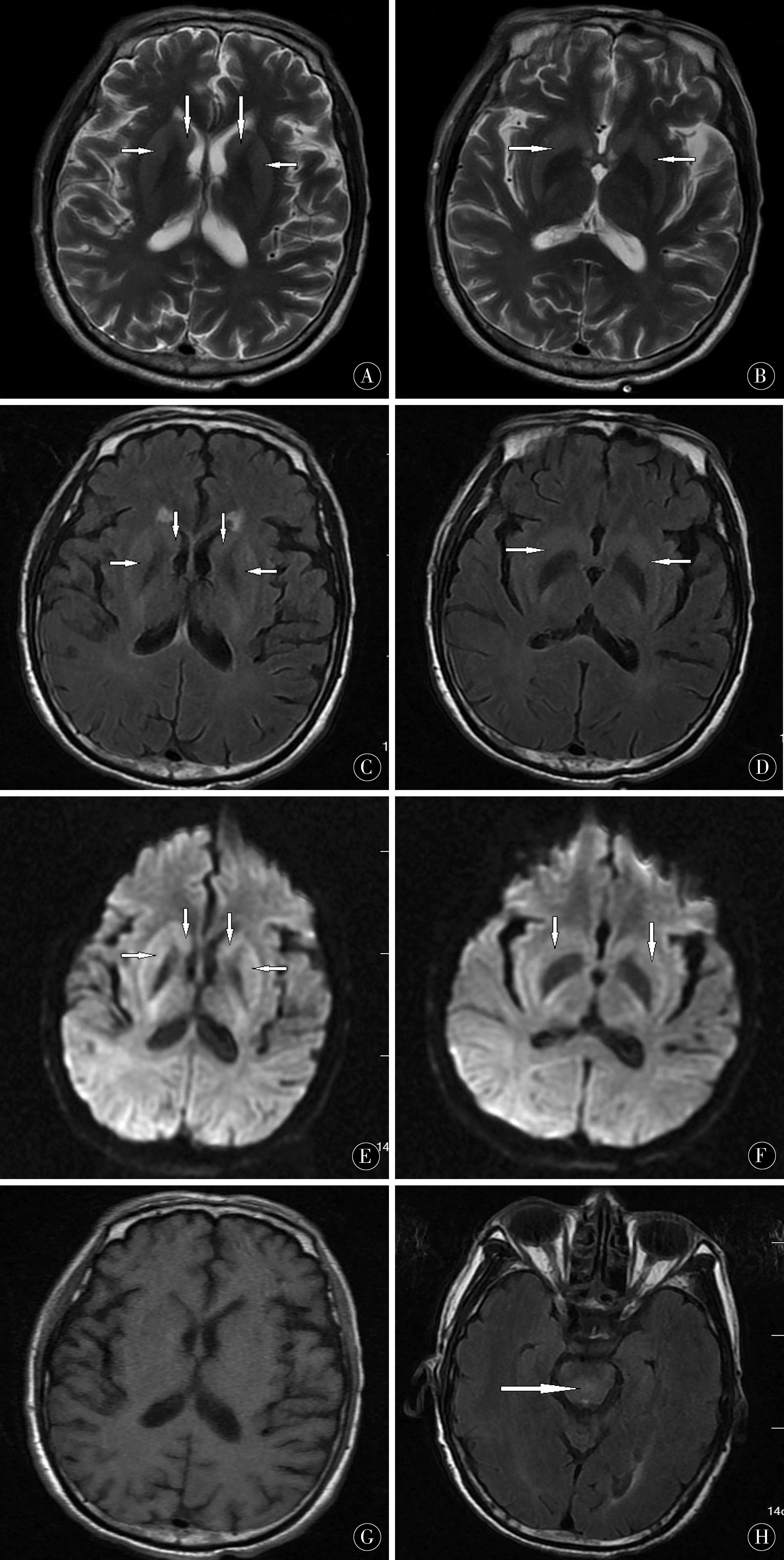
图1 两侧尾状核头及两侧壳核呈对称性等T1稍长T2信号,DWI呈稍高信号,FLAIR像可见脑桥中央高信号Figure 1 The caudal nucleus on both sides and the nucleus on both sides are symmetric and T1 slightly longer T2 signal,and DWI is slightly higher signal.FLAIR looks like a high signal in the center of the pons
3 讨论
经典的脑桥中央髓鞘溶解症(centralpontine myelinolysis,CPM)以脑桥基底部对称性脱髓鞘为病理特征,多在电解质紊乱、营养不良的疾病基础上发生,多数CPM/EPM均发生在纠正电解质紊乱的过程中,出现神经系统症状和体征。BROWN等[2]报道3例因严重高钠血症导致髓鞘溶解病例,髓鞘溶解可见于脑桥中央及脑桥以外区域,脑桥中央病变更常见。本例患者长期独居,脊柱侧弯伴胸廓畸形,形体消瘦,处于营养匮乏状态,突发意识不清,结合本例患者颅脑MRI报告结果:两侧尾状核头部及两侧壳核对称性稍高信号,考虑脑桥外髓鞘溶解症。诊断为EPM。有文献报道EPM的影像学表现可先于CPM 出现[3],本例FLAIR像阅片可见脑桥可疑有片状高信号影,考虑该病例脑桥的影像学变化可能稍滞后于脑桥外部位,结合临床闭锁综合征(四肢瘫痪、假性延髓型麻痹、意识障碍)表现,不除外CPM/EPM并存。关于EPM伴随CPM的存在,GOCHT等[4]在58 例尸检中发现CPM伴EPM 约占20%,与单纯EPM比例相当。患者住院4 d后自动出院,未能跟踪颅脑核磁变化。LAMPL等[5]对1986—2002年的442 例CPM 病因进行分析,病因常见于慢性酒精中毒、低钠血症纠正后、肝移植术后、肝硬化、烧伤后等。本患者长期营养支持条件差,病因考虑为低钠血症的快速纠正,血浆渗透压迅速升高造成神经元脱水而继发脱髓鞘,可见宏观上的水电解质平衡,并不能代表每个细胞的水、电解质平衡。
关于补钠速度,目前尚无统一定论,但多数学者赞同缓慢补钠,无论血钠多少均不应输注高张液体[6]。低钠血症临床分类:轻度低钠血症:血钠130~135 mmol/L;中度低钠血症:血钠125~129 mmol/L;重度低钠血症:血钠<125 mmol/L。《2014年欧洲低钠血症诊疗实践指南推荐》对于重度低钠血症指出补钠原则:第一个24 h内血钠浓度上升不宜超过10 mmol/L,随后每24 h升高宜<8 mmol/L[7-8],每6 h检测血钠直至血钠稳定。如低钠血症被过快纠正应采取以下措施[8]:(1)如第1个24 h血钠增加幅度>10 mmol/L,第2个24 h>8 mmol/L,建议立即采取措施降低血钠;(2)建议停止积极的补钠治疗;(3)建议有关专家会诊以讨论是否可以开始在严密尿量及液体平衡监测下以>1 h、10 m L/kg的速度输注不含电解质液体(如葡萄糖溶液);(4)建议专家会诊,讨论是否可以静注去氨加压素(desmopressin) 2 μg,间隔时间不低于8 h。临床发现严格按照补钠公式程进行补钠,仍有脱髓鞘案例发生,不排除与血钠浓度严重过低以及个体对于颅内渗透压改变的敏感性有关。多数学者认为,对于慢性低钠血症患者每日补钠量限制在8 mmol/L是安全的。同时,对于急危重症患者,融合重症管理模式,脏器支持治疗,其他治疗包括皮质激素、丙种球蛋白、血浆置换、营养支持、维生素B等对患者预后是有帮助的。YOON等[9]在1例干燥综合征(Sjogren syndrome)并发CPM治疗中使用免疫抑制剂、激素、血浆置换等效果明显。本例通过使用甲泼尼龙冲击治疗、肠内营养、B族维生素、基础抗炎支持治疗,患者眼球运动恢复,能随医嘱完成上下运动,认为患者意识清醒,脑干网状上行激动系统得以保留,治疗有效。但肌电图示双上肢周围神经异常(感觉及运动神经均受损,轴索损伤为主),患者是否合并周围神经脱髓鞘改变尚不能精准判断。
关于预后,大多数CPM生存者遗留永久性的神经系统损害,延髓麻痹和痉挛性瘫痪最常见,后期预防并治疗并发症对预后有重要影响,部分患者经适当治疗甚至可完全恢复。有学者[10]曾报道5例CPM,4例存活。需要强调的是,CPM是一种自限性疾病,应积极救治。但本例患者出院1周内的随访调查中发现死于重症肺感染、呼吸衰竭。
临床医师补钠过程中要严密监测血钠变化,应严格遵循国内外专家共识意见,目前国内外尚缺乏对脑桥/脑桥外髓鞘溶解综合征治疗的细化研究,关于血钠纠正速度及时机问题,仍参照国外文献研究,纳入人群多为西方人群,所以中国尚需多中心研究以验证[11-13]。CPM涉及神经内科、急危重症等多系统交叉治疗领域,早期识别、及时脏器支持、多学科系统管理对降低其发病率、改善预后、降低病死率有重要意义。
