Notch信号通路在胰腺癌中的表达及其作用研究
2019-03-25依马木买买提江阿布拉尹继炜
罗 干 易 超 依马木买买提江·阿布拉 徐 林 尹继炜 丁 伟
2018年美国癌症统计数据显示,胰腺癌的5年生存率仅为8%,在所有癌症相关死亡中居第4位[1]。目前多数研究证实胰腺癌恶性生物学特性的产生与维持是一个多细胞信号转导通路共同作用的过程[2-4]。本研究采用Affymetrix基因表达谱芯片分析胰腺癌组织及其癌旁组织中Notch信号通路成员的差异表达情况,并通过阻遏差异表达最为显著的基因,研究Notch信号通路在胰腺癌细胞生长、细胞周期及侵袭转移过程中的作用。
1 材料与方法
1.1 组织样本和质量控制
组织样本:收集新疆医科大学附属第三临床医学院2014年1月—2016年6月行胰十二指肠切除术,术后病理确诊为胰腺导管细胞癌的新鲜癌组织及癌旁组织标本10例。所有患者均为我院首次确诊的新发病例未合并其他恶性肿瘤或高血压、糖尿病等基础疾病;术前未行放、化及抗肿瘤等相关治疗,经病理证实无局部脉管侵犯、区域淋巴结转移;患者本人及患者家属同意留取组织标本并用于研究,允许研究资料交流发表。组织样本收集严格按照美国IRB和HIPAA批准方案进行。
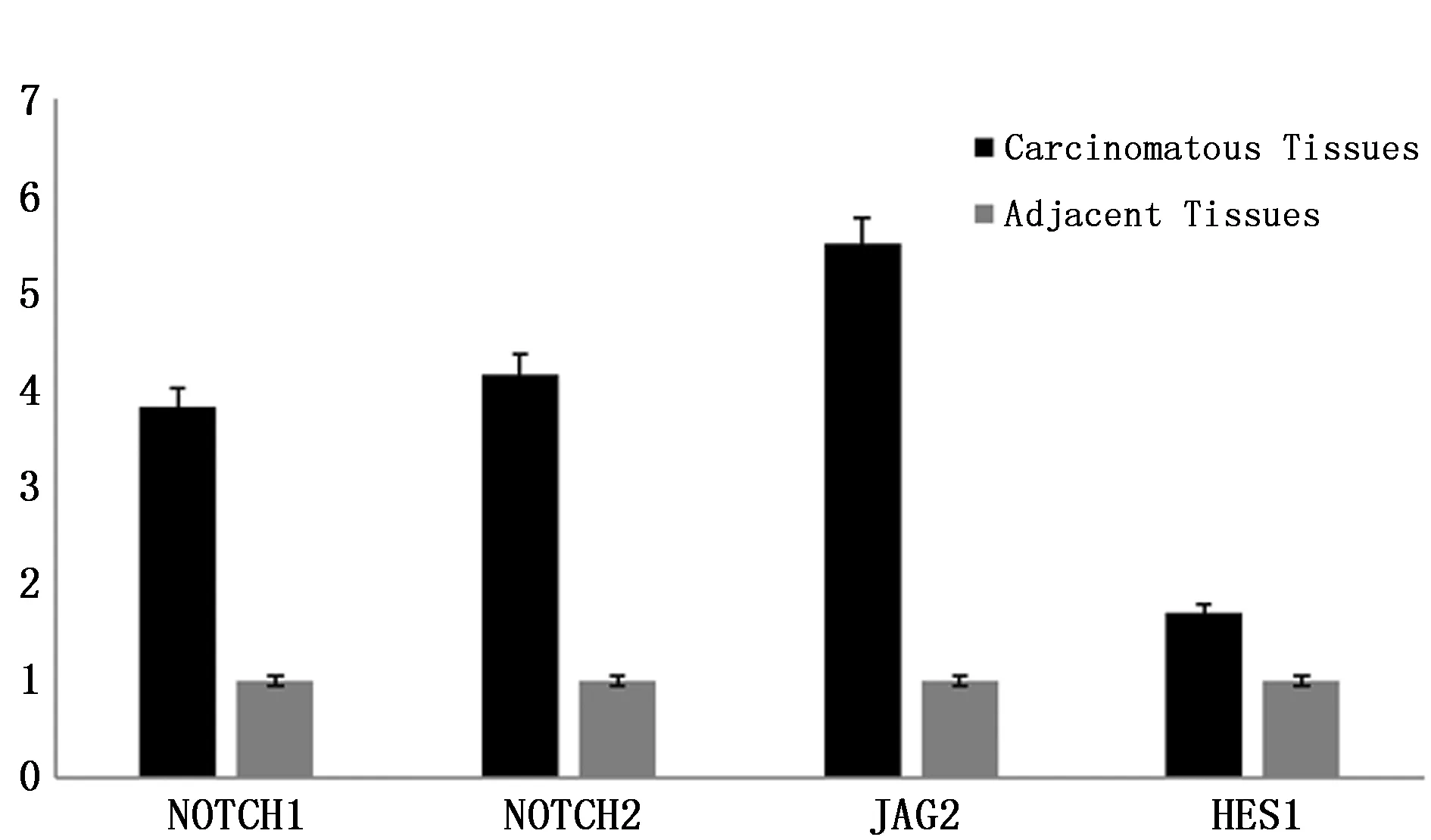
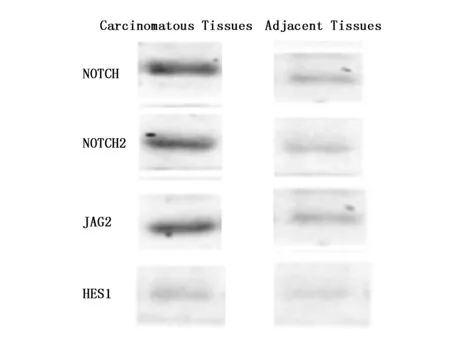
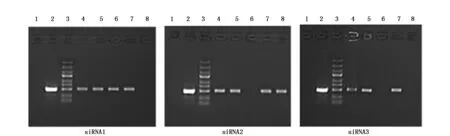
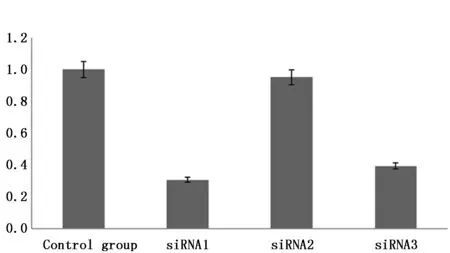
质量控制:组织样本采用Trizol试剂盒提取并纯化获得总RNA后用Nanodrop 2000与Agilent 2100仪器进行质检,参照Unger等[5]方法,筛选出满足(1)RIN值≥7.0;(2)28S/18S>0.7且1.7 经检测合格样本的总RNA参照Villegas-Ruiz等[6]方法由上海吉凯基因代为行基因表达谱芯片分析,反应程序见表1;获得基因表达谱芯片分析数据后通过对比KEGG和BioCarta数据库,采用Fisher精确检验分析并计算Notch信号通路中包含的差异表达基因的富集度水平,筛选出该信号通路中表达存在统计学差异的基因;依据Primer Bank数据库提供的PCR引物信息合成表达存在统计学差异的Notch信号通路成员引物(表2),以GAPDH为内参照,采用实时定量PCR法检测胰腺癌组织及其相应癌旁组织中表达具有统计学差异的基因表达量(目的基因表达量/内参基因表达量),以癌旁组织目的基因表达量做为参照,计算各样本目的基因相对表达量;提取组织样本总蛋白采用Western blot法检测各组样本成员蛋白表达情况,利用Image J软件分析并计算各组样本目的蛋白相较于癌旁组织的相对表达量。 按照徐林等[7]研究方法,采用胰腺癌组织源细胞培养试剂盒(Human Cancer PrimaCellTM:Pancreatic Cancer Tissues Cells)在符合质量控制标准的新鲜胰腺癌组织样本中分离并纯化获得胰腺癌原代细胞,完全培养基(DMEM/F12+10%FBS+1%双抗)、37℃、5%CO2环境中继续培养;待细胞生长至覆盖培养瓶的80%及以上面积时按1∶2比例传3代。 依据GenBank提供的基因信息设计并筛选出3条JAG2 siRNA片段(表3),参照张波等[8]研究方法构建携带3条JAG2 siRNA片段的慢病毒表达载体,并按照吉凯转染试剂盒说明转染胰腺癌原代细胞(感染复数为10,感染条件为Eni.S+polybrene,病毒量:siRNA1 2 μL、siRNA2 1.5 μL、siRNA3 2 μL),感染后按1∶2传3代培养;以GAPDH为内参,用实时定量PCR及Western blot法检测3组细胞中JAG2基因mRNA及蛋白的相对表达量,选择JAG2表达阻遏效果最好的细胞株用于后续研究。 表1 Affymetrix基因表达谱芯片分析反应程序 表2 实时定量PCR引物 上述未经转染的胰腺癌原代细胞加入转染试剂作为对照组,构建的JAG2基因阻遏表达细胞株作为实验组,行如下研究:(1)细胞增殖实验:参照MTT试剂盒说明,检测两组细胞培养每天的OD490值,并以测得的d1、d2、d3、d4、d5 OD490值与d1 OD490的比值作为标准OD490值(OD490/fold表示各天的增殖倍数)绘制生长曲线,对比两组细胞增殖情况差异;(2)细胞周期分析:两组细胞分别加入含碘化丙啶(PI)细胞染色液染色后,采用流式细胞仪分析两组细胞的细胞周期,对比两组细胞细胞周期差异;(3)细胞侵袭能力检测:参照侵袭小室试剂盒说明,上室中分别加入500 μL两组细胞悬液并调整每孔细胞数为5 000个,下室内加入750 μL 30%FBS培养基37℃培养箱培养24 h,去除培养基及非转移细胞后Giemsa染色3~5 min,显微镜拍照并计数细胞,对比分析两组细胞侵袭能力差异。 在胰腺癌组织及其癌旁组织标本间共检测基因38079对,依据KEGG和BioCarta数据库标准,共筛选出差异表达基因512个,其中表达上调的基因419个,表达下调的基因93个。通过对比信号通路数据库信息,Notch信号通路中的关键成员NOTCH1、NOTCH2、JAG2、HES1基因在癌组织中均存在不同程度的上调表达(表4)。 胰腺癌组织中NOTCH1、NOTCH2、JAG2、HES1的mRNA和蛋白相对表达量均高于癌旁组织,差异有统计学意义(P<0.05)(图1-3),Western blot结果显示蛋白表达情况与实时定量PCR基本一致。 表4 胰腺癌组织及其癌旁组织间Notch信号通路差异表达基因 图1 胰腺癌组织及其癌旁组织间Notch信号通路中基因mRNA相对表达量示意图Figure 1 Relative expression of NOTCH1,NOTCH2,JAG2 and HES1 mRNA in pancreatic cancer tissues and adjacent tissues 图2 Notch信号通路中蛋白在各组细胞相对表达量示意图Figure 2 The expression levels of NOTCH1,NOTCH2,JAG2 and HES1 proteins in pancreatic cancer tissues and adjacent tissues 图3 Notch信号通路中各蛋白在X光显影照片Figure 3 The expression levels of NOTCH1,NOTCH2,JAG2 and HES1 proteins in pancreatic cancer tissues and adjacent tissues by X-ray film 本研究通过Affymetrix基因表达谱芯片筛选出JAG2基因表达差异最大(上调表达8.20倍),故将JAG2基因作为阻遏的靶向基因。图4为构建的3条JAG2 siRNA慢病毒质粒PCR菌检电泳照片,阳性克隆提抽质粒后测序结果证实合成的siRNA片段与设计相符且插入载体顺序正确,无碱基错排或点突变;经荧光法测得3种siRNA慢病毒载体滴度分别为6×108、8×108及5×108TU/mL。图5为构建的3株人胰腺癌原代细胞JAG2基因阻遏表达细胞中JAG2 mRNA相对表达量,图6为3株细胞JAG2蛋白Westen blot检测显影照片,检测结果显示,3株细胞JAG2基因表达抑制率分别为69.2%、4.8%、60.5%,故选择第1株细胞用于后续研究。 2.4.1 细胞增殖检测 对照组第1、2、3、4、5天OD490/fold值分别(1.00±0.01)、(1.41±0.02)、(1.86±0.03)、(2.25±0.09)、(3.22±0.03);实验组分别为(1.00±0.02)、(1.17±0.01)、(1.23±0.05)、(1.52±0.02)、(2.01±0.08)。MTT检测结果表明相比对照组,实验组细胞增殖的标准OD490值第4、5天存在统计学差异(P<0.05)。实验结果可证实构建的人胰腺癌原代细胞JAG2基因阻遏表达细胞的生长受到显著抑制(图7)。 2.4.2 细胞周期分析 培养5天后经流式细胞仪分析,对照组中细胞处于G1期、S 期及G2/M 期的细胞占总细胞数的比例分别为(55.05±1.23)% 、(23.53±0.94)% 、(21.42±0.82)%;实验组细胞各期细胞比例则分别为(61.06±0.80)% 、(11.88±1.03)% 、(27.07±0.39)%(图8)。与对照组比较,实验组处于S期、G1期、G2/M期的细胞百分比差异具有统计学意义(P<0.05)。由此可得出实验组的胰腺癌细胞位于G1及G2/M期的细胞增多,而位于S期的细胞则明显减少(P<0.05)。 图4 JAG2 siRNA慢病毒表达载体PCR菌检电泳照片Figure 4 Electrophoresis of PCR products of JAG2 siRNA lentiviral expression vectorsNote:Stripe 1 was the blank control group added with ddH2O;Stripe 2 was the control group that added blank lentivirus vector;Stripe 3 was the Maker for 5 kb,3 kb,2 kb,1.5 kb,1 kb,750 bp,500 bp,250 bp and 100 bp from top to bottom;and Stripes 4 to 8 for siRNA lentiviral Vectors. 图5 构建的人胰腺癌原代细胞JAG2 基因阻遏表达细胞株中JAG2 mRNA相对表达量Figure 5 The relative expression of JAG2 mRNA in JAG2 repressor expression human pancreatic cancer cells 图6 构建的人胰腺癌原代细胞JAG2 基因阻遏表达细胞株中JAG2蛋白Western blot检测显影照片Figure 6 The expression of JAG2 protein in human pancreatic cancer primary cells 2.4.3 细胞侵袭转移能力检测 实验组小室下室内的细胞计数为(3.0±1.00)个/高倍视野;对照组为(63±2.51)个/高倍视野。证实构建人胰腺癌原代细胞JAG2基因阻遏表达细胞侵袭迁移能力显著下降(P<0.05)(图9)。 图7 各组细胞生长曲线Figure 7 Cell curves of pancreatic cancer primary and JAG2 gene repression-expressing cells 图8 各组细胞周期比率Figure 8 The distribution of cell cycle in pancreatic cancer primary and JAG2 gene repression-expressing cells 图9 各组细胞侵袭转移能力测定Figure 9 Invasive and metastatic capacity of pancreatic cancer primary and JAG2 gene repression-expressing cellsNote:A.The pictures of invasion chamber in the control and experimental groups(200×);B.The number of migration cells between pancreatic cancer primary and JAG2 gene repression-expressing cells. 在肿瘤发生发展过程中,Notch信号通路能够直接发挥调控肿瘤细胞增殖、凋亡和分化的作用,也可以通过影响机体其他信号通路间接或者共同调控机体生物学功能[9]。近年来基因表达谱芯片技术的逐步成熟给我们分析疾病发展的过程提供了新的检测方式,本研究中所采用的Affymetrix基因表达谱芯片,因其包含目前更为准确、灵敏且可信度更高的人类全基因组信息和cDNA,所以是目前应用最为广泛的基因表达谱芯片之一[10]。本研究通过Affymetrix基因芯片筛选发现手术切除后胰腺癌组织及其癌旁组织Notch信号通路成员中NOTCH1、NOTCH2、JAG2及其下游靶基因HES1表达均有明显差异。其中JAG2上调表达8.20倍,且JAG2作为Notch信号通路的配体已被证实与胃癌、结肠癌、乳腺癌等多种恶性肿瘤的发生发展密切相关[11-13]。但目前在胰腺癌方面的报道还不多,通过文献检索示JAG2基因高表达会影响胰腺癌细胞的侵袭转移能力,但这种作用的发挥并不是由JAG2独立完成,而是要与Notch1相互作用[14]。 目前siRNA病毒载体转染因其制备方便、价格低廉、高度的特异性及高效性等优点从而成为研究信号通路的主要方法之一[15-16]。为了进一步研究JAG2基因和Notch信号通路在胰腺癌发生发展中的重要作用及机制,本研究成功构建了JAG2基因阻遏表达的胰腺癌原代细胞株,分析阻遏表达细胞株生物学特性显示其细胞株的生长、细胞周期及侵袭转移过程均被明显抑制。本研究结果表明JAG2基因可调控胰腺癌的Notch信号通路,同时也提示Notch信号通路可能在胰腺癌发生发展过程中起重要作用。 综上所述,尽管Notch信号通路与胰腺癌发生和发展密切相关,但因可行手术治疗的胰腺癌患者较少及胰腺癌原代细胞难以分离和培养,导致样本量较少,结果存在一定的偏差。笔者认为,随着分子生物学等基础医学的不断发展,Notch信号通路参与胰腺癌具体机制定将得到充分阐明,并可作为治疗的重要靶点,从而为胰腺癌诊治提供新的思路,将有助于胰腺癌的早期预防、早期诊治及研制靶向药物。1.2 应用Affymetrix基因表达谱芯片分析胰腺癌组织及其癌旁组织中的Notch信号通路成员表达差异情况
1.3 胰腺癌原代细胞的分离与传代培养
1.4 人胰腺癌原代细胞JAG2基因阻遏表达细胞株的构建


1.5 人胰腺癌原代细胞JAG2基因阻遏表达细胞株生物学特性分析
1.6 统计分析

2 结果
2.1 Affymetrix基因表达谱芯片筛选基因表达差异情况
2.2 实时定量PCR检测和Western blot检测结果


2.3 人胰腺癌原代细胞JAG2基因阻遏表达细胞株的构建
2.4 人胰腺癌原代细胞JAG2基因阻遏表达细胞株生物学特性分析




3 讨论
