miR-129通过靶向SEPHS1对骨肉瘤细胞MG-63增殖及凋亡的影响
2019-03-25陈冲王建杨帅
陈 冲 王 建 杨 帅
骨肉瘤是儿童和青少年中最常见的恶性原发性骨肿瘤[1-2]。局限性骨肉瘤患者的5年生存率为60%~70%[3]。然而,转移性骨肉瘤患者的5年生存率仅为20%[4]。迫切需要开发新策略和创新疗法以进一步提高骨肉瘤患者的生存率。随着对骨肉瘤分子水平的发病机制和预后的了解,分子靶向治疗可能成为一种十分有前景的骨肉瘤治疗方法。miRNA是一类短的、非编码的、高度保守的RNA,在肿瘤的发生和生长过程中起着十分关键的作用[5]。miRNA在骨肉瘤的发病过程中发挥的作用已经有广泛研究。miR-132可以通过诱导骨肉瘤细胞周期G1/S期的细胞周期停滞,抑制骨肉瘤细胞在体内外的增殖[6]。关于上调miR-17引起骨肉瘤发生和转移的研究也有报道[7]。因此,miRNA在治疗骨肉瘤方面具有一定的临床价值。硒磷酸合成酶1(SEPHS1)是活性硒的供体,在快速增殖的细胞(如胚胎、癌细胞中)中表达丰富,其表达受到许多应激的诱导,包括氧化应激、盐压力等[8]。SEPHS1表达缺失的小鼠细胞中,细胞生长和增殖也受到影响[9]。因此,SEPHS1的表达在细胞增殖和存活中具有十分重要的作用。
本研究首先检测骨肉瘤组织中miR-129和SEPHS1的表达,通过软件分析SEPHS1和miR-129的结合情况,并应用荧光素酶报告基因实验确认。同时体外培养骨肉瘤细胞系MG-63,建立miRNA过表达和敲低的细胞模型,检测细胞的活性以及凋亡水平。探讨miR-129是否可以通过结合SEPHS1调控骨肉瘤细胞系MG-63的活性和凋亡水平。
1 材料与方法
1.1 病历选择和取材
本研究肿瘤组标本取自2015年7月—2017年7月枣庄矿业集团中心医院骨科初诊的骨肉瘤患者30例,对照组研究标本取自肉瘤周围3.5 cm正常组织。取材后4℃保存,病理确诊后,立刻进行mRNA、miRNA和蛋白的提取。
1.2 组织中mRNA、蛋白和miRNA的提取和反转录
分别应用组织mRNA提取试剂盒和miRNA提取试剂盒进行mRNA和miRNA的提取。总蛋白的提取选择贝博蛋白提取试剂盒。组织中mRNA和miRNA的反转录选择对应的试剂盒进行(mRNA反转录:全式金:AU311;miRNA反转录:全式金:AT351)。实验过程严格按照试剂盒说明书进行操作。
1.3 组织中SEPHS1和人源hsa-miR-129表达的测定
应用NCBI和miRNA base网站搜索人源SEPHS1和miR-129的序列,应用Primer 5进行引物设计(表1)。应用罗氏mRNA qRT-PCR荧光染料以及锐博miRNA qRT-PCR荧光染料,按照试剂说明书及罗氏480 qPCR仪的操作说明进行SEPHS1 mRNA和miR-129 miRNA表达的检测。SEPHS1蛋白的表达采用蛋白质免疫印迹法(Western blot)方法进行检测。

表1 实时荧光定量法(RT-PCR)所用引物
1.4 生物信息学预测SEPHS1和miR-129的结合情况
应用生物信息学网站(Targetscan,miRanda等)预测SEPHS1与miR-129的结合情况。
1.5 miR-129敲低或过表达细胞模型的建立
MG-63细胞生长至覆盖培养瓶50%~70%时,吸出培养液,用温热的PBS清洗两次,加入含miR-129模拟物(mimic,20 nM、50 nM、100 nM和200 nM)或抑制物(inhibitor,20 nM、50 nM、100 nM和200 nM)的Opti-MEM培养基。应用qRT-PCR检测miR-129在MG-63中过表达和敲低的效率。
1.6 荧光素酶报告基因检测SEPHS1和miR-129的结合情况
在北京华大公司合成SEPHS1的3′UTR,在核酸电泳中进行回收和纯化后与构建的载体进行连接、转化,最后进行重组质粒的提取。获取重组质粒后,在6孔板中培养MG-63后,共转染miR-129的模拟物、重组质粒和海肾荧光素酶载体。共转染48 h之后,应用GLOmax20进行双荧光素酶报告基因活性的检测。
1.7 miR-129敲低和过表达对MG-63细胞增殖的影响
在96孔板中配制细胞悬液,将细胞置于37℃的培养箱中预培养12 h。细胞贴壁牢固之后,分别为细胞换成含有200 nM miR-129模拟物、50 nM miR-129抑制物的细胞培养液,培养12 h、24 h、48 h、72 h之后,分别向每孔细胞中加入10 μL的CCK-8溶液,再孵育1 h,在450 nm处应用酶标仪进行吸光度的检测,并按照说明书给出的公式进行计算。
1.8 miR-129敲低和过表达对MG-63细胞凋亡的影响
在6孔板中配制细胞悬液,将细胞置于37℃的培养箱中预培养12 h。细胞贴壁牢固之后,分别为细胞换成含有200 nM的miR-129模拟物、50 nM的miR-129抑制物的细胞培养液,培养48 h之后,提取细胞中蛋白,分别对Bax(21 kD,1∶1500,abcam:ab32503),caspase 3(35 kD,1∶1500,abcam:ab13585),caspase 9(47 kD,1∶1500,abcam:ab32539),Bcl-2(26 kD,1∶1500,abcam:ab32124)进行细胞中蛋白含量测定。采用Gapdh(36 kD,1∶3000,中杉金桥:TA309157)作为内参蛋白。
1.9 数据分析和统计

2 结果
2.1 肿瘤组和对照组miR-129和SEPHS1的表达
RT-PCR结果表明,与对照组相比,肿瘤组中miR-129的表达上调了75%(P<0.05),肿瘤组中SEPHS1 mRNA和蛋白的表达分别下调到72%(P<0.05)和53.5%(P<0.05),表明骨肉瘤患者肿瘤组织和癌旁组织中miR-129、SEPHS1表达不一致,有统计学差异(图1)。

图1 组织中miR-129和SEPHS1的表达Figure 1 Expression of miR-129 and SEPHS1 in osteosarcoma and its adjacent paracancerous tissues.Note:A.Expression of miR-129;B.SEPHS1 mRNA expression;and C.SEPHS1 protein expression in osteosarcoma and its adjacent paracancerous tissues.* showed the significant difference between control and experiment group.
2.2 MG-63细胞中miR-129的过表达和抑制模型的建立
与对照组相比,当miR-129模拟物浓度为200 nM时,miR-129的表达上调了50倍(P<0.05),当抑制物浓度为50 nM时,miR-129的表达下调了49%(P<0.05)。而当抑制物浓度升高到200 nM时,miR-129的表达与50 nM抑制物的抑制程度没有差异。表明miR-129模拟物浓度为200 nM,抑制物浓度为50 nM时,可建立较好的体外细胞的miR-129的过表达和抑制模型(图2)。
2.3 miR-129靶基因SEPHS1的验证结果
为了验证miR-129是否可以与SEPHS1结合,实验首先应用miRbase对miR-129和SEPHS1的结合进行预测,预测结果表明miR-129和SEPHS1可以结合(图3a)。然后本研究应用荧光素酶报告基因检测SEPHS1和miR-129的结合情况。和转染Luc-SEPHS1-WT+NC的细胞相比,转染Luc-SEPHS1-WT+mimic的细胞荧光强度下降了35.1%,具有统计学差异(P<0.05)。在结合位点突变后(MT组),荧光强度没有变化,调控关系消失(图3b)。转染miR-129模拟物(200 nM)的SEPHS1上调了43.6倍(P<0.05),转染miR-129抑制物(50 nM)的SEPHS1下调了53%(P<0.05)(图3c)。表明miR-129可以与SEPHS1结合,且结合位点为CGUUUUU。

图2 MG-63中miR-129过表达和敲低模型的建立Figure 2 Established models of miR-129 overexpression and knockdown in MG-63 cellsNote:* showed the significant difference between experiment and control group.# showed the significant difference with M-20 nM or I-20 nM group.& showed the significant difference with M-50 nM or I-50 nM group.showed the significant difference with M-100 nM or I-100 nM group.
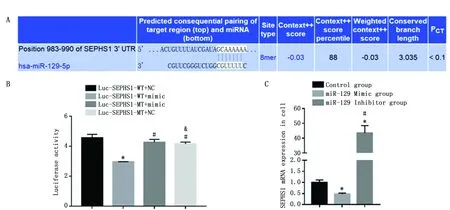
图3 SEPHS1和miR-129的结合情况Figure 3 Binding of SEPHS1 and miR-129Note:A.Website prediction results;B.Luciferase reporter gene test results;and C.SEPHS1 mRNA expression after miR-129 overexpression or inhibition in MG-63 cells.* showed the significant difference between experiment and control group.# showed the significant difference with Luc-SEPHS1-WT+mimic or miR-129 Mimic group.& showed the significant difference with Luc-SEPHS1-MT+mimic group.
2.4 敲低和过表达miR-129后MG-63的增殖情况的检测结果
通过应用miR-129的模拟物和抑制物对MG-63细胞进行处理,应用CCK-8试剂盒对细胞活力进行检测。检测结果表明,和对照组相比,转染miR-129模拟物的细胞培养24 h、48 h和72 h后,细胞活性分别上调了17.5%(P<0.05)、10.4%(P<0.05)和10.5%(P<0.05)(表1)。和对照组相比,转染miR-129抑制物的细胞培养48 h和72 h后,细胞活性分别下调了7.4%(P<0.05)和9.5%(P<0.05)(表1)。结果表明miR-129可以调节MG-63的增殖。
2.5 敲低和过表达miR-129后MG-63细胞凋亡的检测结果
为了检测miR-129转染对MG-63凋亡的影响,本研究应用Westerm blot对凋亡的相关基因Bax、Bcl-2、caspase 3和caspase 9进行了检测。结果表明,和对照组相比,转染miR-129模拟物的细胞中,Bax、caspase 3和caspase 9的蛋白表达量分别下调了23.4%(P<0.05)、42.7%(P<0.05)和29.1%(P<0.05),Bcl-2的蛋白表达上调了2.8倍(P<0.05)(图4a)。和对照组相比,转染miR-129抑制物的细胞中,Bax、caspase 3和caspase 9的蛋白表达量分别上调了27.8%(P<0.05)、34.8%(P<0.05)和49.2%(P<0.05),Bcl-2的表达下调了47%(P<0.05)(图4b)。为了更好的证明miR-129对MG-63凋亡的影响,本实验还应用Hoechest对MG-63染色进行凋亡的检测。结果表明,转染mir-129抑制物的MG-63细胞核染色明显加深加亮,有统计学差异,而转染mir-129模拟物的细胞没有显著变化(图4c),说明转染mir-129抑制物后可以诱导细胞凋亡的发生。

表1 敲低和过表达miR-129后MG-63的增殖情况
Note:* showed the significant difference between control and experiment group.

图4 miR-129对MG-63凋亡的影响Figure 4 Effects of miR-129 on apoptosis of MG-63 cellsNote:A.Detection of apoptosis after miR-129 overexpression in MG-63 cells;B.Detection of apoptosis after miR-129 knockdown in MG-63 cells;and C.Hoechest staining after miR-129 transfection in MG-63 cells.* showed the significant difference between control and experiment group.
3 讨论
骨肉瘤好发于儿童和青少年,是一种高度恶性肿瘤。当肿瘤扩散到全身时,会影响患者的头颈、生殖器官、泌尿系统和四肢,严重危害患者的肢体功能和生命。目前对骨肉瘤的治疗多限于化疗和手术。化疗和手术都会对患者造成严重的心理和生理伤害,并且往往不能预判术后的效果。因此,迫切需要找到骨肉瘤细胞的靶向分子,从细胞和分子水平上抑制骨肉瘤细胞的生长,达到治疗骨肉瘤的目的。
miRNA在肿瘤的发生和生长过程中起着十分关键的作用。研究表明miR-21通过靶向RECK基因,参与骨肉瘤细胞的增殖和迁移[10]。此外,研究人员发现了Wnt通路在骨肉瘤发病机制中的重要作用,而Wnt基因可以由miR-181激活[11]。miR-129在肺癌、膀胱癌和胃癌中的调节作用已有研究[12]。在本实验中,我们在体外培养的MG-63中对miR-129进行过表达和敲低,探究miR-129对骨肉瘤细胞的影响。实验结果表明,miR-129能与SEPHS1结合,当过表达miR-129并转染于MG-63时,能明显加速细胞的增殖,抑制细胞的凋亡。而当miR-129敲低时,其与SEPHS1之间的结合被破坏,细胞增殖被抑制,细胞凋亡增加。表明miR-129对MG-63的调控作用。
SEPHS1参与许多信号转导通路,调节基因转录,通过与胞内蛋白结合参与对细胞周期的调控。一旦细胞周期平衡被打破,细胞本身生存期将出现异常,导致病、死细胞增多。肿瘤患者体内癌细胞数量增多,加速肿瘤生长进度。本研究结果表明SEPHS1的表达与骨肉瘤的分期和分化有关,提示SEPHS1的表达影响着骨肉瘤的发生和发展。已有研究表明SEPHS1可以与细胞分裂周期相关蛋白4(CDCA4)、鸟苷酸结合蛋白2(GBP2)和溶质载体家族F6(SLC35F6)互相作用起到对细胞周期的调控[9],进而调节细胞活性。肿瘤的生长速度取决于肿瘤细胞的活性,而通过对细胞活性的调节可以抑制肿瘤细胞的生长。由于肿瘤发生的复杂性,人类在攻克恶性肿瘤方面取得的进展并不明显。miRNA作为近年研究的新亮点,已经有越来越多的研究证明其对肿瘤的靶向治疗作用。研究表明,与正常组相比,miR-129在浆液性卵巢癌,乳腺癌和胶质瘤患者中的表达都存在较大差异[13]。本研究中,miR-129通过与SEPHS1结合,抑制骨肉瘤细胞的活性,并增加骨肉瘤细胞的凋亡率,起到对骨肉瘤细胞增殖的调控作用。
综上所述,miR-129可能通过与SEPHS1结合,调节骨肉瘤细胞的活性,影响骨肉瘤细胞的凋亡。提示miR-129可能成为骨肉瘤治疗的新靶点。
