PD-L1蛋白与CD8+TILs联合检测在可切除肺腺癌预后评估中的临床意义
2019-03-25马健力张明辉姬宏飞徐向英
马健力 张明辉 姬宏飞 徐向英
肺癌目前是最常见的恶性肿瘤,其死亡率在全球范围内居恶性肿瘤首位,肺腺癌是其最常见的病理类型。在中国肺腺癌的发病率呈明显上升趋势,尽管早期诊断、手术、化疗及放射治疗等综合治疗的应用使可手术肺腺癌治疗效果有了一定程度的提高,但其预后仍然很差,ⅢB期的5年生存率只有10%左右[1]。根治性的手术切除是早期肺腺癌患者首选的治疗,然而患者即使经过规范化的治疗,其预后仍然存在很大差异。确定有效的生物标志物以预测可切除ADC患者的预后可以帮助我们发现高危复发的患者,以便进行更精准的治疗,具有重要的临床意义。
近年来,程序性死亡蛋白1(Programmed cell death 1,PD-1)/程序性死亡蛋白配体1(Programmed cell death-ligand 1,PD-L1)抑制剂在肺癌治疗中显示出良好的疗效,研究显示PD-L1表达与预后不良有关[2-3],但在可切除ADC中PD-L1表达的预后价值仍然存在争议。因此,全面分析肺腺癌中PD-L1的表达以及其与预后之间的关系具有重要的临床意义。另有大量研究证实,肿瘤浸润的淋巴细胞(Tumor infiltrating lymphocyte,TIL)的数量及种类可以作为指导肿瘤患者预后的确定因素[4]。其中,CD8+TILs是一种具有抗肿瘤免疫功能的细胞亚群,其浸润数量和功能与肿瘤的发展有着显著相关性。研究发现,在可切除ADC中,CD8+TILs可作为预后良好的重要预测指标,但其与PD-L1表达的相关性仍有待进一步探究。本研究旨在检测PD-L1与CD8highTILs在可切除ADC患者中的表达,确定二者的相关性,评价其在可切除ADC患者生存预测中的重要意义。
1 材料与方法
1.1 一般资料
本研究经哈尔滨医科大学附属肿瘤医院伦理委员会批准,2009年1月—2012年12月在本院接受根治性手术切除的ADC患者104例纳入此项研究,所有患者术前均未接受任何抗肿瘤治疗,患者的中位年龄为62.9岁(32~81岁),其中63名(60.6%)为男性,吸烟者49例(47.1%),69例(66.3%)为Ⅰ~Ⅱ期,35例(33.7%)为Ⅲ期。
1.2 PD-L1在肺癌组织中的表达及肿瘤浸润CD8+TILs的测定
患者术后的石蜡包埋(FFPE)肿瘤组织用于免疫组织化学(IHC)分析PD-L1及CD8+TILs表达。将4 μm厚的切片用二甲苯脱蜡,并用梯度浓度的乙醇溶液进行水化,并应用甲醇中的H2O2处理抑制内源性过氧化物酶活性。将载玻片组织与针对人PD-L1或CD8的兔单克隆抗体(Abcam,Cambridge,UK)一起孵育。基于染色强度和肿瘤细胞阳性百分比确定PD-L1阳性表达,根据文献报道选择5%为界值[5],肿瘤细胞弱染色或阳性百分比低于5%的判定为阴性;中度或强染色和阳性百分比超过5%判定为是阳性。具有在中央或边缘肿瘤区域内浸润的CD8阳性的淋巴细胞被定义为CD8+TILs。基于肿瘤区域内呈现的CD8+TILs的百分比,我们规定5%作为CD8+TILs的界值(CD8highTILs,CD8lowTILs)。所有IHC由两位经验丰富的病理学家进行定量评估分析。
1.3 随访情况
患者在治疗出院后均接受哈尔滨医科大学附属肿瘤医院随访,以门诊及电话方式进行。患者在前两年每三个月进行一次后续检查,3~5年每六个月进行一次,此后每一年进行一次。根据随访记录获得无病生存期(Disease free survival,DFS)和总生存期(Overall survival,OS)。DFS定义为从根治性手术日期开始至疾病复发或由于疾病进展导致患者死亡或末次随访的时间,OS定义为根治性手术日期到死亡或末次回访的时间。
1.4 统计分析
利用SPSS软件(SPSS 17.0,Chicago,Illinois,USA)进行统计学分析。使用χ2检验或Fisher精确检验评估PD-L1和CD8+TILs表达与临床病理学特征的关系。通过Kaplan-Meier方法评估DFS和OS,并使用对数秩检验进行比较。通过单因素和多因素Cox回归分析OS的预后因素,P<0.05为差异有统计学意义。
2 结果
2.1 肺腺癌组织中PD-L1与CD8+TILs的表达情况
应用IHC检测104例接受根治性手术切除ADC患者组织标本中PD-L1表达及CD8+TILs的浸润情况,PD-L1主要表达在肿瘤细胞膜,在104例患者中40例(38.5%)PD-L1蛋白表达阳性,在46例(44.2%)病例中检测到CD8highTILs(图1)。

图1 肺腺癌患者PD-L1与TIL中CD8免疫组织化学染色(200×)Figure 1 The expression of PD-L1(A and B)and CD8+ in TILs(C and D)in lung adenocarcinoma tissues(200×)Note:A and B.Positive and negative expression of PD-L1;C and D.High and low expression of CD8 in TILs.
2.2 PD-L1表达与CD8high TILs浸润与ADC患者临床病理特征的关系
统计分析可切除ADC组织中PD-L1和CD8highTILs与临床病理特征之间的关系,肺门淋巴结转移患者有高PD-L1表达倾向,但差异没有统计学意义(P=0.081)。PD-L1表达水平与年龄、性别、吸烟史、肿瘤大小、TNM分期无关(P>0.05)。而CD8highTILs与可切除ADC患者的TNM分期有关(P=0.021)(表1)。

表1 PD-L1与CD8high TIL的表达水平与临床病理特征的关系
2.3 PD-L1表达和CD8high TILs浸润与可切除ADC患者的预后的关系
PD-L1阳性表达可切除ADC患者的DFS(P=0.018)和OS更长(P=0.008)。而CD8highTILs患者的DFS(P=0.021)与OS较长(P<0.001)(图2)。
2.4 PD-L1与CD8high TILs等因素对可切除ADC患者预后的影响
单因素Cox回归模型显示TNM分期、PD-L1表达和CD8highTILs与OS有关,而年龄、性别、吸烟状况、肿瘤大小和淋巴结转移状态与OS无关。进一步的多因素分析表明,TNM分期、PD-L1及CD8highTILs均是OS重要的独立预测因子(表2)。
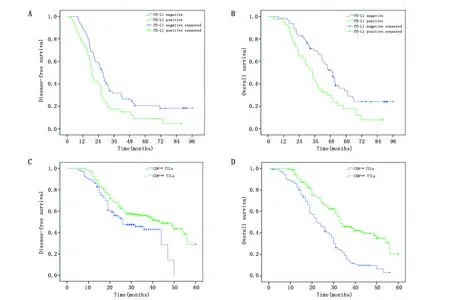
图2 PD-L1和CD8high TILs在肺腺癌中表达的预后意义Figure 2 Prognostic significance of expression of PD-L1 and CD8+TILs in lung adenocarcinomaNote:A and B.The curves of DFS(P=0.018)and OS(P=0.008)for patients with positive expression of PD-L1 and negative expression of PD-L1;C and D.The curves of DFS(P=0.021)and OS(P<0.001)for patients with high expression of CD8+TILs and low expression of CD8+TILs.

FactorUnivariate analysisHR(95% CI)PMultivariate analysisHR(95% CI)PAge(>65 vs. ≤65)1.353(0.862~2.123)0.188Gender(Male vs. Female)1.231(0.780~1.942)0.373Smoking status(Yes vs. No)1.184(0.757~1.852)0.46Tumor size(>3cm vs. ≤3cm)1.553(0.975~2.475)0.0641.283(0.787~2.09)0.318Lymph node metastasis1.51(0.963-2.370)0.0731.538(0.955~2.475)0.077TNM stage(Ⅲ-Ⅳ vs. Ⅰ~Ⅱ)1.902(1.19~3.038)0.0071.992(1.182~3.124)0.008PD-L1(+ vs.-)1.811(1.154~2.842)0.0101.571(0.982~2.513)0.060CD8+TILs(High vs. Low)1.675(0.968~2.347)0.0201.689(1.040~2.743)0.034
同时,我们研究了PD-L1表达与临床病理特征之间的关联。结果显示,PD-L1表达增加出现在男性患者(OR=1.56,95%CI:1.02~2.37;P=0.04)和阳性淋巴结转移患者中(OR=1.74,95%CI:1.23~2.46;P=0.002)。同时,可发现PD-L1表达与吸烟(OR=1.49,95%CI:0.86~2.58;P=0.16),肿瘤大小(OR=1.57,95%CI:0.40~6.19;P=0.52),EGFR状态(OR=0.62,95%CI:0.26~1.45;P=0.27),ALK状态(OR=1.52,95%CI:0.63~3.67;P=0.35)和KRAS状态(OR=1.27,95%CI:0.74~2.16;P=0.38)间均不存在显著相关(图3)。分析PD-L1表达与淋巴结转移,ALK状态和KRAS状态间的关系时并没有观察到异质性,所以使用固定效应模型。随机效应模型用来进行其他分析。

图3 PD-L1表达与临床病理特征之间关联的森林图Figure 3 Forest plots for the association between PD-L1 expression and clinicopathologic features
3 讨论
PD-1/PD-L1途径在免疫逃逸中起重要作用,可能显著影响CD8highTILs的抗肿瘤杀伤功能。多项研究已证实,PD-L1的高表达与多种肿瘤的不良预后有关[7-8]。然而,PD-L1和CD8highTILs的表达在可手术切除ADC患者生存及预后中的作用仍有待进一步探讨,对于评价能否应用针对PD-1/PD-L1途径的免疫疗法治疗可切除ADC患者具有重要的临床意义。
诸多研究表明,PD-L1表达是影响肿瘤患者治疗反应和预后的关键因素[9];但其在判断预后中的作用仍存在争议[10-11]。以下几个方面可能是导致这些不同结果的原因:(1)不同的研究中鉴定PD-L1蛋白表达的抗体不同;(2)不同研究中判定PD-L1阳性表达的标准不一致;(3)不同研究中登记患者的病理特征和干预因素存在差异[6];(4)标本采集时间会影响PD-L1检测结果。因此,建立规范的、标准化的PD-L1检测平台和统一PD-L1阳性表达的判定标准对于今后的PD-L1相关研究具有重要意义。本研究通过IHC检测104例可切除ADC的患者PD-L1表达,发现PD-L1阳性表达与患者预后不良相关。目前,最大规模的研究收集1,070例可手术的NSCLC[12],结果显示PD-L1阳性表达组比PD-L1阴性表达组更容易复发,这与我们的结果一致。同样,我们分析公共数据库的结果也显示,PD-L1高表达可促进肿瘤复发和转移。临床试验证实,PD-1/PD-L1抑制剂在肺腺癌的治疗中具有更好的疗效[13]。
T淋巴细胞作为机体免疫的基本组成部分,在肿瘤的系统性特异性免疫应答中起到重要作用,CD8highTILs在微环境中可与肿瘤细胞产生直接联系和相互作用,其介导的细胞毒性作用以及释放的细胞因子发挥重要的抗肿瘤功能,从而抑制肿瘤增殖和迁移。因此,检测肿瘤组织CD8highTILs的表达水平可能更好地评价肿瘤患者的预后情况。本研究中,我们同样检测了104例可切除ADC患者中CD8highTILs的表达情况,也观察到CD8highTILs可提示患者的良好预后,同时可作为判断可切除ADC患者预后的独立因素。未来的研究中,深入地探讨CD8highTILs在肿瘤中的作用将具有重要的临床意义。
近年来,PD-1/PD-L1抑制剂作为重要的免疫疗法,已在多种肿瘤中展现出很好的疗效。研究表明,肿瘤细胞中PD-L1和CD8highTILs表达水平与PD-1/PD-L1抑制剂治疗密切相关,是预测疗效的有效指标[14]。因此,揭示ADC中PD-L1和CD8highTILs的阳性表达率及其与临床参数的相关性可以更好地筛选适合PD-1/PD-L1抑制剂治疗的群体。本研究表明,PD-L1阳性表达的ADC患者比例为38.5%(40/104),而CD8highTILs的阳性率为44.2%,与Huynh等[15]的结果相似。此外,我们的结果提示有肺门淋巴结转移的患者PD-L1表达较高,但无统计学意义。PD-L1表达与淋巴结转移之间的关联表明PD-1/PD-L1通路的激活导致肿瘤细胞逃避免疫系统监视,促进转移。CD8highTILs的表达水平与患者的TNM分期具有显著的相关性,可能能够应用CD8highTILs预测患者的临床分期。
本研究表明肿瘤细胞中PD-L1与CD8highTILs的表达具有显著的相关性,和ADC患者的预后不良有关。但是具体的分子机制尚不清楚。目前认为有几种可能的作用机制为:“Toll样受体信号传导途径”“细胞因子受体相互作用”“趋化因子受体相互作用”“T细胞受体信号传导途径”。除免疫相关信号传导外,还发现PD-L1表达与增殖信号通路相关,如JAK/STAT3。同时,PD-L1表达与性别和淋巴结转移密切相关,该群体可能在抗PD-1/PD-L1治疗中具有相对优势,并且表达结果可以为临床药物选择提供参考。关于PD-L1表达和CD8highTILs对患者免疫状态的调节,应在基础研究中确认其潜在的分子机制。
