抑癌基因DKK2抑制儿童肾母细胞瘤细胞增殖的机制研究
2019-03-25袁桂霞冯婉琪夏小娟
袁桂霞 李 岩 冯婉琪 夏小娟 李 旭
近年来,儿童肿瘤发病率有显著升高的趋势;肾癌是最常见的儿童恶性肿瘤,儿童期肾癌约占儿童癌症的7%[1]。儿童肾癌最常见的病理类型是肾母细胞瘤,少见的病理类型主要包括横纹肌样瘤、透明细胞肉瘤、先天性中胚层肾瘤、肾尤文肉瘤、原发性肾肌上皮癌、囊性部分分化肾母细胞瘤、多房囊性肾瘤、原发性肾滑膜肉瘤和间变性肉瘤;肾母细胞瘤可影响单侧肾脏或双侧肾脏的功能[2]。尽管肾母细胞瘤的诊治有了显著的提高,但是儿童肾母细胞瘤的死亡率仍然居高不下[2];因此寻找早期肾母细胞瘤相关的靶基因有着重要的意义。
Dickkopf(DKK)蛋白是WNT信号通路的负调控因子,其家族成员主要包括DKK1、DKK2、DKK3和DKK4等。其家族成员在结构上有共同的特点:都含有1个信号肽序列、2段富含半胱氨酸的保守结构域和辅酯酶折叠[3]。人DKK相关基因主要包括了DKK1~4等。其中DKK2(Dickkopf-related protein 2)是分泌性肿瘤抑癌基因,在人多种实体肿瘤中发挥着重要的作用[4-6]。但DKK2在儿童肾母细胞瘤的作用尚未见报道。本研究检测DKK2基因在儿童肾母细胞瘤组织和细胞系SK-NEP-1中的表达,采用基因过表达技术,过表达儿童肾母细胞瘤细胞SK-NEP-1中DKK2基因,运用CCK-8实验、流式细胞实验等分析儿童肾母细胞瘤细胞过表达后细胞增殖等变化。
1 资料与方法
1.1 试剂和材料仪器
胎牛血清和1640培养液购于美国Gibico公司;RNA提取试剂盒和RNA逆转录试剂盒购于美国Promega公司;实验中相关引物由上海生工设计与合成;qRT-PCR染料购于上海碧云天公司;一抗、二抗抗体均购于美国CST公司。实验中所用的仪器(细胞培养孵育箱、RNA浓度测量仪器Landdrop、qPCR仪、酶标仪等)均由湖北医药学院中心实验室提供和使用。
1.2 细胞系和临床组织样本
儿童肾母细胞瘤SK-NEP-1、正常肾上皮细胞PCS-400-010、PCS-400-011和PCS-400-012等均购自中科院细胞生物库。细胞培养用含10%胎牛血清的培养液于37℃,5%CO2细胞孵育箱中培养。2010年1月—2017年1月收集湖北医药学院附属东风总医院儿科诊治的30例儿童肾母细胞瘤的组织及配对癌旁组织,同时收集正常肾组织16例。本研究得到了湖北医药学院附属东风总医院的伦理委员会的批准,组织标本诊断由湖北医药学院病理教研室诊断并审核。
1.3 实验方法
1.3.1 RNA和蛋白提取 肾母细胞瘤细胞系和正常肾上皮细胞的RNA和蛋白以及上述临床样本中的RNA和蛋白提取步骤同已有的文献报道[13]。提取后的RNA在Landdrop仪器中测得浓度,通过RNA逆转录试剂盒将RNA逆转为cDNA,实验方法及步骤参考样样品实验说明书及已有的参考文献[13]。将逆转录后的cDNA放于-20℃冰箱中保存。
1.3.2 DKK2过表达载体构建和细胞转染 DKK2过表达质粒转染方法和步骤同参考文献[14],活性状态下的儿童肾母细胞瘤细胞SK-NEP-1种在六孔板中,转染载体:Lipofectamine-2000,将DKK2过表达的SK-NEP-1细胞设定为实验组(DKK2组),空白对照质粒组设定为对照组(Vector组),细胞转染48h后收集实验组和对照组细胞进行相应的后续实验。
1.3.3 RT-PCR和qRT-PCR检测DKK2在肾母细胞瘤中的表达 RT-PCR和qRT-PCR的步骤同试剂盒使用说明书同文献所述[15]。DKK2的引物序列,DKK2-F:5′-GGCCAGAAGAAGCTGCTGATAG-3′,DKK2-R:5′-AGTTGGTCTCCACAGCACTTACC-3′。使用HT7500生物系统以及SYBR®Green的试剂盒。通过实时监测PCR扩增,选择β-actin为内参基因,每个样品做三个重复,用2-△△Ct法对样本基因进行表达差异相对定量分析,在扩增的指数期对起始模板进行定量,扩增指数越高,相对表达越高。
1.3.4 CCK-8法和克隆形成实验检测DKK2基因过表达对肿瘤细胞增殖活性的影响 CCK-8法:上述质粒转染SK-NEP-1细胞48 h后取实验组和对照组细胞计数,3000细胞/100 μL DMEM培养液细胞加入96孔板中放于细胞孵育箱中继续培养约24 h;待细胞完全贴壁后,每孔加入20 μL的MTS试剂继续培养2~3 h,使用酶标仪(480 nm)测定实验组和对照组的吸光度,然后统计作图。
克隆形成实验:细胞转染48 h后,实验组与对照组计数,取1000细胞/100 μL 1640液的细胞加入六孔板中,将六孔板放于37℃,5%CO2的孵箱中继续培养两周,当细胞形成集落克隆团后,多聚甲醛固定、染色并计数,然后统计作图。
1.3.5 流式细胞周期和凋亡实验 流式细胞周期的方法同参考文献[16]。质粒转染SK-NEP-1细胞48 h后取实验组(过表达DKK2)和对照组细胞(Vector)计数,收集并使用多聚甲醛4℃进行固定约24 h,避光下使用PI染色,并送流式细胞仪进行分析和统计作图。细胞凋亡:细胞转染48 h后收集细胞,Binding缓冲液重悬,分别加入V-fluorescein和碘化丙锭(PI)混匀,避光30 min,送流式细胞仪分析,统计作图。
1.3.6 裸鼠成瘤实验检测DKK2基因过表达对肿瘤细胞增殖的影响 裸鼠成瘤的方法和步骤同文献所述[15]。收集稳定表达DKK2的SK-NEP-1细胞或对照细胞(3×106/空),离心后并重悬,将0.1 mL PBS注入裸鼠皮下(n=5)。肿瘤直径每3天测量一次,动物培养房中培养约30天,当肿瘤直径约1 cm时,取出肿瘤并进行相应的功能实验。
1.3.7 免疫组织化学染色 对裸体移植肿瘤组织的石蜡切片进行免疫组织化学染色,使用抗DKK2、Ki67一抗进行染色。将组织样品切成4 μm,然后脱蜡,在无水二甲苯中漂洗并通过梯度乙醇再水合,进行抗原修复[15]。将切片样品在3%过氧化氢中温育以阻断内源性过氧化物酶活性,用PBS洗涤三次,然后在室温下用5%FBS-PBS溶液封闭15 min;与第一抗体在4℃温育过夜。第二天,将切片与二抗在室温下孵育60 min,然后用二氨基联苯胺显色并用苏木精(HE)复染。在显微镜下以400×拍照并获取图像。
1.3.8 免疫蛋白印迹实验 收集肾母细胞瘤和正常肾上皮细胞,提取细胞蛋白后测定蛋白浓度[16]。取50 μg/孔细胞蛋白进行凝胶电泳,常温下将电泳分离后的蛋白转膜于PVDF膜上,5%脱脂牛奶的TBST室温下封闭2 h,加入一抗及内参GAPDH,于4℃冻库封闭过夜。24 h后常温下复温约0.5 h,TBST液洗膜后,二抗封闭液室温下摇床孵育2 h,显色剂(DAB)显色、成像仪曝光,并用Quantity One软件分析蛋白灰度值,以目的蛋白条带灰度值与内参GAPDH之比来表示相对表达差异。
1.4 数据统计方法

2 结果
2.1 DKK2在儿童肾母细胞瘤细胞系中表达
通过免疫蛋白印迹实验发现,与正常肾上皮细胞(PCS-400-010、PCS-400-011和PCS-400-012)相比,肾母细胞瘤细胞系SK-NEP-1中DKK2蛋白表达下调,差异具有统计学意义(P<0.01)(图1A);同时通过qRT-PCR发现,与正常肾上皮细胞相比,DKK2 mRNA在肾母细胞瘤细胞系SK-NEP-1中表达下调,差异有统计学意义(P<0.01)(图1B)。

图1 儿童肾母细胞瘤细胞系和肾上皮细胞系中DKK2的表达Figure 1 The expression of DKK2 in nephroblastoma cells and renal epithelial cellsNote:A.The expression of DKK2 protein was down-regulated in nephroblastoma cells;B.DKK2 mRNA was down-regulated in nephroblastoma cells.**P<0.01,when compared to the negative control group.
2.2 DKK2 mRNA在儿童肾母细胞瘤组织中表达
通过半定量荧光PCR实验发现,与癌旁组织相比,配对的儿童肾母细胞瘤组织中DKK2 mRNA的表达水平下调,差异有统计学意义(P<0.001)(图2A,2C)。同时与非配对的正常儿童肾组织相比,DKK2 mRNA表达水平在儿童肾母细胞瘤中表达下调,差异有统计学意义(P<0.001)(图2B)。因此,DKK2 mRNA在肾母细胞瘤组织中表达下调,可能作为潜在抑癌基因参与儿童肾母细胞瘤的进展。
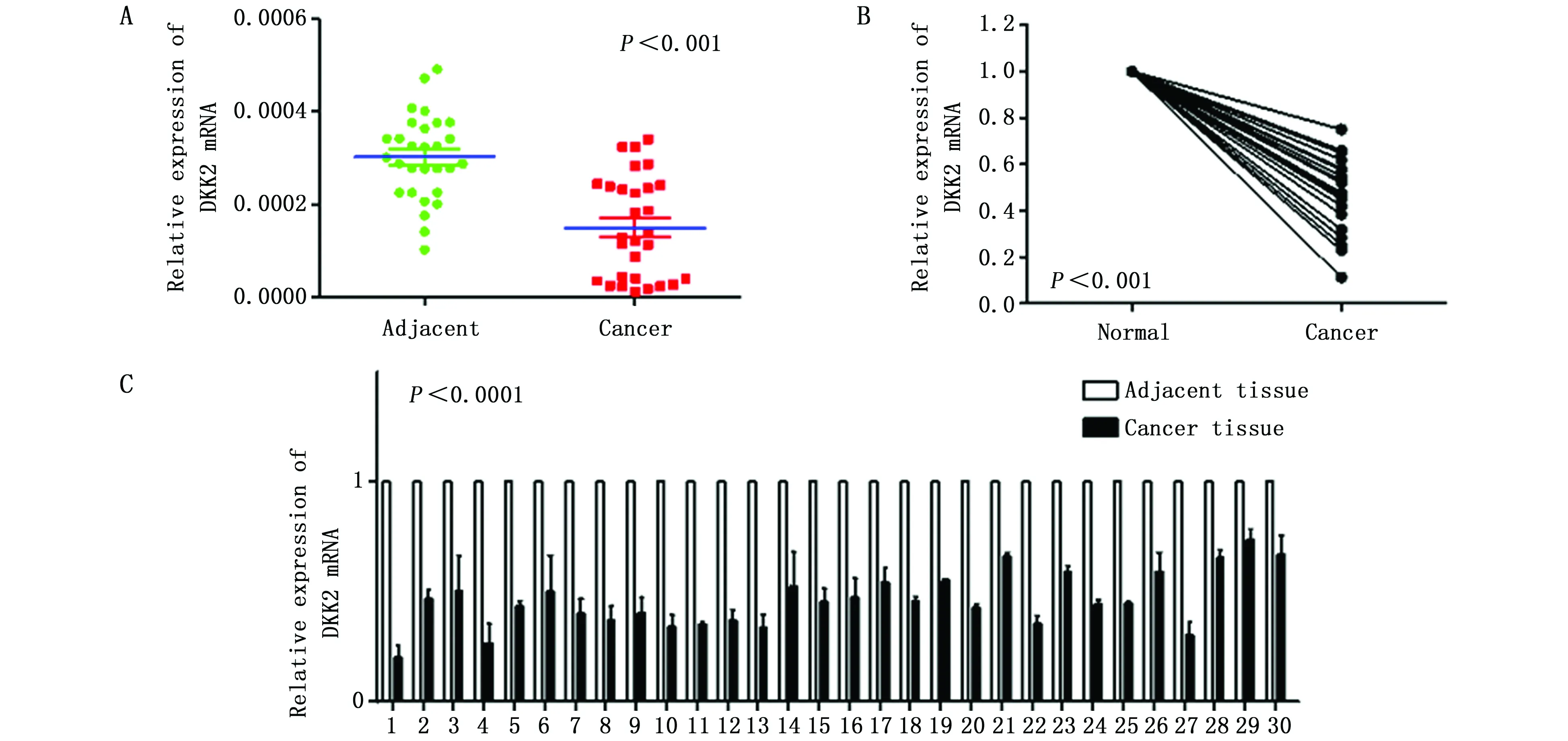
图2 DKK2 mRNA在儿童肾母细胞瘤组织表达Figure 2 The expression of DKK2 at mRNA level in childhood nephroblastomaNote:A.DKK2 mRNA was down-regulated in paired nephroblastoma tissues;B.DKK2 mRNA was down-regulated in non-paired nephroblastoma tissues;and C.DKK2 mRNA was down-regulated in paired nephroblastoma tissues.***P<0.01,when compared to the negative control group.
2.3 DKK2基因体外对肿瘤细胞增殖抑制
为验证DKK2是否作为功能性抑癌基因参与儿童肾母细胞瘤的进展,本研究对SK-NEP-1细胞进行DKK2过表达,RT-PCR和免疫蛋白印迹实验验证了DKK2的过表达(图3A)。CCK-8实验发现,与对照组相比,实验组SK-NEP-1细胞转染DKK2后,24 h、48 h和72 h后细胞存活率显著下降(P<0.01)(图3B);同时通过克隆形成实验发现,与对照组相比(100%),实验组SK-NEP-1细胞克隆形成的效率下降(31.23±4.18)%(P<0.001)(图3C)。
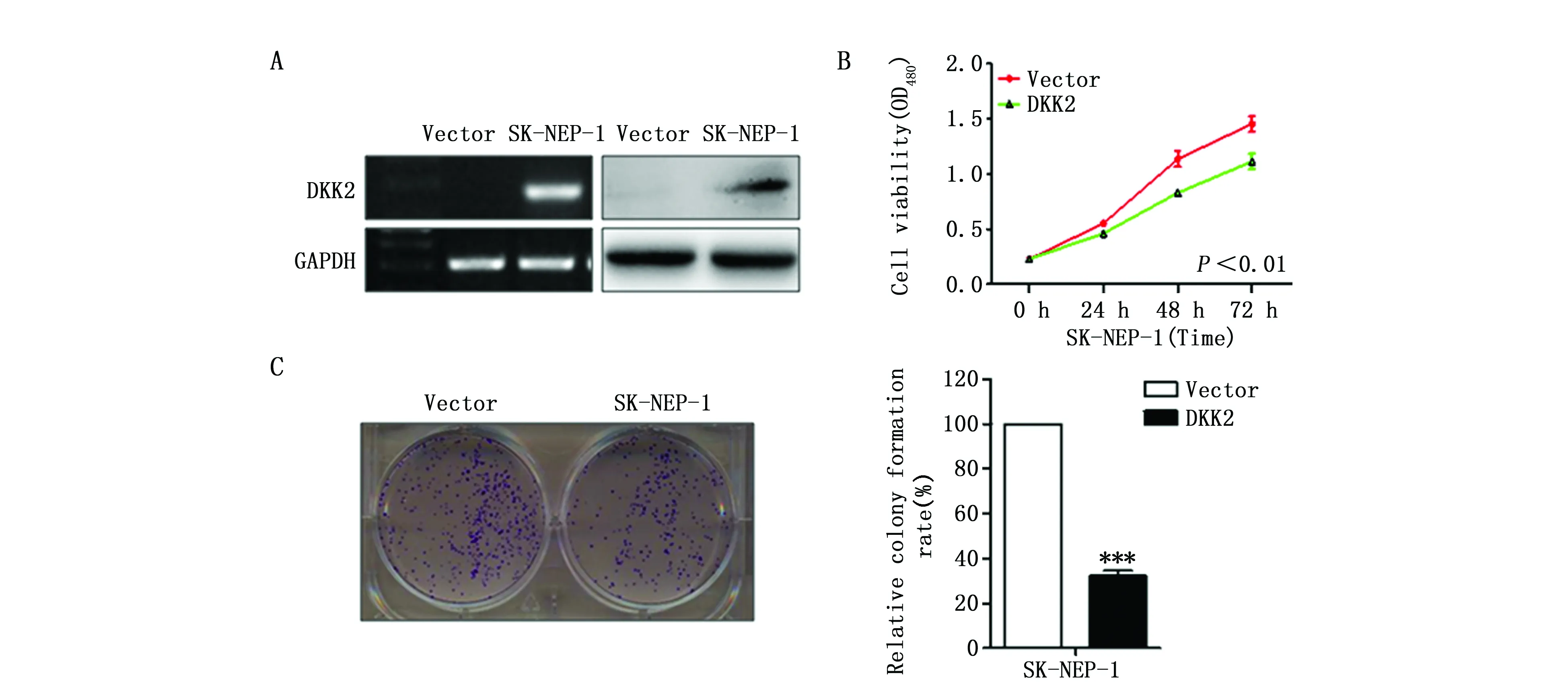
图3 DKK2对细胞增殖的抑制Figure 3 The inhibitory effect of DKK2 on proliferation of SK-NEP-1 cellsNote:A.The expression of DKK2 was examined in SK-NEP-1 cells by RT-PCR and Western blotting;B.Cell viability in over-expressed DKK2 SK-NEP-1 cells by CCK8 assay;and C.colony formation in over-expressed DKK2 SK-NEP-1 cells.***P<0.001,when compared to the negative control group.
2.4 DKK2基因对细胞周期和凋亡的影响
为验证DKK2抑制肿瘤细胞增殖的机制,流式细胞实验发现:儿童肾母细胞瘤细胞系SK-NEP-1过表达DKK2后,出现G0/G1期阻滞,与对照组(25.36±4.33)%相比,实验组中G1期细胞百分比明显增加(44.12±3.31)%,差异具有统计学意义(P<0.001)(图4A);流式细胞凋亡实验发现,儿童肾母细胞瘤细胞系中SK-NEP-1过表达DKK2后,细胞明显发生凋亡,凋亡细胞增加了(14.29±5.14)%,差异具有统计学意义(P<0.001)(图4B)。

图4 DKK2对细胞周期和凋亡的影响Figure 4 The effect of DKK2 on cell cycle and apoptosis in SK-NEP-1 cellsNote:A.The distribution of cell cycle in SK-NEP-1 cells;B.The apoptotic induction in SK-NEP-1 cells.***P<0.001,when compared to the negative control group.
2.5 DKK2基因体内对肿瘤细胞增殖抑制
前期体外实验中DKK2基因过表达能抑制肿瘤细胞的增殖,为进一步探讨DKK2是否可以改变裸鼠体内肾母细胞瘤细胞SK-NEP-1的增殖,本研究将实验组细胞和对照组细胞注入裸鼠皮下,在注射30天后从裸鼠切除肿瘤。结果显示,实验组小鼠的肿瘤大小和平均肿瘤重量显著降低(P<0.001)(图5A,5B)。免疫组化分析DKK2蛋白在实验组中的过表达,同时与对照组相比,细胞增殖相关蛋白Ki-67的表达显著减少(P<0.001)(图5C,5D)。
2.6 DKK2对Wnt/β-catenin信号通路的影响
为验证WNT信号通路调控因子DKK2对Wnt/β-catenin信号通路的影响及作用机制,分别取实验组和对照组细胞,提取总RNA和总蛋白,采用实时荧光定量PCR法和蛋白质印迹检测过表达DKK2后对active-β-catenin及下游靶基因的影响,结果显示,过表达DKK2后,active-β-catenin及下游的靶基因c-Myc,cyclinD1的表达明显受到抑制,而与细胞周期相关蛋白p21和p27的表达明显上调(P<0.001)(图6A,6B)。
3 讨论
WNT信号通路是高度保守的信号通路,在细胞增殖、组织分化、器官形成、免疫调控等病理生理过程发挥着重要的作用。肿瘤的形成是个多因素、多步骤参与的复杂过程;儿童肾母细胞瘤的发生发展和其他恶性肿瘤相似,是一个连续性、动态化的生物学过程[12-13]。近年来,人类基因组学研究的兴起,科研工作者们开始重视并致力于肾母细胞瘤相关基因的基础研究,拟解开其与肿瘤发生发展相关的基因和调控机制。对寻找诊断和治疗儿童肾母细胞瘤的靶点,以及儿童肾母细胞瘤靶向治疗及药物开发,最终达到改善患者预后具有十分重要的意义。
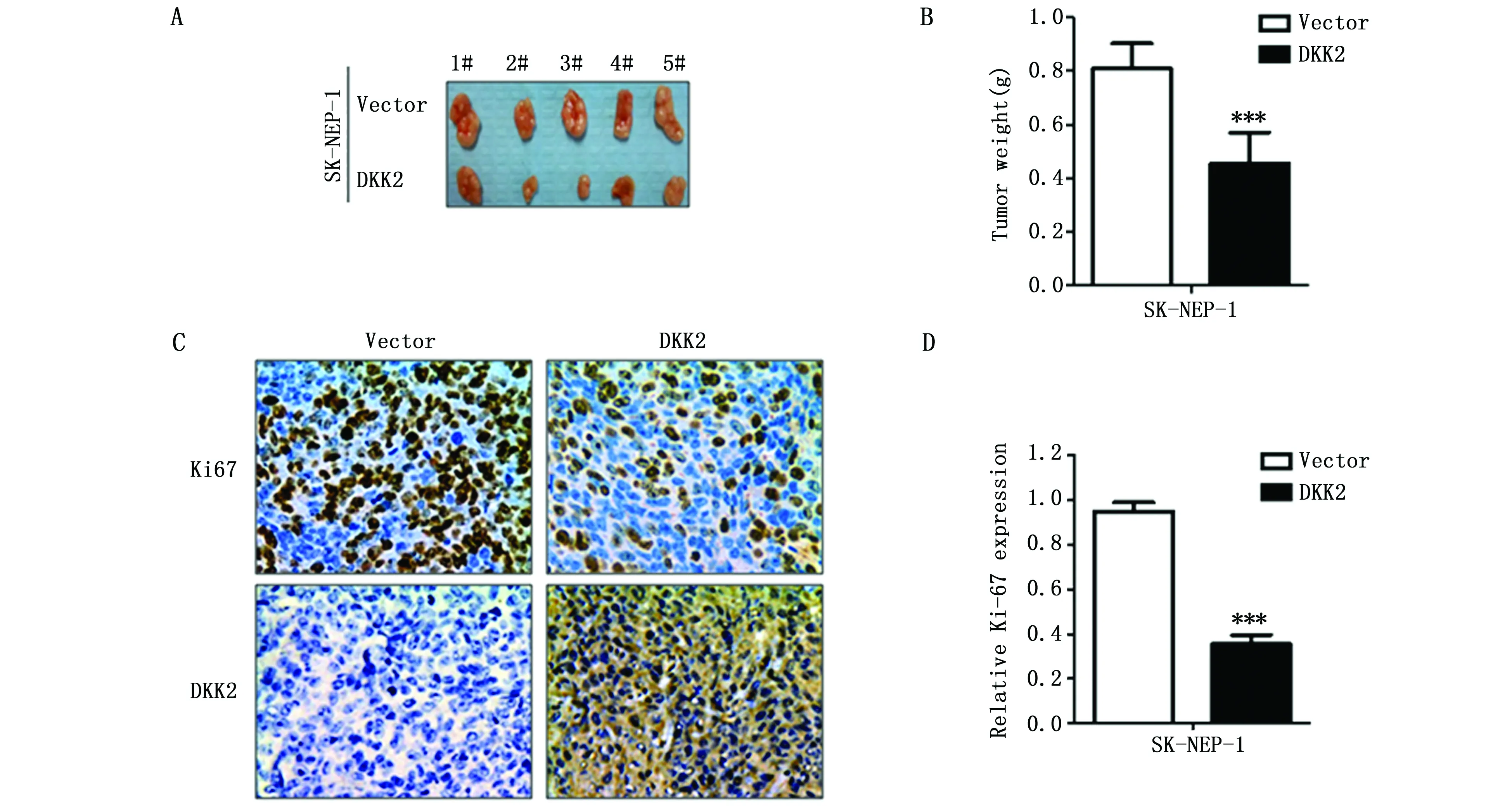
图5 DKK2在体内实验中抑制肿瘤的增殖Figure 5 Figure 5 DKK2 inhibited tumor growth in nude miceNote:A.Tumors derived from nude mice;B.Tumor weight in the experimental and control groups;and C.The expression of DKK2 and Ki67 in xenografts of mice(magnification ×400);and D.The statistical analysis of Ki-67 expression.***p <0.001,when compared to the negative control group.

图6 DKK2过表达后对Wnt/β-catenin信号通路的影响Figure 6 Effect of over-expressing DKK2 on protein expression rated to the Wnt/ beta-catenin signaling pathway in SK-NEP-1 cellsNote:A.The expression of c-Myc,cyclin D1,p21 and p27 protein was examined in over-expressed DKK2 SK-NEP-1 cells by Western blotting;B.The expression of c-Myc,cyclin D1,p21 and p27 mRNA was examined in over-expressed DKK2 SK-NEP-1 cells by qRT-PCR assay.***P<0.001,when compared to the negative control group.
WNT信号的异常激活导致肿瘤的发生;DKK2是经典WNT信号通路的调控因子,在人多种实体肿瘤中异常表达,作为潜在抑癌基因或癌基因参与癌症的组织、凋亡和转移。文献报道,DKK2在头颈部/口腔鳞状细胞癌(HNSCC/OSCC)中表达上调;高表达DKK2的头颈部/口腔鳞状细胞癌容易远处转移和预后较差[14]。DKK2在口腔粘膜白斑(OLK)和口腔黏膜下纤维化(OSF)中低表达,其在口腔粘膜白斑和口腔黏膜下纤维化发育不良中表达下调或丢失是进展至口腔癌的高危因素[15]。另有文献研究显示,DKK2在如乳腺癌细胞系和组织中表达下调或沉默,通过甲基化PCR研究发现,DKK2在78%的乳腺肿瘤样本中高甲基化,而在正常乳房和手术切缘中仅极少发生甲基化,可能作为甲基化特性抑癌基因参与乳腺癌的进展。但DKK2在儿童肾母细胞的中尚未见报道和研究。
本研究我们首先用qRT-PCR法检测了DKK2 mRNA儿童肾母细胞瘤细胞系和组织中的相对表达情况。研究发现,与正常肾上皮细胞相比,DKK2 mRNA在肾母细胞瘤细胞SK-NEP-1中表达下调;同时在组织表达的研究发现,在配对和非配对的临床样本组织中,DKK2 mRNA在儿童肾母细胞瘤组织中表达明显下调,可能作为潜在的抑癌基因参与儿童肾母细胞瘤的进展。为证实DKK2是否为功能性的抑癌基因参与儿童肾母细胞瘤的进展,通过CCK-8实验发现转染pcDNA3.1(+)-Flag-DKK2质粒后实验组细胞在24、48、72 h的细胞增殖活性明显低于对照组;同时为进一步明确DKK2抑制儿童肾母细胞瘤细胞增殖的机制,通过流式细胞实验发现,过表达DKK2后的SK-NEP-1细胞,细胞周期明显阻滞与G1期;同时过表达DKK2后的SK-NEP-1细胞的凋亡细胞明显增加;与文献中报道相一致[4-6]。而在体内实验中,本课题研究发现,与对照组相比,过表达DKK2后,裸鼠体内的肿瘤体积和肿瘤质量受到了明显的抑制。因此,通过体内实验和体外实验我们可以推测DKK2可能作为潜在的抑癌基因参与儿童肾母细胞瘤的进程。为进一步明确DKK2抑制儿童肾母细胞瘤细胞增殖的分子机制,通过qRT-PCR和WB实验发现,过表达DKK2后的SK-NEP-1细胞,active-β-catenin及下游的靶基因c-Myc,cyclinD1的表达明显受到抑制,与前期实验和文献报道相一致[4-6]。
综上所述,DKK2基因在儿童肾母细胞瘤组织中表达下调,过表达DKK2后通过促进细胞周期阻滞和诱导,从而抑制儿童肾母细胞瘤细胞增殖。
