MRI鉴别诊断表现为磨玻璃结节的早期浸润性肺腺癌
2019-03-25,,,,
, ,, ,
(河北医科大学第四医院CT和MRI科,河北 石家庄 050011)
自20世纪90年代起,肺癌筛查结果显示肺腺癌的发病率较高,占所有检出肺癌的76%[1]。不同亚型肺腺癌预后不同,不典型腺瘤样增生(atypical adenomatous hyperplasia, AAH)和原位腺癌(adenocarcinoma in situ, AIS)患者的5年无瘤生存率可达100%,微浸润性腺癌(minimally invasive adenocarcinoma, MIA)患者的5年无瘤生存率接近100%,而其他浸润性肺腺癌患者的5年无瘤生存率约40%~85%[2]。鉴别诊断肺腺癌对指导临床医师选择治疗方案意义重大[3]。CT是肺部疾病的首选检查方法,但有辐射,可增加人群患癌风险[4],且CT对早期肺癌的鉴别诊断价值有限[5-6]。胸部受呼吸运动影响,且肺组织含气体较多,既往MRI较少用于肺部病变,但随着MR技术的发展,成像速度不断加快,其在肺部的应用受到重视[7-9]。有研究[10]表明肺磨玻璃结节的MRI特征可能与其组织成分有关,提示MRI可能有助于鉴别诊断肺结节。本研究探讨MRI鉴别诊断以磨玻璃结节为表现的浸润性肺腺癌的价值。
1 资料与方法
1.1 一般资料 回顾性分析2015年12月—2017年12月于本院接受CT及MR检查的34例肺腺癌,均为单发,男14例,女20例,年龄26~83岁,平均(55.8±12.1)岁。纳入标准:①CT表现为磨玻璃结节;②CT与MR检查的间隔在2周以内;③结节最大径6~30 mm;④均接受手术治疗并经病理证实为腺癌。排除MRI未能显示的病变。根据病理结果,将患者分为非浸润性腺癌组(n=15)和浸润性腺癌组(n=19)。非浸润性腺癌组男8例,女7例,年龄41~83岁,平均(57.7±10.8)岁,病理类型包括AAH、AIS和MIA;浸润性腺癌组(n=19),男6例,女13例,年龄26~71岁,平均(54.4±13.1)岁,病理类型均为浸润性腺癌。
1.2 仪器与方法 采用Siemens Skyra 3.0T超导型MR扫描仪,18通道表面相控阵线圈。检查前指导患者进行吸气、屏气及呼气练习。采用螺旋桨技术三维容积内插屏气扰相梯度回波序列(Star-3D gradient-recalled-echo volume-interpolated breath-hold examination, T1-Star-VIBE)采集T1WI,TR 3.87 ms,TE 1.8 ms,翻转角12°,层厚2 mm,层间距1.2 mm,FOV 400 mm×400 mm,矩阵320×192。半傅里叶采集单次激发快速自旋回波(half-Fourier-acquired single-shot turbo-spin-echo, HASTE)序列,TR 1 600 ms,TE 95 ms,翻转角180°,层厚5 mm,层间距1 mm,FOV 380mm×285 mm,矩阵320×224;采用TSE序列采集T2WI,TR 2 500 ms,TE 79 ms,翻转角150°,层厚5.5 mm,层间距1.0 mm,FOV 380 mm×380 mm,矩阵320×320。DWI采用EPI序列,TR 5 000 ms,TE 60 ms,层厚5 mm,层间距2 mm,FOV 400 mm×400 mm,矩阵128×128,b值取0、200、400、600、800 s/mm2,NEX 4。
1.3 图像分析 观察并记录病变最大径;于T2WI沿病灶轮廓手动勾画ROI,尽量包括病灶边缘,测量病变T2WI信号强度;为尽量排除ADC值中灌注成分,采用b值为0和800 s/mm2的DWI图像经Siemens Syngo MultiModality Workplace VE40C后处理工作站自动拟合生成ADC图像,参考同层面其他序列图像手工勾画ROI,尽量包括病灶边缘,记录ADC值。所有数据测量3次,取平均值。
1.4 统计学分析 采用SPSS 21.0统计分析软件。符合正态分布的计量资料以±s表示,采用两独立样本t检验比较2组病变最大径、T2WI信号强度、ADC值。计数资料比较采用χ2检验。以ROC曲线评价MRI指标诊断浸润性肺腺癌的效能。P<0.05为差异有统计学意义。
2 结果
2组间性别(χ2=1.64,P=0.20)、年龄(t=0.79,P=0.44)差异均无统计学意义。
非浸润性腺癌组病变最大径为(9.91±2.63)mm,小于浸润性腺癌组[(13.12±2.71)mm],差异有统计学意义(t=-3.41,P<0.01)。非浸润性腺癌组病变的T2WI信号强度为92.97±8.33,低于浸润性腺癌组(113.57±22.88),差异有统计学意义(t=-3.60,P<0.01)。非浸润性腺癌组病变ADC值为(0.98±0.22)×10-3mm2/s,低于浸润性腺癌组[(1.34±0.31)×10-3mm2/s],差异有统计学意义(t=-2.70,P=0.01)。见图1、2。
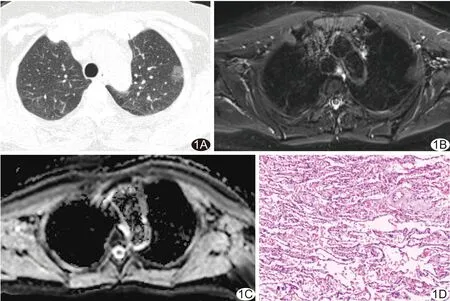
图1 患者女,56岁,左肺上叶MIA A.CT肺窗图像示左肺上叶磨玻璃结节; B.左肺上叶小片状T2WI稍高信号,信号均匀; C.ADC图,病变ADC值为0.44×10-3 mm2/s; D.病理图(HE,×40)

图2 患者女,60岁,左肺上叶IAS A.CT肺窗图像示左肺上叶部分实性结节; B.左肺上叶小片状T2WI稍高信号,信号不均匀; C.ADC图,病变ADC值为1.32×10-3 mm2/s; D.病理图(HE,×40)
病变最大径、T2WI信号强度和ADC值鉴别诊断浸润性腺癌组与非浸润性腺癌组的效能见表1,ROC曲线见图3。其中病变最大径鉴别诊断浸润性腺癌与非浸润性腺癌的AUC为0.791,临界值为11.52 mm,敏感度为73.72%,特异度为73.33%。
3 讨论
近年来CT多用于诊断及随访肺结节,但多数结节需多次重复扫描,增加了辐射剂量[4]。MR为无辐射检查方法,近年来将其用于肺结节的研究[11-12]逐渐增多,且结果表明其有助于鉴别诊断良恶性肺结节。但既往研究[7-9]大多针对肺部实性结节,并未纳入磨玻璃结节,其原因在于磨玻璃结节实性成分少,周围磁场不均匀,MR信号弱,成像效果较差。本研究采用3.0T超导型MR扫描仪,HASTE序列和T2-TSE序列图像不仅可显示结节的实性成分,也可显示磨玻璃成分,其原因在于:①3.0T MRI信噪比高,更有利于显示病变;②HASTE序列及T2-TSE序列可敏感显示含水量较高的病变。本研究中,虽然DWI对部分磨玻璃结节显示不佳,存在伪影,但结合观察其他序列图像,可辨认并测量DWI及ADC图像中的肺磨玻璃结节。
虽然病理上MIA伴微浸润,但患者5年无瘤生存率高,且临床对MIA的处理与AAH、AIS类似,可进行局限性肺切除(楔形切除、肺段切除等)[2-3,13],而对于浸润性腺癌则多需进行肺叶切除,且预后较差,因此本研究将MIA、AAH、AIS均归为非浸润性腺癌组。

表1 病变最大径、T2WI信号强度和ADC值鉴别诊断浸润性腺癌与非浸润性腺癌的效能
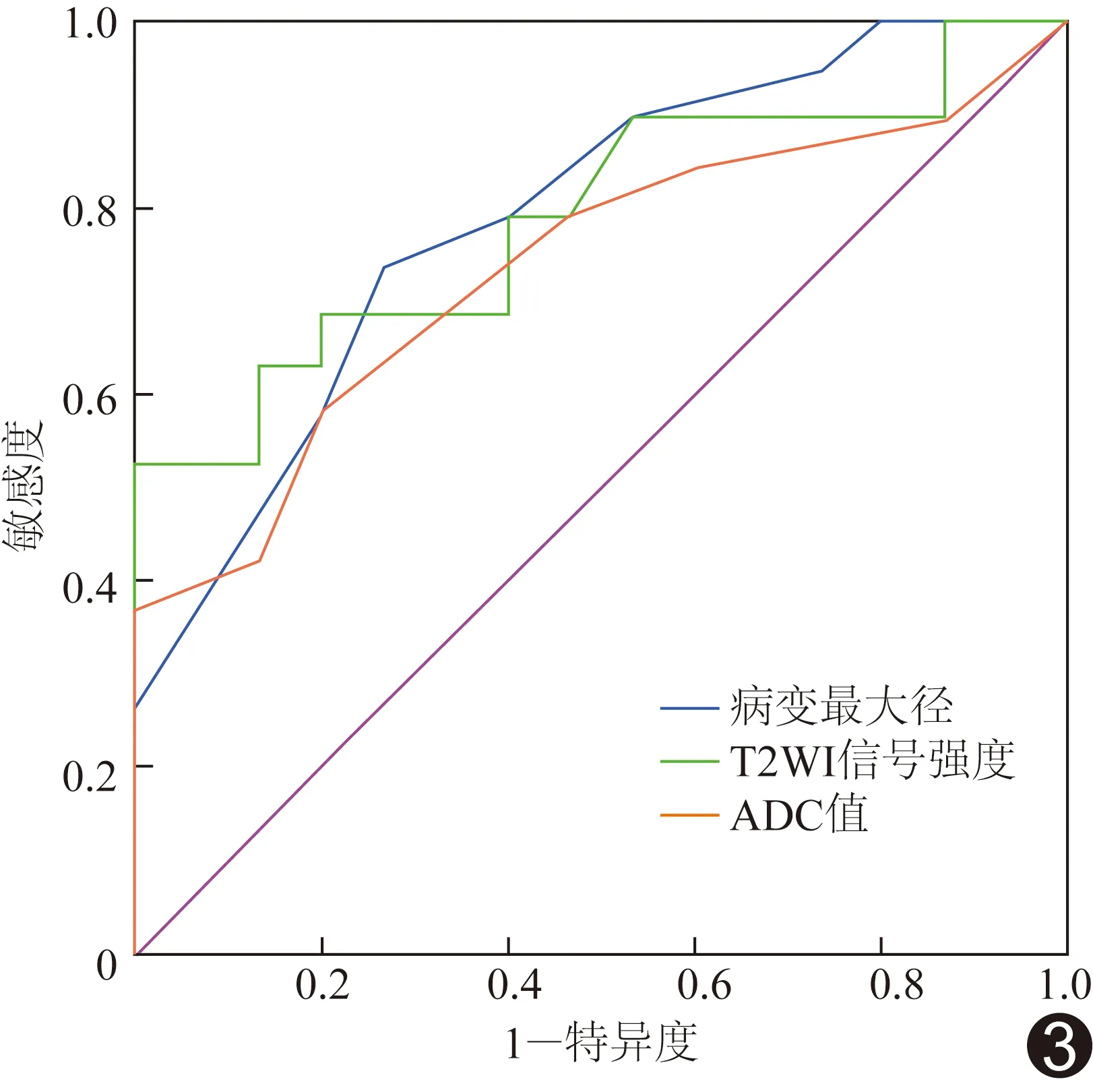
图3 病变最大径、T2WI信号强度和ADC值鉴别诊断浸润性腺癌与非浸润性腺癌的ROC曲线
本研究结果显示,浸润性肺腺癌结节的最大径大于非浸润性腺癌结节,考虑原因在于前者恶性程度高,生长速度快。本组根据结节最大径判断磨玻璃结节为非浸润与浸润性病变的AUC最大,为0.791,临界值为11.52 mm,略小于既往研究[14-15]报道的CT临界值。推测其原因,除MRI层厚较厚导致的部分容积效应外,还可能与结节边缘与肺交界处磁场不均匀,T2*效应造成质子失相位加快,MR信号衰减严重有关,使MRI显示的磨玻璃结节较CT偏小。
本研究显示浸润性肺腺癌的T2WI信号强度高于非浸润性腺癌,可能因浸润性腺癌实性成分较多,细胞代谢旺盛,含水量增高,坏死成分较多,造成及其T2延长,MRI表现为T2WI高信号。Koo等[10]研究显示恶性肺结节的T2及T2*值均高于良性结节,本研究结果与之相似。本组根据T2WI信号强度诊断浸润性肺腺癌的AUC为0.789,特异度为100%,但敏感度仅52.59%,可能因采集T2WI时层厚较厚,部分容积效应较重,对于较小结节的测量值偏低。
DWI可无创检测组织水分子布朗运动,ADC值为定量测量水分子扩散程度的指标,常用于鉴别良恶性病变。恶性肿瘤组织内细胞致密,水分子运动阻力大,扩散受限,DWI呈较高信号,ADC值较低。本研究结果显示ADC值可用于鉴别2组病变,浸润性腺癌组的ADC值高于非浸润性腺癌组,可能是由于非浸润性腺癌组内细胞成分复杂,包括淋巴细胞增生、纤维化、肉芽肿和其他炎性细胞;而浸润性肺腺癌内细胞成分较单一,且可能存在坏死成分,造成ADC值偏高;另外,浸润性肺腺癌中实性成分的组织学基础可能是腺泡[16],腺泡中的水分子扩散无明显受限,也使ADC值升高。
本研究的局限性:样本量较少,可能使结果产生偏倚,还需进行大样本量的队列研究;MRI对于肺磨玻璃结节的显示能力有待提高;计算ADC值时使用单指数模型,ADC值有可能偏高。
综上所述,MRI对于鉴别诊断以磨玻璃结节为表现的浸润性肺腺癌具有一定价值。
