丙二酸二乙酯加氢制备1,3-丙二醇反应动力学研究
2019-03-22余锦涛曹景顺魏永梅田恒水
余锦涛,曹景顺,王 涛,魏永梅,田恒水
(华东理工大学 化工学院,上海 200237)
关键字:动力学;丙二酸二乙酯;1,3-丙二醇;铜基催化剂
随着石油资源的枯竭和环境问题的频发,使得利用传统化学工业生产化学品受到了严峻挑战。近年来,利用合成气,二氧化碳和生物质等资源生产高附加值的化学品成为研究的热点[1-4]。其中,利用酯加氢技术制备醇类化合物是一条绿色无污染和符合我国能源结构的技术路线。目前,多种醇类包括乙二醇,γ-丁内酯,1,4-丁二醇,四氢呋喃和 1,3-丙二醇高附加值和应用广泛的化学品都可以通过草酸酯,马来酸二甲酯和丙二酸二乙酯(DEM)加氢制得[5-9]。相比其他二醇类,1,3-丙二醇不仅仅广泛应用于油墨、染料、制冷剂,还用于合成对苯二甲酸丙二醇酯(PTT)[10]。由于其合适的碳链长度,使得PTT展示比相关聚酯纤维更加优异的性质[11]。而工业较成熟的丙烯醛水合加氢法和环氧乙烷羰基化法都需要有毒的催化剂和苛刻的反应条件,使得1,3-丙二醇产量不高且市场紧俏[12]。
利用丙二酸二乙酯催化加氢制备1,3-丙二醇是一条利用可再生资源的绿色途径。另一方面,铜基催化剂因具有选择性活化C=O键和C-O键,且SiO2载体具有较大的比表面积(~400m2/g)和可调控的形貌,使得Cu/SiO2催化剂在酯加氢反应过程中展现出良好的催化性能[13-15]。为了高活性催化丙二酸二乙酯选择性制备1,3-丙二醇,Cu/SiO2催化剂受到了广泛研究。Ding等[8,16,17]首先验证了丙二酸二乙酯加氢制备1,3-丙二醇工艺路线的热力学可行性,继而研究了Cu/SiO2催化剂焙烧温度和催化剂助剂对催化性能的影响。Zheng等[18]指出了丙二酸二甲酯加氢过程中的反应网络,并提出了副反应途径和Cu/SiO2中活性组分价态可调控加氢产物的分布。可以看出,通过表征和合理设计催化剂可以有效提高丙二酸酯选择性加氢生成1,3-丙二醇。然而,利用Cu/SiO2催化剂得到加氢制备1,3-丙二醇的收率依然不高(<50%),且副反应严重,直接使得该工艺路线受到限制。故进一步认识丙二酸二乙酯加氢过程和铜基催化剂在反应中的详细催化过程是合理设计催化剂的必要途径。
微反应动力学提供了认识催化反应过程的有效途径。Xu等[19]对草酸二乙酯加氢制备乙二醇进行了微反应动力学研究,确定了草酸酯在铜基催化剂表面反应为速率控制步骤(RDS),并且建立了在一定温度内适定的反应速率表达式。Li等[20]建立了草酸二甲酯的反应动力学,筛选出了合适的动力学模型,指出酯在铜活性位点的表面解离为速率控制步骤而且验证了铜基催化剂的Cu0和Cu+都是活性组分。因此,通过微反应动力学有助于认识酯加氢的具体反应机理。筛选出酯加氢过程中的速率控制步骤,可以帮助合理改性铜基催化剂从而增强催化活性。对于丙二酸二乙酯加氢过程,不仅仅有过度加氢产物正丙醇,还有平行反应的副产物丙酸乙酯生成。因此,建立微反应动力学对于加强铜基催化剂在该过程中的活性和认识反应机理具有重要意义。
本文采用自制的Cu/SBA-15催化剂,在不同条件下进行加氢实验得到动力学数据,建立了不同反应机理和速率控制步骤的数学模型。通过与实验值的对比,得到适定的数学模型和较合理的反应机理,并给出反应速率表达式,为合理设计适合丙二酸二乙酯加氢过程的铜基催化剂提供了基础。
1 实验部分
1.1 催化剂的制备
采用蒸氨法制备Cu/SBA-15催化剂[9]。将一定量的Cu(NO3)2·3H2O溶解于三口烧瓶中,用25%的氨水溶液滴入烧瓶,控制pH至11.0。待完全反应后,将SBA-15粉末加入烧瓶中,40℃下搅拌老化4h。将溶液加热升温至90℃,蒸去剩下的氨水待pH为7时停止加热。过滤,洗涤,放入烘箱中过夜。450℃焙烧4h压片造粒后放入固定床中。300℃活化后待用。
1.2 动力学实验
气相DEM加氢实验在内径为10mm的反应器中进行。将一定体积的催化剂放入固定床恒温段中,两端填充石英砂。热电偶温度计跟踪床层温度,背压阀和精密压力表控制反应器压力。还原活化之后,DEM的乙醇溶液(wDEM=7.5%)用高压恒流泵连续注入反应器中。待反应达到稳定(5h)后,收集产品。用配备HP-5毛细柱的气相色谱GC-9800内标法(碳酸二乙酯为内标)进行分析。动力学实验数据温度:180~200℃,液时空速(LHSV):0.5~5.5h-1,氢酯物质的量比:230~430,压力:3~5MPa。
2 实验结果与讨论
2.1 内外扩散影响的消除
研究本征动力学反应,需要消除内外扩散的影响[20,21]。为考察内扩散的影响,筛分不同粒度的催化剂颗粒,并进行丙二酸二乙酯加氢实验。为考察外扩散影响,在相同的液时空速下,控制催化剂装填量,进而改变气体流速。如图1a所示,液时空速在较大范围内(>0.3h-1)可以保证外扩散影响可以忽略不计。然而,当液时空速低于0.3h-1时,气速较慢一组,催化性能开始出现下降,说明在液时空速低于0.3h-1,外扩散影响开始显著。如图1b所示,三种不同目数的催化剂展现出相似的催化结果,说明内扩散影响可以忽略。故为保证动力学数据能反应本征动力学特征,采用目数为40~60目和液时空速大于0.3h-1条件下获得,可保证消除内外扩散影响,获取的部分动力学数据汇总于表1中。
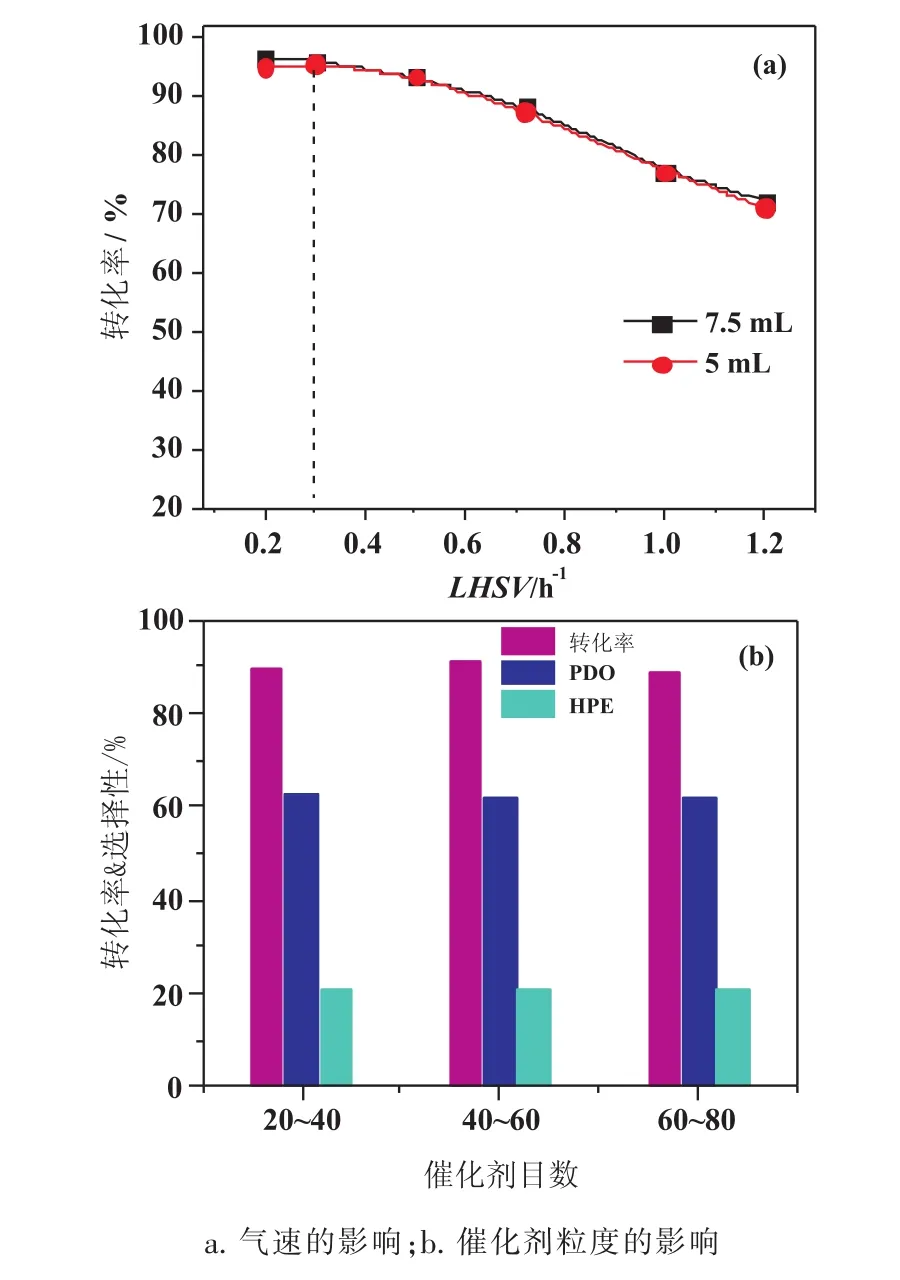
图1 内外扩散对丙二酸二乙酯加氢影响
2.2 反应机理推测和模型建立
草酸酯加氢反应和马来酸二甲酯等常见的双酯类加氢都是串联反应,即先部分加氢生成中间产物,继而进一步加氢生产乙二醇和1,4-丁二醇。目前,较为认同的丙二酸二乙酯加氢过程则主要包括以下4个反应。其中,在铜基催化剂作用下,式(1)和(2)是常见的串联反应,代表铜基催化剂选择性对酯基的加氢反应。而式(3)和(4)是羟基加氢的副反应。式(3)是1,3-丙二醇的羟基过度加氢反应。类似的副反应也常见于其他同系物二酯类的加氢反应中。与其他二酯类不同的是,该加氢过程包括式(3),即中间产物3-羟基丙酸乙酯的羟基加氢反应。该步反应是相对于主反应的平行反应。故对于丙二酸二乙酯体系而言,可看作由酯基加氢的主反应(式(1)、(2))和羟基加氢的副反应(式(3)、(4))两大类反应构成。
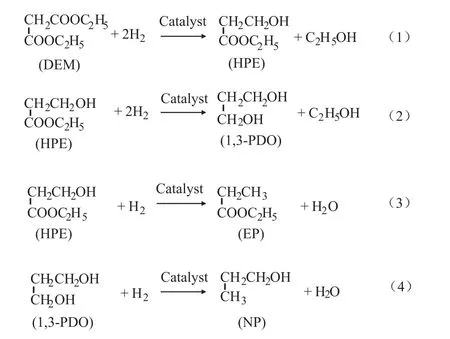
图2 丙二酸二乙酯加氢过程主反应和副反应
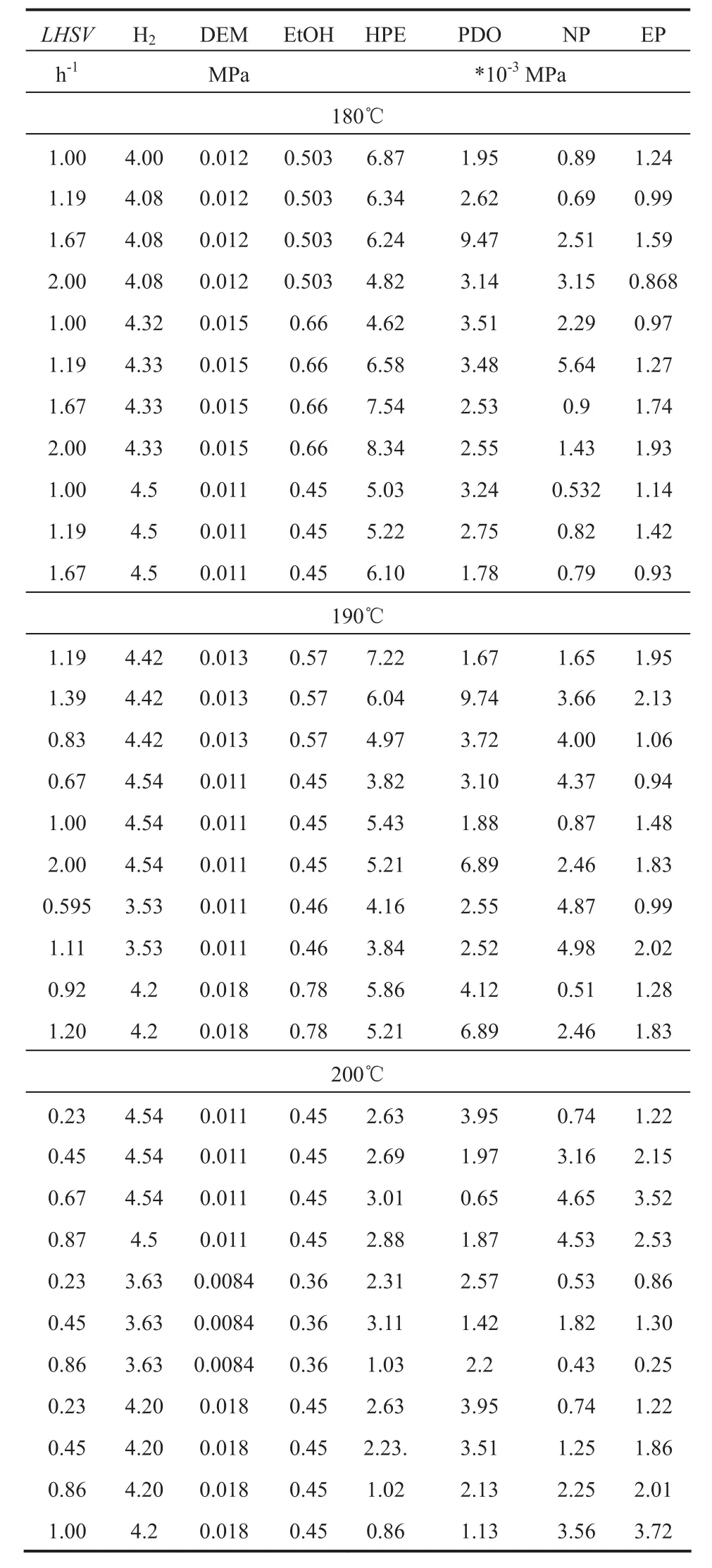
表1 部分动力学实验数据
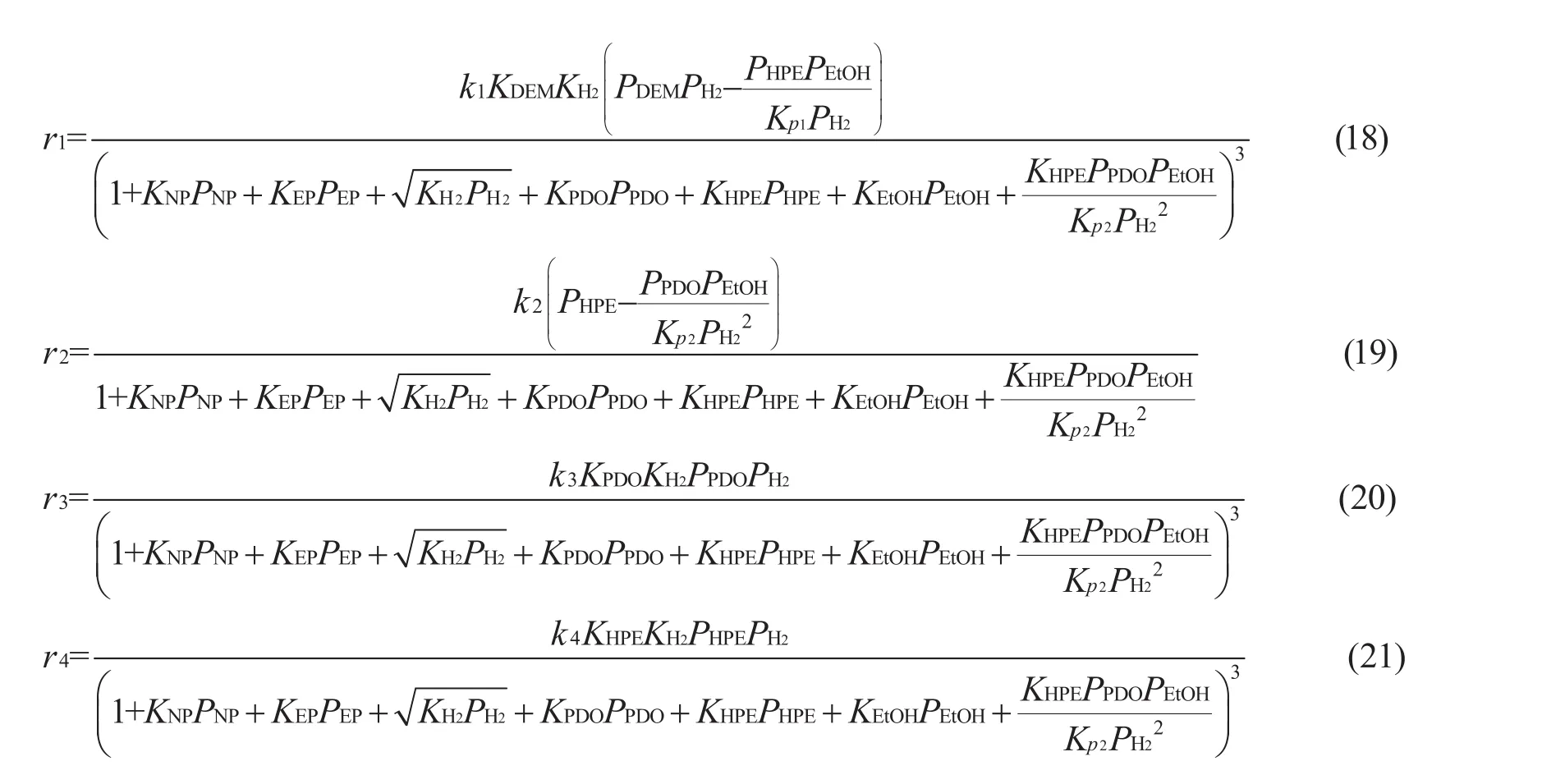
一般认为,酯类在铜基催化剂表面的加氢符合Langmuir-Hinshelwood模型[21-23]。据此,可将上述丙二酸二乙酯加氢反应过程分解为:(1)氢气和丙二酸二乙酯反应物在铜活性位点上吸附;(2)铜活性中心上吸附活化的反应物进行基元反应,生成相应的产物;(3)生成的产物从活性中心位上的脱附。对于宏观的反应速率,根据稳态近似法可以视为速率控制步骤(RDS)的反应速率。酯的吸附方式则包括解离吸附和非解离吸附(分子吸附),氢气的吸附方式亦有解离吸附和非解离吸附的可能[21,24]。故根据不同的吸附方式和不同的速率控制步骤可以假设出不同的反应机理。再根据稳态近似法可以推导出相应的双曲型本征反应速率表达式[25]。如图3所示,以氢气的解离吸附和酯的非解离吸附为例,可以推测基元反应步骤如(5)~(17)式所示。值得注意的是,过度加氢反应往往可以适当简化,这是因为过度加氢反应选择性较小或者水分子在铜金属位点吸附能力较弱[19,20]。对于较复杂的丙二酸二乙酯加氢反应,过度加氢生成丙酸乙酯和正丙醇的副反应,即(3)和(4)式,其基元反应步骤可简化为(14)~(17)式。 相应的速率表达式如(18)~(21)式所示,其中Kpi来源于相关热力学相关文献[26]。

图3 氢气解离吸附和酯分子吸附反应机理
2.3 动力学模型检验
本征动力学模型数学表达式的求解,应使得模型计算值与实验值相吻合。目标函数可表示为(22)式:
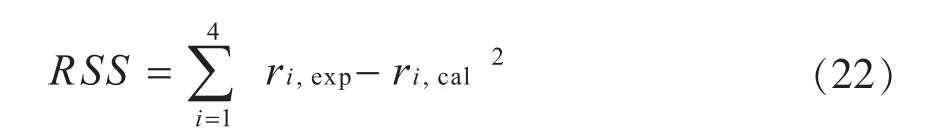
求解过程在Matlab上完成,为保证参数准确性,先使用Ga函数全局优化算法求解,以解得的值为初值,再使用lsqnonlin函数局部优化算法求解精确值。解得的目标函数RSS最小,且模型中的参数应符合:
(1)反应速率常数ki和吸附平衡常数Ki都为正数;
(2)反应速率常数和吸附平衡常数应分别符合Arrhenius 方 程和 Van’t Hoff方程
(3)一般的,由(2)计算出的活化能为正值,吸附焓为负值;
(4)与实验数据吻合良好。
根据以上判据,通过不同模型的筛选,可以得到合适的模型。如图3所示,其中,氢气分子以解离吸附方式在铜活性中心表面,而酯分子以非解离形式吸附在铜活性中心表面。 步骤 (7),(9),(14)和(16)为速率控制步骤。 速率表达式为(18)~(21)式。不同温度下,得到的实验值与模型计算值如图4所示。可见,计算值和实验值较为吻合且在较大范围内能分布在上下两边。进一步的,通过该模型计算得到的吸附平衡常数和反应速率常数总结于表2中。可见所有数值均大于零。使用Arrhenius方程和Van’t Hoff方程对温度拟合,结果总结于图5中,可见吸附平衡常数和反应速率常数均有较好的线性规律。
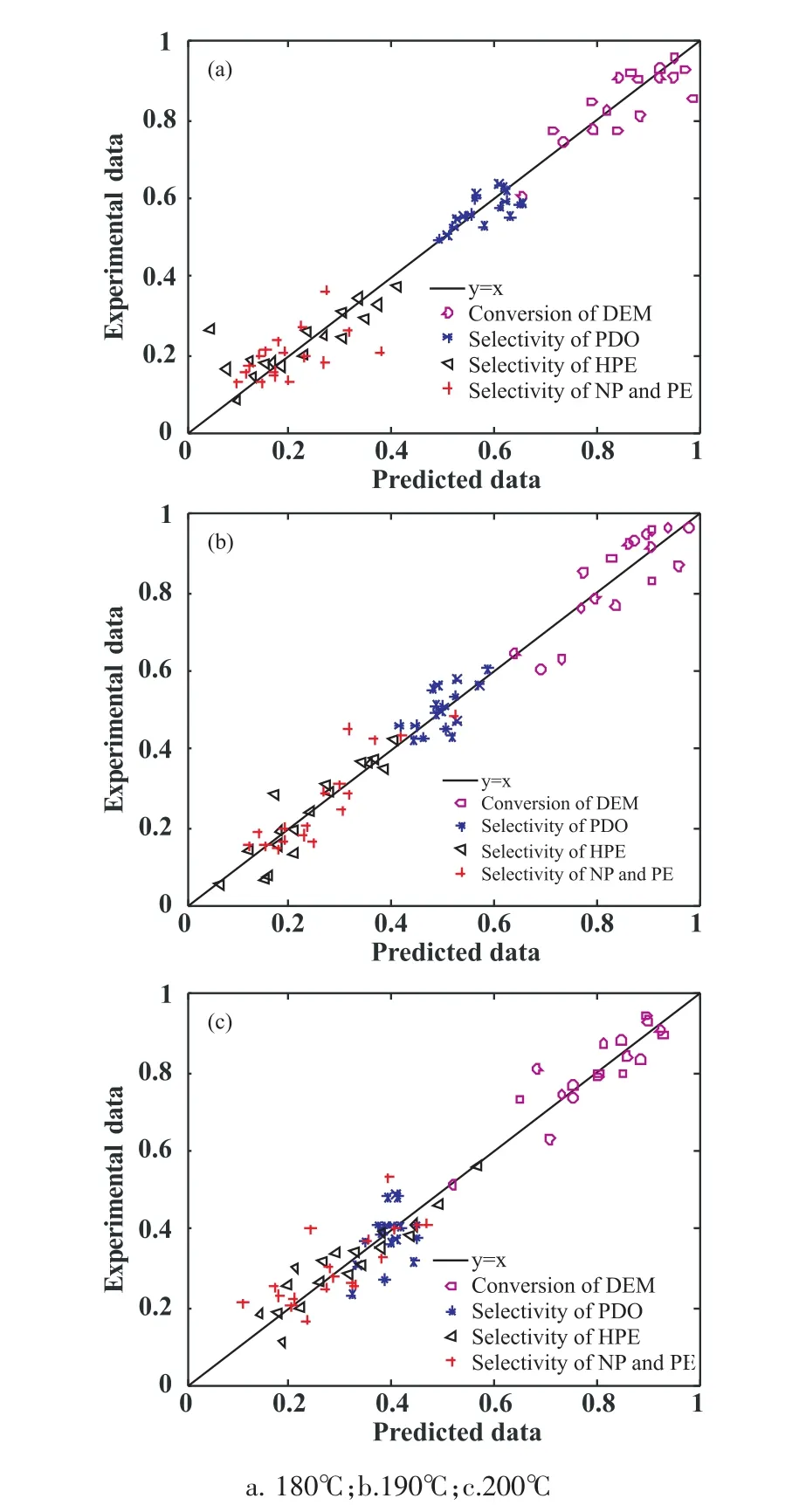
图4 模型计算值与实验值对比
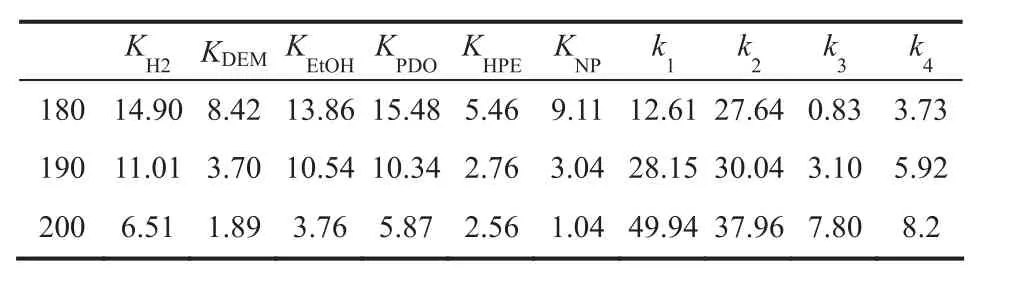
表2 不同温度下吸附平衡常数Ki(MPa-1)和速率常数ki(mol/h)计算结果
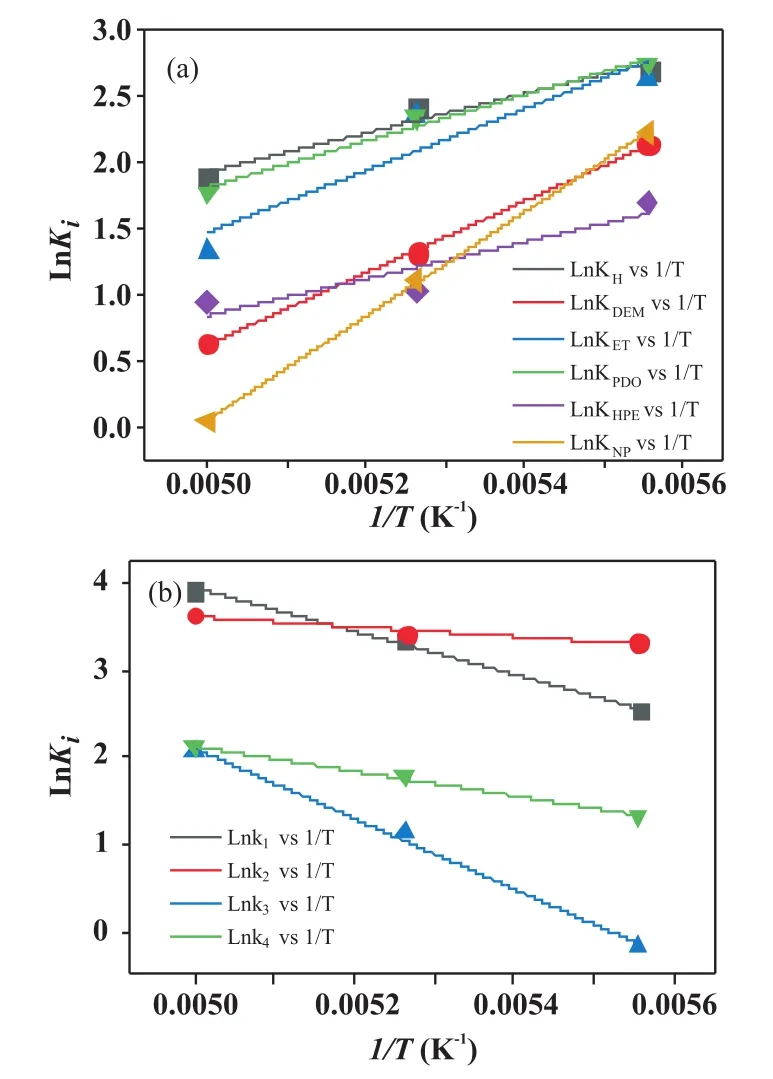
图 5 LnKi(a)和 Lnki(b)对 1/T关联图
2.4 参数计算和讨论
由Arrhenius方程和Van’t Hoff方程计算得到的计算结果汇总与表3和表5中。可见,吸附平衡常数皆为负值,活化能皆为正值。此外,吸附平衡常数还应满足Boudart等提出的热力学判据[27],即:
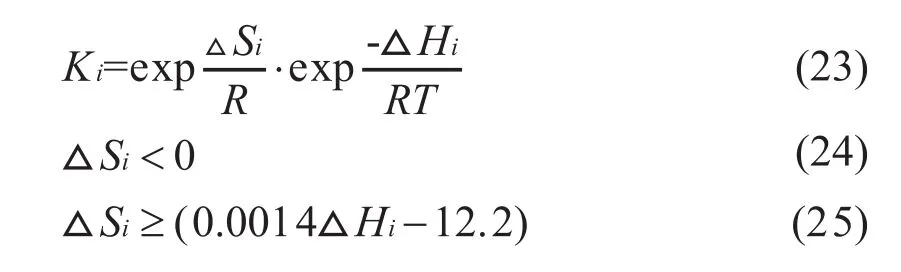
热力学判据计算结果汇总于表3中,可以看出,各组分能够较好的满足热力学检验,说明利用本模型计算出的吸附平衡常数较为可靠。
进一步的,降低活化能是催化反应的关键。由表5所示,主反应中的酯加氢步骤活化能Ea1与Ea2之和小于副反应羟基加氢活化能Ea3与Ea4之和,印证了铜基催化剂具有选择性活化酯基(C=O)和催化酯加氢制备醇类物质的能力[28]。同时也印证了在较高温度下(>200℃)时,脱水副反应更容易发生。这也在其他双酯类加氢过程中得到印证[29,30]。因为在铜基催化剂催化下,副反应活化能更高,对反应温度更加敏感。模型计算结果显示指前因子k20较小,说明主反应中第二步加氢更为困难,说明铜基催化剂具备较高的活性对第二步加氢反应更为重要。此外,指前因子k30和活化能Ea3都大于k40和Ea4,也印证了在实际丙二酸二乙酯加氢反应中,副产物丙酸乙酯比副产物正丙醇更容易生成[18]。故合理的设计铜基催化剂,使其能在较低温度下且具有较好的催化活性[31](例如,减小粒径和增大比表面积和活性位分散度)。同时,选择性催化丙二酸二乙酯加氢同时抑制丙酸乙酯的生成,是提高1,3-丙二醇收率的关键。值得注意的是,在图4,表3和表5中,部分少量实验点与计算值没有很好的吻合,计算所得的活化能还有少量误差。这可能由于丙二酸二乙酯加氢体系还存在其他反应机理,例如,双活性位点Cu0和Cu+的协同催化作用[32,33]。
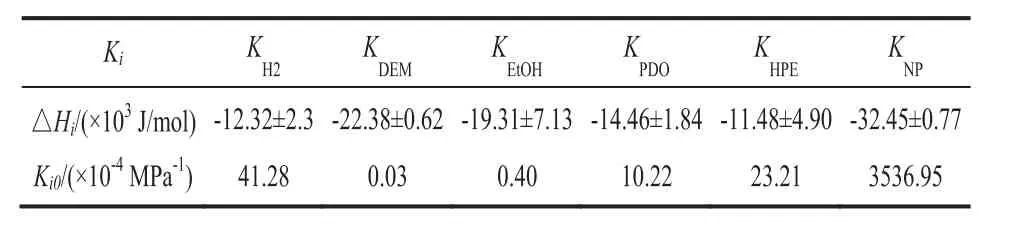
表3 吸附焓和吸附指前因子计算结果
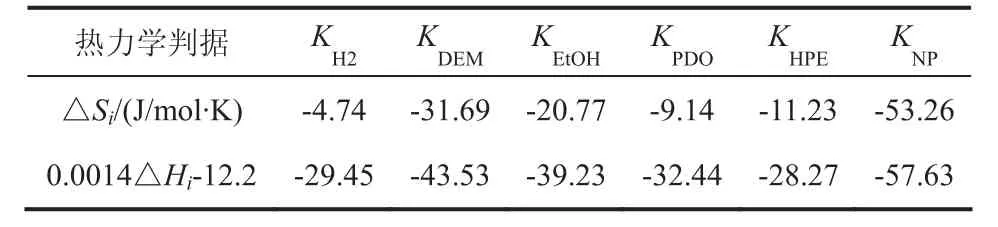
表4 热力学检验结果

表5 活化能和指前因子计算结果
3 结论
通过对铜基催化剂催化丙二酸二乙酯加氢过程的本征动力学研究,筛选出了在实验范围内较适定的的动力学模型和相应的速率控制步骤。模型说明氢气分子以解离方式吸附,酯分子以非解离形式吸附在铜金属活性位上。进一步计算活化能、吸附焓和指前因子,说明目前限制丙二酸二乙酯加氢制备1,3-丙二醇收率在于副反应易生成丙酸乙酯而且对温度敏感,并指出高选择性催化酯基和高催化活性的催化剂能够抑制丙酸乙酯的生成,是以后提高丙二酸二乙酯加氢制备1,3-丙二醇的关键。为以后合理设计催化丙二酸二乙酯加氢制备1,3-丙二醇的铜基催化剂提供了基础。
符号说明
ki-反应速率常数(mol/h),i=1,2,3,4;Ki-吸附平衡常数(MPa-1),i=DEM,H2,HPE,PDO,NP,ET,EP;ri-化学反应速率(mol/h),i=1,2,3,4;ri,exp-实验反应速率 (mol/h),i=1,2,3,4;ri,cal-模型计算反应速率(mol/h),i=1,2,3,4;Pi-各组分分压(MPa),i=DEM,H2,HPE,PDO,NP,ET,EP;△Hi-吸附焓 (J/mol),i=DEM,H2,HPE,PDO,NP,ET,EP;△Si-吸附熵 (J/mol·K),i=DEM,H2,HPE,PDO,NP,EtOH,EP;Ki0-吸附指前因子(MPa-1),i=DEM,H2,HPE,PDO,NP,ET,EP;Eai-活化能(J/mol),i=1,2,3,4;ki0-指前因子(mol/h),i=1,2,3,4;R-理想气体常数(J/(mol·K))。
