VEGF基因转染脂肪干细胞后上清液对皮肤成纤维细胞及脐静脉血管内皮细胞的影响*
2019-03-21李江璇肖丽玲李升红刘宏伟潘潇寒张碧雅
李江璇,肖丽玲,李升红,刘宏伟,潘潇寒,张碧雅
(暨南大学附属第一医院整形外科, 广东 广州 510632)
脂肪源性干细胞(adipose-derived stem cells,ADSCs)是一类具有多向分化潜能的细胞,被证实可分化为脂肪细胞、骨细胞、神经细胞、心肌细胞和上皮细胞等[1],将其直接注射于损伤部位周围可修复疾病所致受损细胞,如将脂肪干细胞输入门脉系统治疗肝脏疾病[2]。然而将人ADSCs(human ADSCs, HADSCs)直接应用于人体可能存在一些风险,包括其分化方向和生长调控的不确定性等,因此HADSCs上清液(HADSCs-conditioned medium, HADSCs-CM)的修复作用被发现。现已知ADSCs可分泌包括血管内皮生长因子(vascular endothelial growth factor,VEGF)[3]、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)[4]、转化生长因子和血管生成素[5]等生长因子,曾有实验表明其上清液可促进成纤维细胞[6]和内皮细胞[5]等的生长进而促进创面愈合,因此,我们试图通过提高HADSCs的分泌功能并用其上清液培养细胞,观察其对创面相关细胞的影响。
本研究通过慢病毒转染VEGF165基因于HADSCs,并收集HADSCs-CM,观察其对人皮肤成纤维细胞(human dermal fibroblasts,HDFs)及人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)增殖及迁移的作用,为其在创面愈合方面提供参考资料。
材 料 和 方 法
1 主要试剂与仪器
胎牛血清(fetal bovine serum,FBS)、DMEM培养液和PBS溶液(HyClone);ECM培养液(ScienCell);人CD29-PE、CD90-PE、CD45-FITC和CD106-FITC 单克隆抗体(BD);Ⅰ型胶原酶(Sigma);人脂肪干细胞成骨、成脂和成软骨诱导液(Cyagen);青霉素-链霉素液(灏洋公司);胰蛋白酶和中性蛋白酶(Gibco);免疫组化试剂盒(中杉金桥公司);VEGF ELISA试剂盒(联科生物公司);bFGF ELISA试剂盒(Bio Swamp);靶向VEGF165慢病毒(吉凯公司)。
CO2培养箱和细胞超净工作台(Esco);倒置显微镜(Olympus);低速离心机(中佳公司);培养板(康宁公司);CCK-8试剂盒(和元公司);多功能酶标仪(BioTek)。
2 主要方法
2.1HADSCs的分离、培养和鉴定 将人皮下脂肪组织(来源于暨南大学附属第一医院整形外科抽脂后弃用脂肪,患者年龄为20~45岁,符合伦理学会要求,本人知情同意)移入离心管中,使用含双抗的PBS缓冲液洗涤,留下干净上层脂肪,加入等体积0.1%的Ⅰ型胶原酶消化约1 h,待脂肪呈乳糜状,300×g离心5 min弃上清, PBS重悬底层细胞并中和胶原酶,细胞筛过滤悬液至新离心管中;继续300×g离心5 min弃上清,并加入含10%FBS和1%双抗的DMEM培养液重悬接种,培养箱中培养;3 d后换液,细胞长满至80%时消化传代。鉴定:取第3代HADSCs,将细胞吸去培养液,0.25%胰酶常规消化,制成1×106个每份的细胞悬液,分别于对应的细胞中加入1~5 μL人CD29、CD90、CD44、CD45、CD105和CD106单克隆抗体,同时设立空白同型对照,室温下避光孵育30 min,300×g离心5 min,弃上清,用PBS洗涤2遍,后用200 μL PBS重悬细胞后上流式细胞仪检测表面标志物(实验重复3次)。使用第3代HADSCs,消化后以1×105的密度种于6孔板中,设立空白对照组及各诱导组(成脂、成骨和成软骨),对照组为正常培养液,诱导组为不同成分诱导液,约14 d后行对应染料染色,观察细胞诱导情况并拍照。细胞鉴定完成后进行后续实验。
2.2HDFs的培养和鉴定 将人体包皮组织(来源于暨南大学泌尿外科包皮环切术后弃用组织,患者年龄<25岁,符合伦理学会要求,本人知情同意)用含10%双抗PBS缓冲液浸泡冲洗,用眼科剪去除皮下组织并剪成小条,加入1 mL中性蛋白酶消化过夜。第2天真皮和表皮分离,弃表皮,所剩真皮置于培养皿中,剪成糊状;加1 mL胰蛋白酶浸没真皮组织,300×g离心5 min弃上清,用含10%FBS、1%的双抗的DMEM培养液重悬接种,培养箱中培养;3天后更换培养液,细胞长满至80%时传代。取第3代细胞进行免疫组化染色鉴定及后续实验。
2.3HUVECs的培养和鉴定 HUVECs购自武汉中国典型培养物保藏中心(China Center for Type Culture Collection,CCTCC),以含10%FBS、1%双抗和1%内皮细胞生长添加剂的内皮细胞完全培养液(ECM)培养细胞,隔2 d换液1次,细胞长满至80%时消化传代。为保证细胞未受到其他细胞污染,行相关鉴定,通过血管性血友病因子(von Willebrand factor,vWF)免疫荧光染色鉴定该细胞。
2.4慢病毒转染HADSCs并收集上清 将第4代的HADSCs以每孔5×104个接种于6孔板中,设立空白组及感染复数(multiply of infection, MOI)=10、20和30共4组。病毒为针对人类VEGF基因mRNA序列构建重组的慢病毒VEGF165,转染293细胞后扩增病毒,并由绿色荧光蛋白(GFP)标记,病毒滴度为2×1011TU/L。将6孔板置入超净台,移去旧培养液,每孔换1 mL新鲜培养液,根据公式:所需病毒量=MOI×细胞量/病毒滴度,算出每孔需要病毒量,在每孔中加入病毒,轻轻“8”字混匀,放入37 ℃培养箱感染4 h。加入病毒4 h后,每孔加1 mL培养液至足量。24 h后弃去含病毒培养液,换新鲜培养液,继续放入37 ℃培养箱培养。48 h后荧光显微镜下观察GFP荧光强度,以后每隔2天各组换无血清培养液,并在每次换液时收集上清直至第10天,换液前在显微镜下观察细胞转染效率并拍照。
2.5检测上清中VEGF及bFGF的表达 在细胞转染第4、6、8和10天时,使用1 mL吸头分别吸取转染后脂肪干细胞上清(VEGF-CM)及正常上清(normal CM, Nor-CM)到离心管中,300×g离心5 min,将上清用0.22 μm的过滤器过滤到离心管中,储存于-80 ℃冰箱中。测定时将细胞上清液从-80 ℃冰箱中取出融化;取出试剂盒,室温平衡30 min,按照VEGF及bFGF的ELISA试剂盒说明书操作,酶标仪检测吸光度(A)值并分析。实验重复3次。
2.6VEGF-CM对HDFs和HUVECs活力的影响 实验前1 d,将HDFs和HUVECs用完全培养液以每孔2 000个接种到96孔板中,分为5组,每组5个复孔。因收集上清液中完全不含血清,故将完全培养液与VEGF-CM以1∶0、 1∶2、 1∶1、 2∶1和0∶1的比例配成5组,VEGF-CM选择最佳浓度时的上清液。待细胞贴壁,约12 h后弃去旧培养液更换上述5种比例培养液,48 h后准备用CCK-8试剂盒检验细胞活力。实验重复3次。
2.7VEGF-CM对HDFs和HUVECs迁移的影响 将HDFs和HUVECs用完全培养液以每孔5×105个接种到6孔板中,6孔板背面提早划横线。分为:(1)完全培养液、(2)完全培养液与VEGF-CM按最佳比例混合及(3)完全培养液与normal-CM按最佳比例混合3组。6孔板中加入2种实验细胞,待细胞80%满时用无血清培养液饥饿细胞12 h,饥饿后的细胞用200 μL吸头划痕,划痕与横线垂直,选取固定4个点为基准。划痕后用PBS洗2遍。换3种培养液,各组细胞在倒置显微镜下分别于0 h、 12 h和24 h拍照。由软件Image-Pro Plus 6.0测量细胞迁移的距离。实验重复3次。
3 统计学处理
数据以均数±标准差(mean±SD)表示,以SPSS 13.0软件进行统计学分析,组间比较采用单因素方差分析(one-way ANOVA),以P<0.05为差异有统计学意义。
结 果
1 细胞的生物学特性
人脂肪干细胞:HADSCs培养3 d后可见细胞贴壁,7 d后快速增殖,呈“纺锤样”长梭形,对第3代HADSCs细胞表面标志物进行流式检测显示:CD90、CD29、CD44和CD105呈阳性表达,CD45和CD106呈阴性表达,符合脂肪干细胞特性。经成脂、成骨和成软骨诱导分化后,可被油红O、茜素红和阿尔辛蓝染色,见图1。

Figure 1.Multidirectional induced differentiation and identification of surface markers of HADSCs. A: osteogenic differentiation of HADSCs and alizarin red staining; B: adipogenic differentiation and oil red O staining; C: chondrocytes differentiation and Alcian blue staining; D: the surface marker identification of HADSCs.
图1HADSCs多向诱导分化及表面标志物鉴定
人成纤维细胞:原代HDFs生长10 d后爬满瓶底,呈鱼群样或漩涡状,传代后细胞生长迅速,细胞间无接触抑制,可层层叠加。对细胞进行波形蛋白(vimentin)和Ⅰ型胶原免疫组化染色,结果呈阳性,见图2。
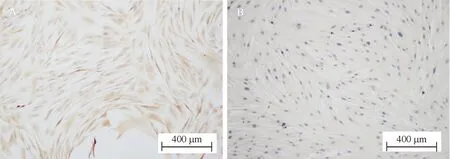
Figure 2.The immunohistochemical staining of HDFs. A: vimentin staining; B: type Ⅰ collagen staining.
图2HDFs免疫组化染色鉴定
人脐静脉内皮细胞:HUVECs生长迅速,经过1~2 d的潜伏期后进入对数生长期,约4天即可爬满瓶底,呈铺路石状或短梭形; vWF表达呈阳性,见图3。
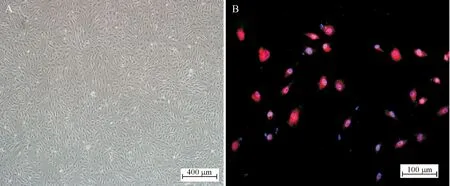
Figure 3.The morphological change (A) and vWF immunofluorescence staining (B) of HUVECs.
图3HUVECs的细胞形态及免疫荧光染色鉴定
2 VEGF165慢病毒转染后HADSCs及细胞因子表达
VEGF165慢病毒感染HADSCs后第2天,荧光显微镜下即可见部分细胞内有微弱绿色荧光表达;随着感染时间增加,荧光明显增亮;至第7天细胞爬满培养瓶时绿色荧光最强,而后随着细胞生长、老化,细胞荧光表达主要集中于细胞核内,如图4所示。未转染组细胞未见荧光。
经ELISA检测,可见各组上清中VEGF与bFGF均呈阳性表达,而VEGF-CM中VEGF及bFGF的分泌水平明显高于非转染组。在转染病毒后收集上清的第4天,VEGF的分泌开始增加,高峰在第8天,随后逐渐下降,在MOI=30时分泌量最高。而bFGF的分泌自转染后便保持相对较高,在第4天时未见到因病毒的毒性作用而分泌下降,高峰在第6天,见图5。选择MOI=30的转染后上清液进行后续实验。
3 VEGF-CM对HDFs及HUVECs活力的影响
CCK-8结果表明,1∶2组2种细胞的活力均显著提高(P<0.05),而无VEGF-CM组(1∶0组)细胞的活力较其它组低。这种促进增殖作用在HUVECs中明显,并与VEGF-CM所占比例呈依赖关系,在0∶1组中即使只有VEGF-CM,仍有明显的促增殖能力,1∶2组与0∶1组无显著统计学差异,见图6。
4 VEGF-CM对HDFs及HUVECs迁移的影响
将2种细胞不同时点的照片经过Image-Pro Plus 6.0计算出划痕后空白处的面积,由图7、8可见,VEGF-CM组中2种细胞迁移距离明显大于完全培养液组及Nor-CM组(P<0.05),且在HDFs中促迁移能力显著。
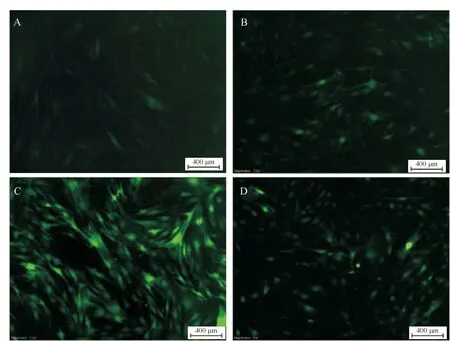
Figure 4.The fluorescence intensity after lentiviral transfection into HADSCs (MOI=30). A: 3 d; B: 5 d; C: 7 d; D: 9 d.
图4携带VEGF165慢病毒转染(MOI=30)HADSCs后的荧光强度
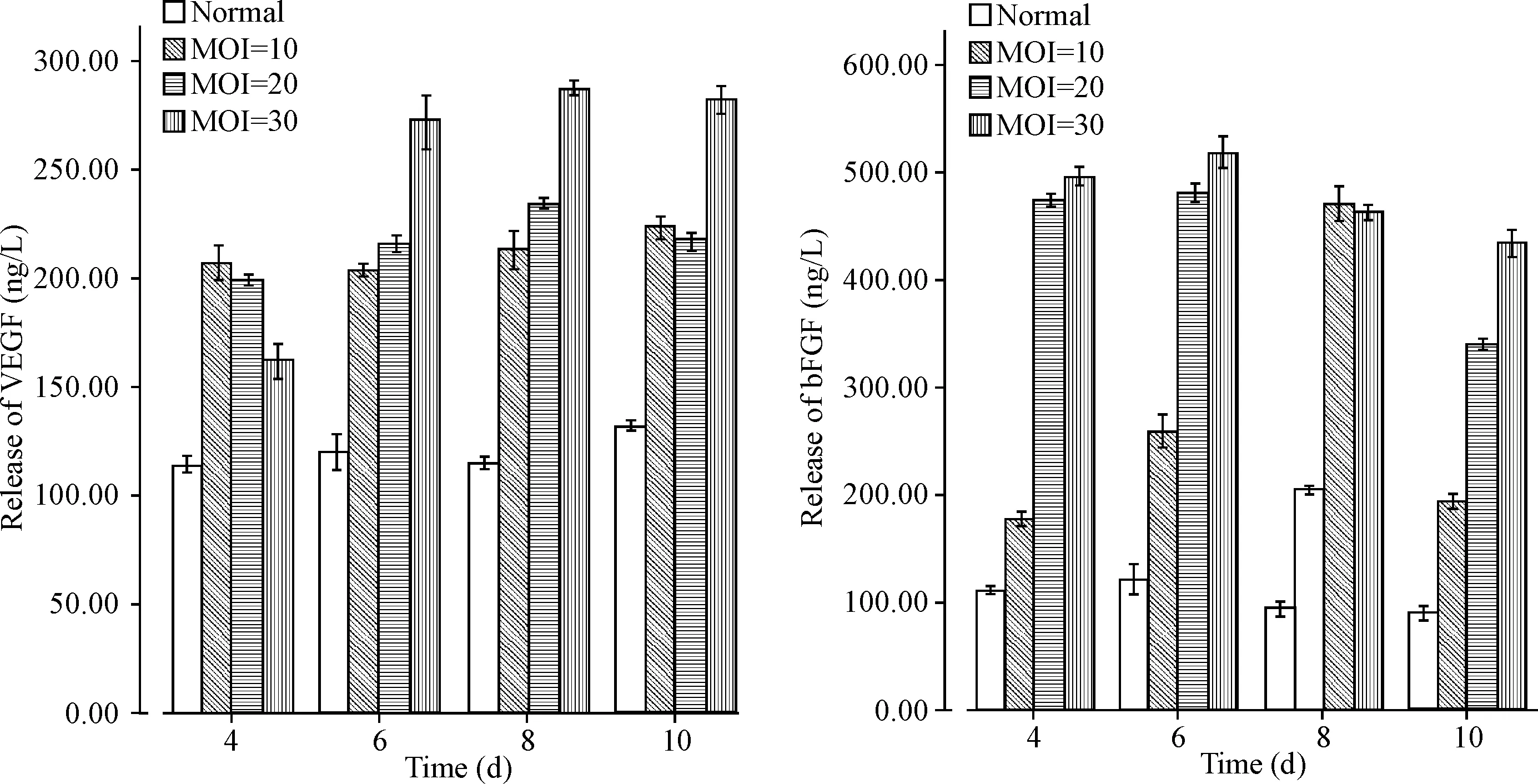
Figure 5.The growth factor content in the supernatants of the HADSCs in transfection groups with different MOI values and non-transfection group. Mean±SD.n=3.
图5未转染组及转染组HADSCs上清液中生长因子的含量
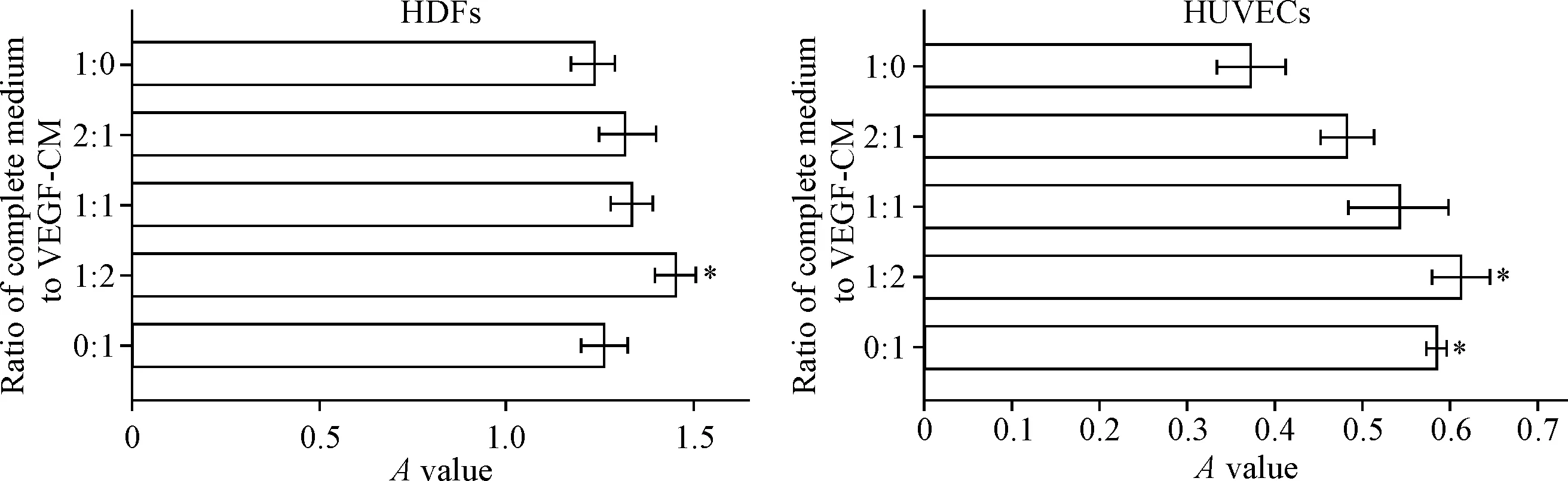
Figure 6.The viability of HDFs and HUVECs treated with the mixed medium. Mean±SD.n=3.*P<0.05vs1∶0 group.
图6完全培养液与VEGF-CM不同比例混合后对HDFs和HUVECs活力的影响
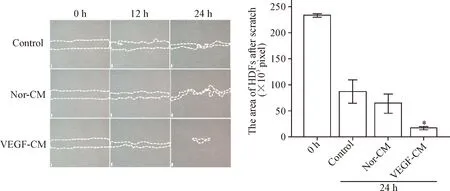
Figure 7.The migration of HDFs treated with different culture media after scratch (×40). Mean±SD.n=3.*P<0.05vscontrol and Nor-CM group.
图7完全培养液、正常上清和VEGF上清对HDFs迁移的影响
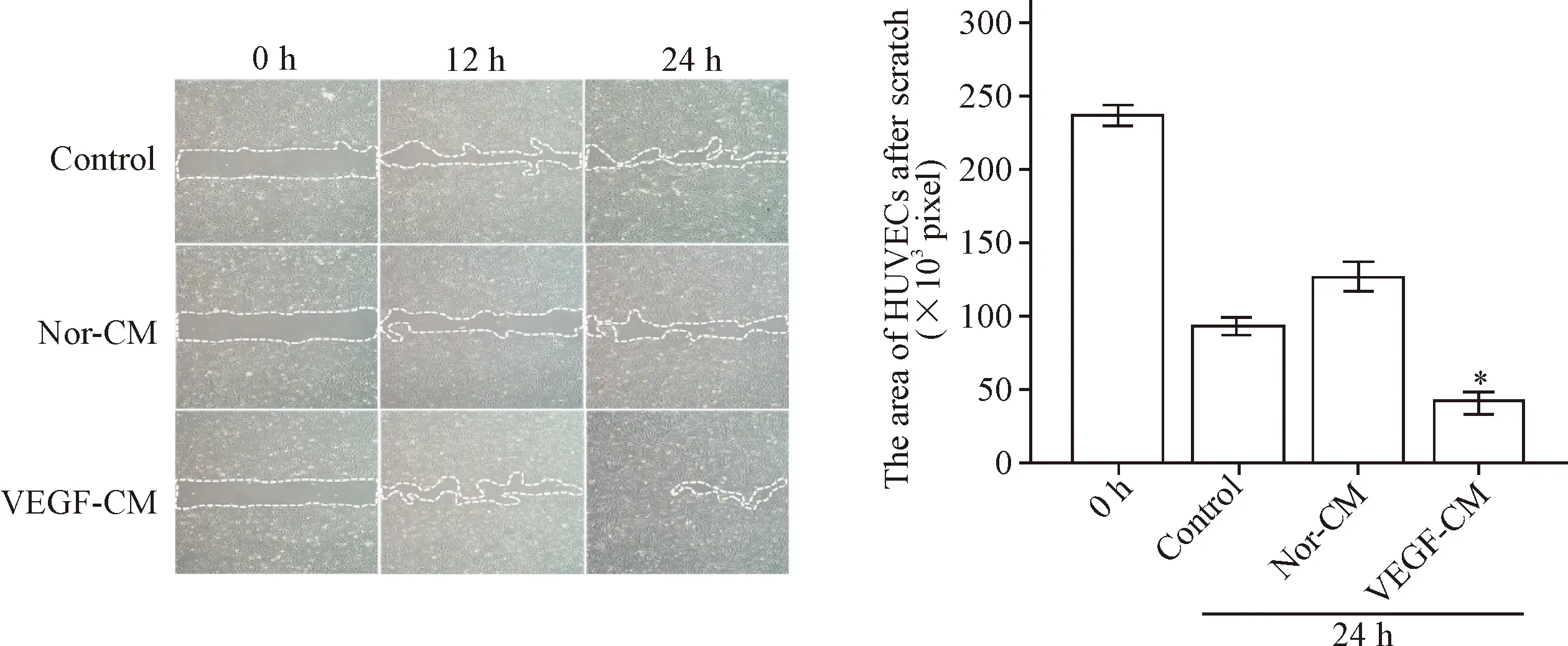
Figure 8.The migration of HUVECs treated with different culture media after scratch (×40). Mean±SD.n=3.*P<0.05vscontrol and Nor-CM group.
图8完全培养液、正常上清和VEGF上清对HUVECs迁移的影响
讨 论
自体ADSCs移植现可通过其多向分化和旁分泌等方式达到疤痕治疗、皮肤年轻化和促进创面愈合等目的[7],但临床自体ADSCs的应用受制于自身脂肪提取,如患者消瘦和营养不良等可导致ADSCs数量不足,此外,老龄化且有冠心病的患者其ADSCs被证明具有衰老特征,促血管生成因子的分泌量减少[8],这些都会限制ADSCs自体细胞治疗的有效性。因此利用干细胞上清液作用于创面治疗是一种选择,很多学者证明,ADSCs的上清液中含有丰富的生长因子,并可促进多种细胞的活力和迁移[6, 9]。在本实验中,通过ELISA法证明在正常上清液中确实可检测到一定量的生长因子,且表达水平较为稳定,但我们试图提高ADSCs的分泌能力再行进一步实验。目前,提高VEGF分泌量的方法至少有以下2种[10]:(1)利用缺氧环境培养ADSCs,可促进其分泌VEGF和bFGF而加速创面愈合[4];(2)利用基因导入技术将目的VEGF基因整合入ADSCs[11]。慢病毒具有可容纳大片段外源性基因、低免疫原性及长期稳定表达等显著优点[12],我们选择慢病毒携带目标基因转染ADSCs,本研究证明ADSCs可被慢病毒成功转染VEGF基因,并可增强相关蛋白表达。
VEGF 最初于1983年发现,当时被称作血管通透因子(vascular permeability factor,VPF),后来研究者指出其与1989年牛垂体中检测到的可特异性地作用于血管内皮细胞的蛋白质为同一物质[13]。VEGF能特异性地促进内皮细胞和巨噬细胞等的生长、增殖和迁移,以促血管生成为最大特点。bFGF是一个作用很强的有丝分裂原和血管生成因子,能吸引并刺激成纤维细胞、血管内皮细胞和角质细胞等的增殖,与VEGF有协同作用[14]。有动物实验表明,在Ⅲ度压疮中,组织缺血缺氧程度超过了机体的代偿范围,使得VEGF和bFGF的分泌下降,并呈正相关,从而导致压疮的继续发展及难以愈合[15]。本实验中也观察到,转染VEGF基因于ADSCs,转染组上清液中VEGF及bFGF均得到提高,反映出二者的协同作用。本实验通过基因转染技术提高了ADSCs对VEGF和bFGF的表达,若将上清液作用于慢性创面,可对创面愈合起到积极作用。
本实验证明,对比完全培养液和正常上清液,HUVECs的活力和迁移对VEGF-CM的依赖性十分明显,这与VEGF-CM含有丰富的VEGF、bFGF等因子有关,其中还包括未行检测的其它因子,如胎盘生长因子、粒细胞巨噬细胞刺激因子和胰岛素样生长因子[5]等,各种因子相互协同作用,最终起到促进作用。同样,比起其余2组,VEGF-CM对HDFs也有促进作用,而且促迁移能力更为显著。
综上所述,通过慢病毒转染使ADSCs高表达VEGF,获得含有丰富生长因子的VEGF-CM,其可促进HDFs及HUVECs的增殖及迁移。这为进一步研究脂肪干细胞上清液的临床应用提供方向,虽然作用机制仍需进一步的研究,但将外源性、高浓度的VEGF-CM应用于局部创面十分简单、方便,考虑为一种有效的治疗方式。
