上调miR-181a抑制香烟提取物诱导的支气管上皮细胞致炎因子生成与collagen IV、fibronectin和α-SMA表达*
2019-03-21梁珍珍解玉东张艳莉韩丽丽吕燕平
梁珍珍,解玉东,张艳莉,韩丽丽,吕燕平
(周口市中心医院呼吸科, 河南 周口 466000)
慢性阻塞性肺疾病(chronic obstruction pulmonary disease,COPD)是一种全球性疾病,目前居全球死因第4位,且预计至2030年COPD将居全球疾病死因第3位[1]。我国流行病学调查发现,40岁以上人群COPD的发病率为8.2%[2],其发病率和死亡率有日益增高的趋势[1]。在COPD疾病进程中,长期的慢性炎症导致的黏膜下腺增生、黏蛋白过度分泌、纤维化、气道平滑肌的增生肥大及气道微血管的再生等病理性变化,即气道重塑,是COPD患者肺功能减退的关键性病理变化[3],其中气道炎症贯穿气道重塑的整个过程,气道纤维化是气道重塑的重要病理变化形式,因此抑制支气管上皮细胞致炎因子的分泌与纤维化进展相关蛋白的表达有望抑制气道重塑并减轻COPD进展。
微小RNA(microRNA,miRNA,miR)可参与多种肺部疾病的发病过程,如肺结核[4]、肺癌[5]、COPD[6]、哮喘[7]和特发性肺间质纤维化(idiopathic pulmonary fibrosis,IPF)[8]等。近年来在一项连续动态模拟COPD大鼠的模型中发现,COPD组的miR-181a表达下调,且随着COPD的进展逐步下调[9]。然而miR-181a与气道重塑的关系尚未明了。基于以上研究背景,本研究选取香烟提取物(cigarette smoke extract,CSE)刺激人支气管上皮细胞(human bronchial epithelial cells,HBECs),观察miR-181a的表达、致炎因子生成、IV型胶原蛋白(collagen IV)、纤连蛋白(fibronectin)和α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)表达的关系,并进一步分析其相关机制,为并评估miR-181a是否可以作为防治COPD的新靶点提供实验依据。
材 料 和 方 法
1 材料与试剂
胎牛血清购自PAA;EGM-2-MV内皮细胞培养基购自Lonza;白细胞介素1β(interleukin-1β,IL-1β)、IL-6、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和转化生长因子β1(transforming growth factor-β1, TGF-β1) ELISA试剂盒购自武汉博士德生物公司;抗磷酸化核因子κB(phosphorylated nuclear factor-κB,p-NF-κB) p65、NF-κB p65、collagen IV、fibronectin和α-SMA抗体购自Santa Cruz;抗p-Smad3、Smad3和TGF-β1抗体购自CST;抗GAPDH抗体购自江苏碧云天生物公司;miR-181a引物、miR-181a模拟物(miR-181a mimic)和miR mimic阴性对照(miR mimic negative control,NC-m)由上海吉玛公司合成。
2 香烟提取物的制备
参照文献方法[10],取市售芙蓉王牌香烟,去除过滤嘴后,连接吸烟机,设置抽烟速度为每支5 min。取10支完全燃烧后产生的烟雾完全溶于10 mL无血清的EGM-2-MV内皮细胞培养基中,经0.22 μm微孔过滤器过滤后,此培养基定义为100% CSE母液。后续实验采用的CSE浓度为此培养基所占终体积的百分比。
3 方法
3.1细胞培养与细胞模型的建立 HBECs购于Sciencell。HBECs常规培养于含10%胎牛血清的EGM2-MV内皮细胞培养基中,每3 d换液 1 次。取对数生长期的HBECs接种至6孔板,待细胞贴壁后,更换无血清的培养基同步化12 h,后更换正常培养基,用含不同浓度(5%、10%和20%)的CSE处理细胞48 h,或20% CSE处理细胞24、48和72 h,RT-qPCR检测miR-181a的表达,确定CSE的最佳作用浓度。
3.2miR-181a mimic转染 实验前 1 d常规消化对数期HBECs,按照2×109/L的密度接种于6孔板中,待细胞贴壁后,更换无血清的培养基同步化12 h。按照说明书方法,进行 miR-181a mimic和NC-m转染,将miR-181a mimic和NC-m分别与Lipofectamine 3000溶于无血清培养基中,室温孵育30 min;分别将混合物加至相应组别的细胞中,无血清培养基孵育6 h,更换为常规培养基培养48 h。
3.3细胞分组 将HBECs分为正常对照组(control组,细胞正常培养)、miR-181a mimic组、NC-m组、CSE处理组(20% CSE处理细胞)、CSE+miR-181a mimic组(20% CSE处理miR-181a mimic转染的细胞)和CSE+NC-m组(20%CSE处理NC-m转染的细胞),以上各组HBECs继续培养48 h,进行后续实验。
3.4ELISA法检测细胞培养液中炎性因子的含量 取对数生长期的HBECs接种于96孔板,细胞进行相应的处理,48 h后,收集各组细胞培养液。IL-1β、IL-6、TNF-α和TGF-β1含量的检测均按照ELISA试剂盒说明书进行操作。稀释标准品制作标准曲线,将待测样品按每孔50 μL加入包被相应抗体的酶标板中,室温孵育2 h,甩去酶标板中的液体,每孔加入100 μL对应的生物素化标记的抗体工作液,室温孵育1 h,PBS洗3次,每孔加入100 μL亲和素-过氧化物复合物工作液,室温孵育45 min,PBS洗3次,每孔加入100 μL显色液,室温孵育10 min,最后每孔加入100 μL终止液,液体由蓝色变为黄色即可在酶标仪450 nm波长处测定吸光度(A)值,代入标准曲线,计算样品IL-1β、IL-6、TNF-α和TGF-β1的含量。
3.5RT-qPCR实验 提取细胞中的总RNA,经SuperScript III Reverse Transcriptase逆转录为cDNA。按照SYBR Green RT-qPCR试剂盒的操作步骤,通过ABI 7300 PCR仪检测miR-181a的表达。miR-181a的上游引物序列为5’-TCACTCCTCTCCTCCCG-3’,下游引物序列为5’-GTGCAGGGTCCGAGGT-3’;U6的上游引物序列为5’-GCTTCGGCACATATACTAAAAT-3’,下游引物序列为5’-CGCTTCACGAATTTGCGTGTCAT-3’。 qPCR反应体系包括 1 μL cDNA样品、10 μL SYBR Green PCR Master Mix和0.4 μL上、下游引物。反应条件为95 ℃孵育5 min;然后进行45个循环(95 ℃ 15 s、55 ℃ 30 s、74 ℃ 25 s)。以U6作为内参照,采用2-ΔΔCT法分析miR-181a的表达。
3.6Western blot实验 采用RIPA裂解液裂解细胞,提取细胞蛋白,定量后进行SDS-PAGE。待电泳结束后,采用湿法电转至PVDF膜上。PVDF膜经5%脱脂牛奶室温封闭后,按抗体说明书加入相应稀释比例的 I 抗(抗collagen IV、fibronectin、α-SMA、p-Smad3、Smad3、TGF-β1、p-NF-κB p65和NF-κB p65抗体),室温孵育1.5 h,TBST洗膜3次,再加入相应稀释比例的 II 抗室温孵育45 min,ECL化学曝光显影。以GAPDH为内参照,IPP6.0软件分析条带灰度值。
4 统计学处理
采用SPSS 17.0进行统计分析。数据以均数±标准差(mean±SD)表示,组内数据比较采用方差分析,4组间数据比较采用单因素方差分析的post-hoc test Bonferroni-t检验,6组间数据比较采用单因素方差分析的post-hoc test SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 CSE对HBECs miR-181a表达的影响
给予5%、10%和20%的CSE分别处理细胞48 h后,miR-181a表达的变化显示,CSE浓度依赖性抑制HBECs的miR-181a表达(P<0.05),见图1A;给予20%的CSE分别处理细胞24、48和72 h后,miR-181a的表达显著降低(P<0.05),且48 h和72 h 2个时点的miR-181a表达差异无统计学显著性,见图1B。综合考虑结果,采用20%的CSE处理48 h为本研究的最佳作用条件。

Figure 1.The effect of CSE on the expression of miR-181a in the HBECs was determined by RT-qPCR. A: HBECs were treated with CSE at different concentrations for 48 h; B: HBECs were treated with 20% CSE for different times. Mean±SD.n=3.*P<0.05vscontrol group.
图1CSE对HBECsmiR-181a表达的影响
2 miR-181a过表达对CSE诱导的HBECs释放致炎因子的影响
ELISA结果显示,与正常对照组比较,CSE处理组致炎因子IL-1β、IL-6、TNF-α和TGF-β1的水平均升高(P<0.05);与CSE处理组比较,转染miR-181a mimic能部分逆转CSE诱导的IL-1β、IL-6、TNF-α和TGF-β1的生成(P<0.05),见图2。说明 miR-181a过表达可部分抑制CSE诱导的HBECs致炎因子生成。
3 miR-181a过表达对CSE诱导的HBECs中collagen IV、fibronectin和α-SMA表达的影响
Western blot结果显示,与正常对照组比较,CSE处理组collagen IV、fibronectin和α-SMA的表达均升高(P<0.05);与CSE处理组比较,转染miR-181a mimic能抑制CSE诱导的collagen IV、fibronectin和α-SMA的表达(P<0.05),见图3。说明 miR-181a过表达可抑制CSE诱导的HBECs中collagen IV、fibronectin和α-SMA表达。
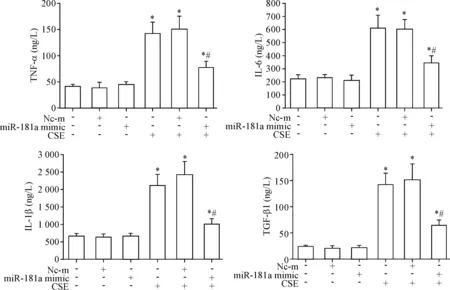
Figure 2.The effect of miR-181a mimic on CSE-evoked pro-inflammatory factor levels in HBECs. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsCSE group.
图2miR-181amimic对CSE诱导的HBECs释放致炎因子的影响

Figure 3.The effect of miR-181a mimic on CSE-evoked the expressions of collagen IV, fibronectin and α-SMA in HBECs. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsCSE group.
图3miR-181amimic对CSE诱导的collagenIV、fibronectin和α-SMA表达的影响
4 miR-181a过表达对CSE诱导的HBECs中NF-κB/TGF-β1/Smad3信号通路的影响
Western blot检测结果显示,与正常对照组比较,CSE处理组的p-NF-κB p65、TGF-β1和p-Smad3蛋白水平均升高(P<0.05);与CSE处理组比较,转染miR-181a mimic能下调CSE诱导的p-NF-κB p65、TGF-β1和p-Smad3的蛋白水平(P<0.05),见图4。结果提示miR-181a过表达可能通过减弱NF-κB/TGF-β1/Smad3信号通路活性,抑制CSE诱导的HBECs致炎因子生成与collagen IV、fibronectin和α-SMA表达。
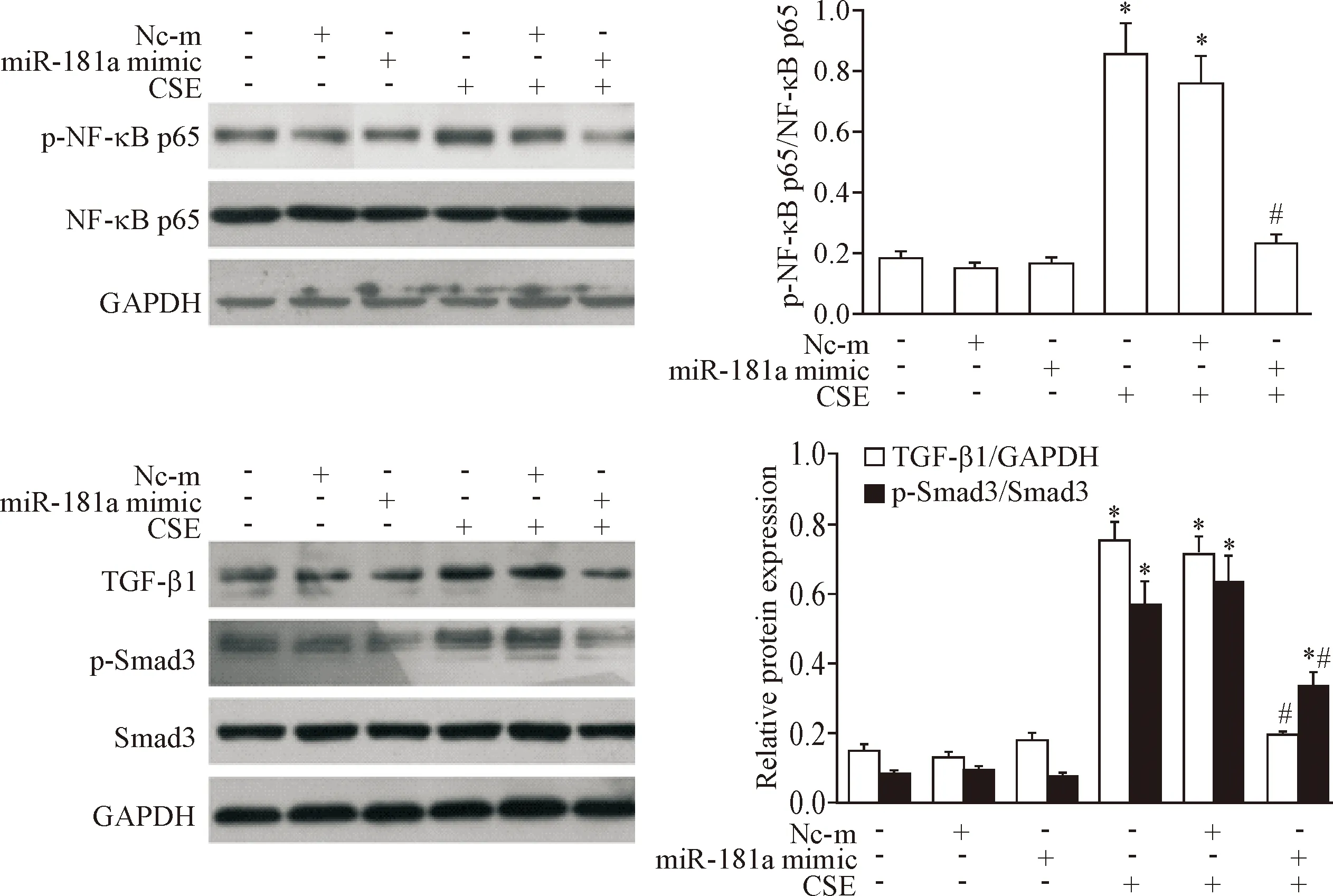
Figure 4.The effect of miR-181a mimic on CSE-evoked the activation of NF-κB/TGF-β1/Smad3 pathway in HBECs. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsCSE group.
图4miR-181amimic对CSE诱导的NF-κB/TGF-β1/Smad3信号通路活性的影响
讨 论
COPD是以烟雾和病毒等长期诱导的以慢性炎症性为主要临床特征的气道疾病,气道重塑为COPD肺功能减退的关键性病理变化[3]。本研究以CSE刺激HBECs的基础上探究miR-181a在气道重塑中的保护作用,实验结果显示CSE可显著增加HBECs的致炎因子生成与collagen IV、fibronectin和α-SMA表达,同时使miR-181a表达水平降低,该研究结果提示miR-181a可能参与COPD进程中气道重塑的病理生理过程。
miR-181a是一个典型的多功能miRNA,其主要参与细胞分化、免疫调节、炎症反应、细胞增殖与凋亡等的多种生物学功能[9, 11-12], 如Sonkoly等[11]发现,miR-181a能调节免疫细胞功能和炎症反应;在脂多糖(lipopolysaccharides,LPS)诱导急性肺损伤研究中,发现过表达miR-181a能显著抑制致炎因子分泌,保护LPS引起的肺损伤[12];在COPD中,香烟刺激的小鼠COPD模型和COPD患者肺组织中,miR-181表达下调[9]。但其在COPD的气道重塑中作用还有待进一步的研究确证,本研究通过在HBECs中转染miR-181a mimic使得miR-181a过表达的基础上,进一步从致炎因子生成与collagen IV、fibronectin和α-SMA表达的角度探讨了miR-181a的作用,结果显示miR-181 过表达可明显抑制CSE诱导HBECs中致炎因子TNF-α、IL-1β、IL-6和TGF-β1的生成及collagen IV、fibronectin和α-SMA表达,提示miR-181可影响COPD进程中气道重塑的病理变化。
NF-κB具有广泛的生物学活性,众多研究提示NF-κB信号通路是肺部炎症性疾病中多种免疫炎症相关基因表达的关键调控点,参与COPD的发生发展[13-14]。而TGF-β1/Smads 信号通路与COPD气道炎症和气道重塑关系密切[15-16]。早期暴露于烟雾等有害气体刺激肺部出现炎症反应导致NF-κB激活,而激活的NF-κB暴露TGF-β1结合位点,直接促进TGF-β1表达,活化TGF-β1/Smads途径[17]。TGF-β1作为COPD发病过程中的关键致病因子,与气道重塑密切相关,Smad2/3在COPD气道重塑中发挥促进作用[17-18]。本研究发现CSE能诱导HBECs中致炎因子IL-1β、IL-6、TNF-α和TGF-β1的释放,在CSE刺激下HBECs细胞中p-NF-κB p65、TGF-β1和p-Smad3的蛋白水平增加,TGF-β1生成增加,提示有NF-κB/TGF-β1/Smad3的活化;而转染miR-181a mimic后HBECs细胞中NF-κB/TGF-β1/Smad3的活性被抑制。结果提示miR-181a过表达可能通过减弱NF-κB/TGF-β1/Smad3信号通路的活性,抑制CSE诱导的HBECs炎性反应与collagen IV、fibronectin、α-SMA的表达。但miR-181a调控NF-κB/TGF-β1/Smad3的具体机制还需进一步深入的研究。
综上所述,CSE可诱导HBECs中致炎因子IL-1β、IL-6、TNF-α和TGF-β1的生成及collagen IV、fibronectin和α-SMA表达,而miR-181a过表达可部分缓解这种病理改变,从而在COPD的气道重塑的进展过程中发挥一定的拮抗作用;此外,miR-181a过表达可部分抑制CSE诱导的HBECs中致炎因子生成和collagen IV、fibronectin、α-SMA表达,可能与其抑制NF-κB/TGF-β1/Smad3通路的活性相关。以上结果提示miR-181a可以作为防治COPD的新靶点。
