活血散结方药物血浆对PDGF干预下兔视网膜色素上皮细胞增殖相关因子及ERK1/2信号转导通路的影响
2019-03-18刘晓清彭俊张又玮谭涵宇李建超吴权龙彭清华
刘晓清 彭俊 张又玮 谭涵宇 李建超 吴权龙 彭清华


摘要:目的 觀察活血散结方对血小板源性生长因子(PDGF)干预下兔视网膜色素上皮(RPE)细胞增殖的影响,探讨其分子机制。方法 以RPE细胞为研究对象,体外进行RPE细胞原代培养及传代,建立PDGF干预下兔RPE细胞增殖模型,并选取PDGF最佳干预浓度。制备活血散结方药物血浆,对兔RPE细胞增殖与毒性的影响进行测定,选取最佳的实验浓度。实验分为空白对照组(DMEM)、正常血浆组、PDGF(10 μg/L)组、PDGF(10 μg/L)+AG1296(10 μmol/L)组、PDGF(10 μg/L)+10%药物血浆组、PDGF(10 μg/L)+20%药物血浆组。分别加入相应处理因素干预48 h,Transwell流式细胞仪检测细胞周期变化;Western blot检测兔RPE细胞cyclin D1蛋白、pERK1/2及ERK1/2蛋白表达。结果 10%、20%活血散结方药物血浆对RPE细胞周期、cyclin D1蛋白及pERK1/2、ERK1/2蛋白有抑制作用,与AG1296抑制剂作用相当(P>0.05),与其他组比较差异均有统计学意义(P<0.01)。结论 活血散结方药物血浆可能通过影响ERK信号通路及对周期蛋白的调控,抑制PDGF干预下兔RPE细胞增殖。
关键词:活血散结方;药物血浆;视网膜色素上皮细胞;细胞周期;血小板源性生长因子;cyclin D1蛋白;pERK1/2蛋白;ERK1/2蛋白
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2019)02-0062-07
DOI:10.3969/j.issn.1005-5304.2019.02.014
开放科学(资源服务)标识码(OSID):
Abstract: Objective To investigate the effect of plasma containing invigorating blood and dissipating masses Chinese medicine on proliferation of rabbit RPE cells treated with PDGF; To discuss the molecular mechanism. Methods The RPE cells were used as the research object and the primitive culture and subculture of RPE cells were proceeded. Rabbit model of RPE cell proliferation treated with PDGF was established, and the best PDGF intervention concentration was chosen. Plasma containing invigorating blood and dissipating masses Chinese medicine was prepared. The effects of rabbit RPE cell proliferation and toxicity were determined, and the best experimental concentration was selected. The experiment was divided into blank control group (DMEM), normal plasma group, PDGF (10 μg/L) group, PDGF (10 μg/L) + AG1296 (10 μmol/L) group, PDGF (10 μg/L) + 10% drugplasma group, and PDGF (10 μg/L) + 20% drug plasma group, and corresponding factors were added into each group for intervening for 48 hours. Transwell flow cytometry was used to detect cell cycle changes in different groups. Western blot was used to detect cyclin D1 protein, pERK1/2 and ERK1/2 protein expressions in rabbit RPE cells. Results 10% and 20% concentration of plasma containing invigorating blood and dissipating masses Chinese medicine inhibited RPE cell cycle, cyclin D1 protein, pERK1/2 and ERK1/2 proteins, which were equivalent to AG1296 inhibitor (P>0.05). There was statistical significance compared with other groups (P<0.01). Conclusion Plasma containing invigorating blood and dissipating masses Chinese medicine may inhibit proliferation of rabbit RPE cells treated with PDGF by affecting ERK signaling pathway and regulation of cyclin.
Keywords: invigorating blood and dissipating masses Chinese medicine; drug plasma; retinal pigment epithelium cells; cell cycle; platelet-derived growth factor; cyclineD1; pERK1/2; ERK1/2
增殖性玻璃体视网膜病变(proliferative vitreoretinopathy,PVR)是1983年由美国视网膜专家协会提出用于描述孔源性视网膜脱离(rhegmatogenous retinal detachment,RRD)等疾病后玻璃体和或视网膜前后面特异细胞增殖形成可以收缩的细胞性膜,进而引起视网膜牵拉、脱离与固定的一种病变,是一种常见的难治性致盲性眼病[1]。目前研究表明,PVR是以细胞介导为主的病理过程[2-3]。视网膜色素上皮(retinal pigment epithelium,RPE)细胞作为最关键细胞,贯穿于PVR发生的所有过程。而血小板源性生长因子(platelet derived growth factor,PDGF)则是参与PVR形成的主要细胞因子。目前临床上PVR西药治疗作用比较单一,且细胞毒性大,基因治疗技术目前尚未成熟,手术治疗存在难度、风险大且易复发。中医辨证论治,不良反应较小,能取得良好的疗效[4]。活血散结方根据眼科水血同治的原则组成[5],本实验观察其药物血浆对PDGF-BB干预下兔RPE细胞的细胞周期、cycling D1蛋白、pERK1/2及ERK1/2蛋白表达的影响,探讨该方有效治疗PVR与细胞增殖相关的作用机制。
1 实验材料
1.1 动物
成年健康无眼疾青紫蓝兔8只,雌雄不限,体质量1.5~2.0 kg,上海市松江区车墩实验动物良种场提供,动物许可证号SXCK(沪)2012-0008。成年健康家兔10只,雌雄不限,体质量1.5~2.0 kg,湖南中医药大学动物实验中心提供,动物许可证号SCXK(湘)2015-0004。饲养于室温18~26 ℃、相对湿度约55%环境,保持空气流通,常规饲料喂养。实验前行常规眼科检查(裂隙灯、间接眼底镜),排除眼内外疾患后进入实验。实验前所有动物适应性饲养1周。
1.2 药物及制备
活血散结方(三七6 g、丹参15 g、昆布15 g等),饮片由湖南中医药大第一附属医院药剂科提供,水煎2次,将药液混合浓缩至含1.025 g原药材/mL,4 ℃保存。
1.3 主要试剂与仪器
DMEM/F12(美国Hyclone),胎牛血清(杭州四季青),流式细胞周期检测试剂盒(南京凯基),PDGF-BB(美国Sigma),AG1296(美国Selleck),RIPA组织细胞快速裂解液(碧云天),BCA蛋白定量试剂盒(碧云天),30%丙烯酰胺(Solarbio),Tris(Solarbio),HCl(国药集团),SDS(美国Sigma),过硫酸铵(Solarbio),TEMED(国药集团),5X SDS-PAGE loading buffer(Vazyme),蛋白预染Marker(Fermentas),PVDF膜(Millipore),脱脂奶粉(Solarbio),PBS(博士德),Tween-20(Amresco),ECL发光液(美国Thermo),PDGF-BB(美国Sigma),HRP羊抗鼠二抗(Proteintech),cyclin D1小鼠单克隆抗体(Abcam),GAPDH小鼠单克隆抗体(Proteintech),ERK1/2小鼠单克隆抗体(Abcam),pERK1/2小鼠单克隆抗体(Abcam),GAPDH小鼠单克隆抗体(Proteintech),HRP羊抗鼠二抗(Proteintech)。CO2细胞培养箱(美国Thermo)、生物安全柜(美国Thermo),倒置显微镜(德国Motic),低速离心机(美国Thermo),MDF-382E型超低温冰箱(日本Sanyo),压力蒸汽灭菌器(上海亚明热处理设备公司),荧光显微镜(德国Zeiss),低速离心机(美国Thermo),MDF-382E型超低温冰箱(日本Sanyo),单通道移液器(德国Eppendorf),八通道电动移液器(德国Eppendorf),酶标仪(美国Bio-tek,ELX800)。
2 实验方法
2.1 药物血浆制备
成年健康家兔10只,随机分为空白组和活血散结方组。根据人与家兔体表面积换算方法计算(人以60 kg体质量为标准,家兔以1.6 kg体质量为标准)活血散结方家兔临床等效剂量为5.064 g/(kg·d)。取4倍家兔临床等效剂量为每日20.256 g/kg≈20.5 g/kg,水煎制成浓度为1.025 g原药材/mL活血散结方药液。活血散结方组每日20 mL/kg灌胃2次,空白组灌服等量蒸馏水,连续5 d。第5日灌胃2 h后麻醉腹主动脉取血,3000 r/min离心10 min,收集上清液即为药物血浆。0.22 μm过滤器分装,置于-70 ℃冰箱保存。
2.2 原代兔视网膜色素上皮细胞的培养及鉴定
利用青紫蓝兔为实验对象,按酶消化法获取RPE细胞原代细胞。5 mL注射器于青紫蓝兔耳缘静脉处空气栓塞法处死,无菌条件下取出眼球,去除表面筋膜,生理盐水洗净,浸泡于4 ℃、400 U/mL庆大霉素生理盐水。PBS冲洗3次后去除角膜、晶状体以及玻璃体。D-Hanks液中漂洗2次,滴加0.25%胰酶,室温下静置10 min,由视网膜周边至视乳头方向轻轻去除视网膜神经上皮层后PBS冲洗3次。滴加0.25%胰蛋白酶0.2 mL,置于细菌培养箱中消化30 min,加入含10%胎牛血清的培养基终止反应。获取细胞悬液,800 r/min离心10 min,弃上清液。在离心管再次胰酶消化、吹打,加入10%胎牛血清的培养基,终止反应,离心,弃去上清液,加入10%胎牛培养基将细胞吹打分散,将RPE细胞调整为(4~5)×104个/mL的密度,并接种于25 mL培养瓶,在含5%CO2、湿度为90%的37 ℃培养箱中培养。细胞贴壁后每3 d更换培养液,直到细胞融合。当细胞贴壁铺满大部分瓶底即可进行传代培养。取原代生长RPE细胞,PBS洗涤2次,胰酶消化,细胞脱壁分散后即加少量完全培养基终止消化。1000 r/min离心4 min,弃上清液,加1~2 mL完全培养液后吹匀,按(4~5)×104個/mL的细胞密度传代培养。取对数生长期第2代细胞,用Cytokeratin-8特异性抗体免疫荧光法[6]在荧光显微镜下进行观察鉴定。
2.3 活血散结方药物血浆干预视网膜色素上皮细胞增殖测定
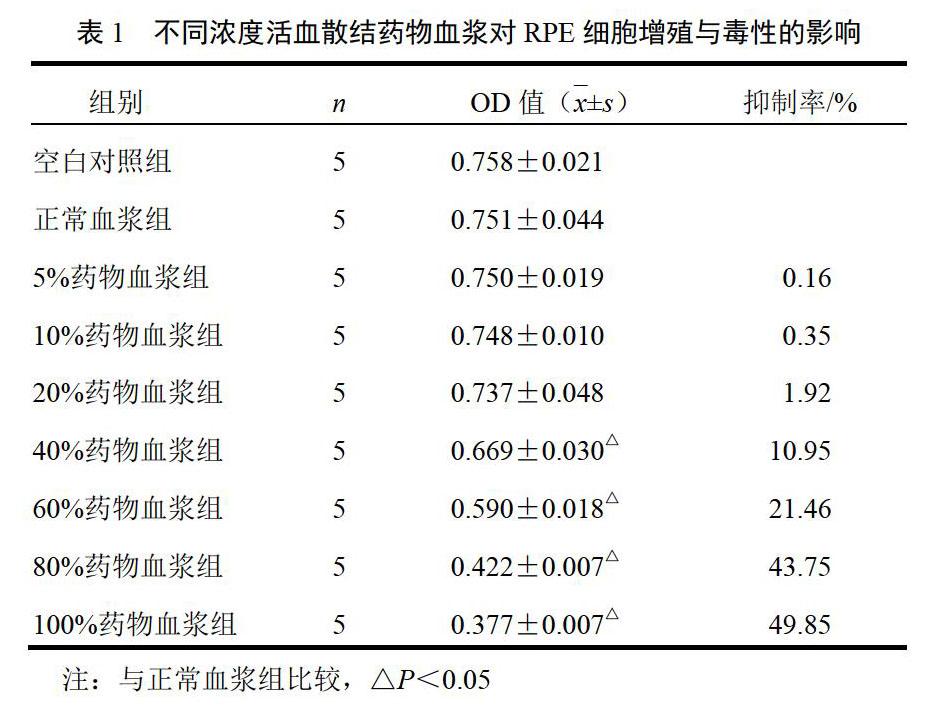
选取第4代体外培养兔RPE细胞,分为空白对照组(DMEM),正常血浆组(正常血浆)及5%、10%、20%、40%、60%、80%、100%药物血浆组(取血浆样本,按体积比1∶2加入纯甲醇,涡旋混合10 min,12 000 r/min离心10 min,取上清液,40 ℃氮气吹干,成冻干粉。用培养基溶分别溶解成7个浓度药物血浆。96孔板培养板培养,每组各设5个复孔。采用CCK-8法检测兔RPE细胞活力。取对数生长期兔RPE细胞,用培养基配成细胞悬液并调整细胞密度至50个/μL,每孔(96孔板培养板)加入100 μL,铺板后用PBS填充边缘孔。置于培养箱,5%CO2、37 ℃孵育,待细胞单层铺满孔底,加入用无血清培养基配制的不同浓度的药物血浆,每孔总体积为200 μL。培养48 h后,每孔加10 μL 7sea-cell counting kit。继续培养2 h后,应用酶标仪检测450 nm处的吸光度(OD)。記录结果,绘制图表,计算各组细胞增殖抑制率和IC50。细胞增殖抑制率(%)=[1-(实验组OD值÷正常血浆组OD值)]×100%。
2.4 血小板源性生长因子干预视网膜色素上皮细胞细胞增殖测定
选取第4代体外培养兔RPE细胞,实验分为空白对照组(DMEM)和PDGF低(5 μg/L PDGF-BB)、中(10 μg/L PDGF-BB)、高(20 μg/L PDGF-BB)剂量组。收集对数期细胞,调整细胞悬液浓度,96孔板加100 μL/孔,铺板,使待测细胞密度至5000个细胞/孔,边缘孔用PBS填充。设5个复孔/样本/浓度,5%CO2、37 ℃孵育,至细胞单层铺满孔底,加入用无血清培养基配制的不同浓度梯度的药物,5%CO2、37 ℃培养48 h。每孔加10 μL试剂盒中7sea-cell counting kit溶液,同步设调零孔。继续培养2 h,于酶标仪450 nm处测定OD。
2.5 活血散结方药物血浆和血小板源性生长因子干预兔视网膜色素上皮细胞增殖测定
实验细胞选取第4代体外培养兔RPE细胞,分为空白对照组(DMEM)、正常血浆组(正常血浆)、PDGF组(10 μg/L PDGF-BB)、PDGF+AG1296组(10 μg/L PDGF-BB+10 μmol/L AG1296)、PDGF+10%药物血浆组(10 μg/L PDGF-BB+10%活血散结药物血浆)、PDGF+20%药物血浆组(10 μg/L PDGF-BB 20%活血散结药物血浆)。
2.6 流式细胞仪检测兔视网膜色素上皮细胞周期
胰酶消化并收集对数生长期的RPE细胞,调整细胞悬液密度至5×105个/mL,取6孔板,根据“2.5”项下分组情况每个孔板加入相应细胞1 mL/孔上述细胞悬液,补足2 mL完全培养基,轻轻混匀,置于5%CO2、37 ℃培养箱中培养,至每孔内细胞融合率达70%~80%,根据分组加入相应干预因素,48 h后收样,流式细胞仪检测细胞周期。步骤:离心收集细胞,弃上清,用预冷PBS冲洗细胞2次;加入预冷70%乙醇,于4 ℃固定过夜;离心收集细胞,1 mL PBS冲洗细胞1次,加450 μL PBS重悬细胞,加50 μL RnaseA(2.5 mg/mL),使RNase A 终浓度为250 μg/mL,4 ℃避光孵育30 min;取50 μL碘化丙锭(1 mg/mL),加入上述细胞悬液中,使PI终浓度为100 μg/mL,4 ℃避光孵育30 min。1 h内进行流式细胞仪检测。
2.7 Western blot检测兔视网膜色素上皮细胞cyclin D1、pERK1/2及ERK1/2蛋白表达
用胰酶消化液消化并收集对数生长期的RPE细胞;调整细胞悬液密度至5×105个/mL;取6孔板,根据“2.5”项下分组情况加入相应细胞1 mL/孔上述细胞悬液,补足2 mL完全培养基,轻轻混匀;置于5%CO2、37 ℃培养箱中培养;至每孔内细胞融合率达70%~80%,根据分组加入相应干预因素;48 h后收样,进行Western blot检测。将需要抽提的蛋白细胞样本加入含有蛋白酶和磷酸酶抑制剂的RIPA裂解液,4 ℃充分裂解,将其刮入1.5 mL EP管中,95 ℃以上加热10 min,12 000×g离心10 min,取上清液,进行蛋白质定量后置于-80 ℃冰箱保存。取等量蛋白进行电泳、转膜、封闭。根据说明书稀释一抗,抗体加入封闭液中稀释到所需浓度,和膜室温孵育2 h或4 ℃孵育过夜。孵育一抗膜用TBST洗涤3次×5 min,随后根据用量,按1∶2000稀释HRP标记的二抗,与膜37 ℃孵育1 h。用TBST洗涤3次×5 min。最后用ECL化学发光检测,将胶片进行扫描,用图像分析软件IPP6.0对图像进行灰度分析。
3 统计学方法
采用SPSS21.0统计软件进行分析。实验数据以±s表示,采用方差分析,组间两两比较用LSD法(方差齐)或Tamhane法(方差不齐)。P<0.05表示差异有统计学意义。
4 结果
4.1 兔视网膜色素上皮细胞生长状况及鉴定
倒置显微镜下观察,采用酶消化法取材,RPE原代细胞呈圆形,胞体透亮,胞浆内可见较多黑色素颗粒,可见清晰透明的单核细胞或双核细胞。接种24 h后,细胞开始贴壁伸出伪足,逐渐变成扁平不规则多角形,分裂繁殖增快,生长活跃。5~7 d细胞基本融合呈镶嵌状排列。传代细胞1 h开始贴壁,24 h大部分贴壁伸出伪足,胞浆内黑色素颜色和颗粒随着传代次数的增加而减少,传至第4代时明显减少。传至第6代时,胞体透亮肥大,胞浆内色素完全消失,细胞轮廓清楚,细胞核及核仁清晰可见。Cytokeratin-8特异性抗体免疫荧光法结果显示,荧光显微镜下观察RPE细胞,荧光遍及胞质,细胞角蛋白染色呈强阳性。
4.2 活血散结方药物血浆对兔视网膜色素上皮细胞增殖和毒性的影响
活血散结方药物血浆各组干预RPE细胞48 h后细胞增殖与毒性检测结果显示,药物血浆对RPE细胞均有不同程度的增殖抑制作用,且存在一定量效关系(正相关),其中5%~20%活血散结方药物血浆对细胞有较弱的抑制作用,与正常血浆组比较,细胞活力OD值差异无统计学意义(P>0.05),而4%~100%活血散结方药物血浆对细胞的抑制作用则更为明显,与正常血浆组比较,细胞活力OD值差异有统计学意义(P<0.05);20%以下药物血浆对RPE细胞的增殖抑制率低于1.92%,计算活血散结方药物血浆IC50为95.65%,表明此次制备的活血散结方药物血浆虽然对RPE细胞有一定的增殖抑制作用,但毒性较低,20%及以下浓度活血散结方药物血浆对RPE细胞无明显细胞毒性。综合以上结果考虑选取10%、20%活血散结方药物血浆作为下一步实验干预浓度。结果见表1。
4.3 血小板源性生長因子对兔视网膜色素上皮细胞增殖的影响
不同剂量PDGF对RPE细胞的细胞活力均有一定的增强作用,且存在一定的量效关系,与空白对照组比较,细胞活力OD值差异有统计学意义(P<0.01);其中PDGF中、高剂量组较PDGF低剂量组作用更强,细胞活力OD值差异均有统计学意义(P<0.05);而PDGF中剂量组与PDGF高剂量组作用相当,细胞活力OD值差异无统计学意义(P>0.05)。故选取10 μg/L PDGF-BB作为下一步实验干预浓度。结果见表2。
4.4 活血散结方药物血浆对血小板源性生长因子干预下视网膜色素上皮细胞周期的影响
PDGF对RPE细胞周期有明显影响作用,PDGF组S+G2期比例高于正常血浆组,差异有统计学意义(P<0.01),表明PDGF有促进RPE细胞增殖的作用;AG1296对RPE细胞周期有明显影响作用,PDGF+AG1296组S+G2期比例低于PDGF组,差异有统计学意义(P<0.01),表明AG1296具有抑制RPE细胞增殖的作用,能阻止PDGF促RPE细胞增殖;而10%、20%活血散结方药物血浆亦能明显影响RPE细胞周期,2个浓度活血散结药物血浆组S+G2期比例均低于PDGF组,差异均有统计学意义(P<0.01),表明2个浓度活血散结方药物血浆均有抑制RPE细胞增殖的作用,能阻止PDGF促RPE细胞增殖,均与AG1296抑制剂作用相当,差异均无统计学意义(P>0.05),且10%、20%活血散结方药物血浆作用相当,差异无统计学意义(P>0.05)。结果见表3。
4.5 活血散结方药物血浆对视网膜色素上皮细胞cyclin D1蛋白表达的影响
PDGF有促进RPE细胞cyclin D1蛋白表达的作用,与正常血浆组比较,PDGF组RPE细胞cyclin D1蛋白表达差异有统计学意义(P<0.01);AG1296有抑制RPE细胞cyclin D1蛋白表达的作用,PDGF+AG1296组RPE细胞cyclin D1蛋白表达低于PDGF组,差异有统计学意义(P<0.01),表明AG1296具有阻止PDGF促RPE细胞cyclin D1蛋白表达的作用;而10%、20%活血散结方药物血浆均可抑制RPE细胞cyclin D1蛋白表达,2个浓度活血散结方药物血浆组RPE细胞cyclin D1蛋白表达均低于PDGF组,差异均有统计学意义(P<0.01),表明2个浓度活血散结方药物血浆均具有阻止PDGF促RPE细胞cyclin D1蛋白表达的作用,与AG1296抑制剂作用均相当,差异均无统计学意义(P>0.05),且2个浓度活血散结方药物血浆组间比较差异无统计学意义(P>0.05)。结果见表4。
4.6 活血散结方药物血浆对视网膜色素上皮细胞ERK信号通路蛋白表达的影响
PDGF有促进RPE细胞pERK1/2、ERK1/2蛋白表达的作用,与正常血浆组比较,PDGF组RPE细胞pERK1/2、ERK1/2蛋白表达差异有统计学意义(P<0.01);AG1296有抑制RPE细胞pERK1/2、ERK1/2蛋白表达的作用,PDGF+AG1296组RPE细胞pERK1/2、ERK1/2蛋白表达低于PDGF组,差异有统计学意义(P<0.01),表明AG1296具有阻止PDGF促RPE细胞pERK1/2、ERK1/2蛋白表达的作用;而10%、20%活血散结方药物血浆均可抑制RPE细胞pERK1/2、ERK1/2蛋白表达,2个浓度药物血浆组RPE细胞pERK1/2、ERK1/2蛋白表达均低于PDGF组,差异均有统计学意义(P<0.01),表明2个浓度活血散结方药物血浆具有阻止PDGF促RPE细胞pERK1/2、ERK1/2蛋白表达的作用,但与AG1296抑制剂作用相当,差异无统计学意义(P>0.05),且2个浓度活血散结方药物血浆组组间比较差异无统计学意义(P>0.05)。结果见表5。
5 讨论
中医对视网膜增殖物的辨证,认为凡出血所致日久不散变成膜状物多属气血瘀滞,炎症所致的增殖多因痰湿凝结。活血散结方中三七化瘀止血活血,丹参活血祛瘀,入肝经血分,二药合用活血化瘀,共为君药;昆布消痰软坚、利水消肿,入肝肾两经。全方共奏活血化瘀、软坚散结之功,使眼内瘀血痰结之有形之物消散,改善眼底情况,提高患者视功能。陈吉等[7-8]研究表明,活血利水法能降低PVR增殖膜中转化生长因子-β1、纤维连接蛋白信使核糖核酸阳性表达,抑制PVR的发生发展。付美林等[9-10]研究也显示,活血利水法可通过拮抗增殖膜中整合素β1、EGF mRNA表达的作用来抑制增殖细胞的过度增生,从而防治PVR形成和发展。
丝裂原活化蛋白激酶(MAPK)家族是真核细胞内普遍存在的参与调节细胞生物学反应的重要信号系统,与细胞的增殖、分化、转化及凋亡等不同调节功能密切相关。Ras/Raf/MEK/ERK是其中重要的信号通路,而ERKl/2是这一信号通路下游的核心元件。Punn等[11]发现ERKl/2信号传导通路的激活可促进各种细胞增殖分裂、分化相关的转录因子合成,对细胞损伤修复意义重大。但病理情况下,由细胞外刺激调节的RPE细胞ERKl/2信号传导通路激活并扩大,则有RPE细胞增殖、分化过度的可能,导致视网膜前或视网膜下的RPE细胞过量增殖,分化转型,终至PVR增殖膜的形成。PDGF可通过与RPE细胞细胞膜上的PDGF受体结合,激活相应络氨酸蛋白激酶通路,引发RPE细胞内信号转导级联放大反应,促进RPE增殖、迁移及凋亡。司艳芳等[12]通过体外细胞实验研究发现,PDGF-BB诱导的人RPE细胞的生物学活动主要通过ERKl/2、p38和PI3K等细胞信号转导通路完成,ERKl/2主要与人RPE细胞的增殖相关,而p38和PI3K主要与RPE细胞的迁移相关。
Motkura等[13]于1991年发现了cyclin D1基因,其编码翻译后的cyclin D1蛋白对细胞周期起着正性调节作用。研究发现,cyclin D1在细胞生长周期G1期向S期转化方面发挥着重要作用[14]。有研究表明, cyclin D1表达过度可导致细胞分裂增殖明显提高,甚至有恶变可能[15]。已有多项研究证实,cyclin D1的表达减少会阻滞细胞周期G1期向S期的转化[16-20]。郭丽莉等[21]通过细胞实验也发现,RPE细胞中cyclin D1的表达减少同样会阻滞细胞周期G1期向S期的转化。
本实验研究结果显示,10%、20%活血散结方药物血浆均能降低PDGF干预下兔RPE细胞S+G2期的比例,且存在一定的量效关系趋势,与PDGF组比较差异均有统计学意义(P<0.01),表明10%、20%活血散结方药物血浆均有抑制PDGF干预下兔RPE细胞的增殖、迁移的作用,抑制PDGF干预下兔RPE细胞进入分裂增殖周期。2个浓度药物血浆以上作用均与AG1296相当(P>0.05),但10%和20%活血散结方药物血浆以上作用亦相当(P>0.05)。研究结果还显示,10%、20%活血散结方药物血浆均能抑制PDGF干预下兔RPE细胞与细胞增殖相关的细胞周期调控蛋白cyclin D1及ERK1/2细胞信号通路pERK1/2、ERK1/2蛋白的表达,且存在一定的量效关系趋势,与PDGF组比较差异均有统计学意义(P<0.01),均与AG1296作用相当(P>0.05),10%、20%活血散结方药物血浆以上作用亦相当(P>0.05)。表明10%、20%活血散结方药物血浆均能通过抑制cyclin D1蛋白的表达及抑制ERK1/2細胞信号通路pERK1/2、ERK1/2蛋白的表达而阻止RPE细胞分裂增殖。
综上,活血散结方药物血浆能有效抑制RPE细胞增殖,其机制是通过抑制ERK信号通路,以及对周期蛋白的调控来抑制RPE细胞增生。
参考文献:
[1] 任彦新.姜黄素在增殖性玻璃体视网膜病变中对表皮生长因子的作用[D].石家庄:河北医科大学,2016.
[2] 苗景鹏,魏文斌.增生性玻璃体视网膜病变的发病机制及治疗研究进展[J].国际眼科纵览,2013,37(6):367-373.
[3] 韩瑞芳.增生性玻璃体视网膜病变相关细胞因子研究进展[J].中华实验眼科杂志,2016,34(8):765-768.
[4] 杨晓旭,杨冬萍,俞洋.中医药防治增殖性玻璃体视网膜病变研究进展[J].辽宁中医药大学学报,2017,19(12):109-112.
[5] 彭俊,曾志成,谭涵宇,等.眼科活血利水法的基础研究进展[J].眼科新进展,2010,30(6):585-589,593.
[6] 胡健艳,陈雪,陈辉,等.兔视网膜色素上皮细胞培养和鉴定[J].南通大学学报,2005,25(3):171-173.
[7] 陈吉,彭清华,邢雁飞,等.活血利水法对外伤性增生性玻璃体视网膜病变兔眼玻璃体TGF-β1表达的影响[J].湖南中医药大学学报,2010, 30(5):12-15.
[8] 陈吉,彭清华,邢雁飞,等.活血利水法对外伤性PVR兔眼玻璃体FN mRNA表达的影响[J].国际眼科杂志,2009,9(12):2303-2306.
[9] 付美林,彭清华,陈吉,等.活血利水法对兔外伤性PVR增殖膜上EGF mRNA表达的影响[J].国际眼科杂志,2012,12(1):25-29.
[10] 付美林,彭清华,陈吉,等.活血利水法对兔外伤性玻璃体视网膜病变增殖膜上整合素β1表达的影响[J].中华中医药学刊,2011,29(4):722-725.
[11] PUNN A, MOCRIDGE J W, FAROOQUI S, et al. Sustained activation of p42/p44 mitogen-activated protein kinase during recovery from simulated ischaemia mediates adaptive cytoprotection in cardiomyocytes[J]. Biochem J,2000,350:891-899.
[12] 司艳芳,王君,关娟,等.血小板来源的生长因子通过ERK/p38/PI3K促进人视网膜色素上皮细胞的增殖、迁移[J].现代生物医学进展,2012:12(34):6628-6631.
[13] MOTKURA T, BLOOM T, KIM H G, et al. A novel cyclinencoded by a bell-linked candidate oncogene[J]. Nature,1991,350:512.
[14] MARX J. How cells cycle toward cancer[J]. Science,1994,263:319- 321.
[15] SHERR C J. G1 phase progression:cycling on cue[J]. Cell,1994, 79:551-555.
[16] GAO J, ZHU J, LI H Y, et a1. Small interfering RNA targeting integrin linked kinase inhibited the growth and induced apoptosis inhuman bladder cancer cells[J]. Int J Biochem Cell Biol,2011, 43:1294-1304.
[17] PERSAD S, ATTWELL S, GRAY V, et a1. Inhibition of integrin- linked kinase (ILK) suppresses activation of protein kinase B/Akt and induces cell cycle arrest and apoptosis of PTEN-mutant prostate cancer cells[J]. Proc Natl Acad Sci USA,2000,97:3207- 3212.
[18] ZHU X Y, LIU N, LIU W, et a1. Silencing of the integrin-linked kinase gene suppresses the proliferation,migration and invasion of pancreatic cancer cells (Panc.1)[J]. Genet Mol Biol,2012,35:538- 544.
[19] D'AMICO M,HULIT J, AMANATULLAH D F, et a1. The integrin-linked kinase regulates the cyclin D1 gene through glycogen synthase kinase 3beta and cAMP-responsive element-binding protein dependent pathways[J]. J Biol Chem,2000,275:32649-32657.
[20] WANG D L, LAN J H, CHEN L, et al. Integrin-linked kinase functions as a tumor promoter in bladder transitional cell carcinoma[J]. Asian Pac J Cancer Prev,2012,13:2799-2806.
[21] 郭麗莉,于文贞,黎晓新,等.整合素连接激酶对视网膜色素上皮细胞生长、凋亡和分泌功能的影响[J].中华实验眼科杂志,2013,31(8):729- 733.
