宫颈病变组织中CDC7和PHH3蛋白的表达及临床意义△
2019-03-14王海燕丁燕青海大学附属医院妇科青海西宁810001
王海燕,丁燕青海大学附属医院妇科,青海 西宁 810001
2甘肃省肿瘤医院妇瘤科,甘肃 兰州 7300300
宫颈癌是女性生殖系统最常见的恶性肿瘤之一,其发病的年轻化趋势越来越明显,严重危害女性的身体健康和生活质量。宫颈癌主要与高危型人乳头瘤病毒(human papilloma virus,HPV)感染有关,HPV感染可导致细胞周期调控失常并发生恶性转移[1]。目前,规范化的宫颈癌筛查可显著降低其发病率,但仍会出现细胞学和HPV检查假阴性的问题,因此,对宫颈癌进行早期诊断及预后评估仍是一个亟待解决的问题。磷酸化组蛋白H3(phospho histone H3,PHH3)是一种抗磷酸化的组蛋白H3的抗体[2],组蛋白H3的磷酸化与有丝分裂染色体的浓缩相关,且其表达水平与肿瘤的恶性程度呈正相关,是一个具有潜在价值的肿瘤标志物,与肿瘤的预后密切相关。细胞周期的失调可导致肿瘤细胞的生长,且对肿瘤的生物学行为及预后有重要意义[3]。研究显示,细胞分裂周期蛋白7(cell division cycle protein 7,CDC7)在多种肿瘤细胞中高表达,在所有转移肿瘤细胞中也均显示高表达,使其成为目前肿瘤研究的重要标记和靶点[4]。表明CDC7蛋白是肿瘤发生、发展过程中的关键调控因子。目前,国内关于宫颈癌PHH3与CDC7的表达水平及其相关性的研究较少。本研究探讨不同宫颈病变组织中CDC7及PHH3的表达水平,分析其与宫颈癌临床特征的关系,为宫颈癌的早期诊断提供理论依据,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2016年8月至2017年5月在青海大学附属医院接受病理组织学检测的宫颈疾病患者的组织标本。纳入标准:所有患者均经病理活检证实为宫颈鳞癌、宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)或宫颈炎。排除标准:①宫颈鳞癌患者术前接受放化疗及免疫治疗;②合并其他系统恶性肿瘤的患者。依据纳入和排除标准,共纳入144例宫颈疾病患者,年龄21~78岁,平均年龄(48.2±5.6)岁。宫颈脱落细胞学检查:阴性28例,无明确意义的不典型鳞状上皮细胞(atypical squamous cells of undetermined significance,ASCUS)16例,低度鳞状上皮内病变(low-grade squamous intraepithelial lesion,LSIL)32例,不除外高度鳞状上皮内病变的不典型鳞状上皮细胞(atypical squamous cells-cannot exclude high-grade squamous intraepithelial lesion,ASC-H)40例,高度鳞状上皮内病变(highgrade squamous intraepithelial lesion,HSIL)28 例 。病理学检测结果:正常宫颈组织28例,CINI级30例,CINⅡ~Ⅲ级32例,宫颈鳞癌44例,宫颈腺癌10例。根据病理学检测结果,本研究共纳入54例宫颈癌患者,年龄:<55岁24例,≥55岁30例;病理分级:高34例,低中20例;淋巴结转移:无18例,有36例;临床分期:I~Ⅱ期23例,Ⅲ~Ⅳ期31例。
1.2 主要试剂
兔抗人CDC7单克隆抗体[稀释浓度为(1∶50)~(1∶500)]购自美国Santa Cruz公司,兔抗人PHH3单克隆抗体(稀释浓度为1∶200)购自北京中杉金桥生物技术有限公司。免疫组织化学试剂盒、二氨基联苯胺(diaminobenzidine,DAB)显色剂均购自北京中杉金桥生物技术有限公司。
1.3 免疫组织化学染色法检测CDC7和PHH3蛋白表达情况
免疫组织化学染色法检测144例宫颈病变患者宫颈组织中CDC7和PHH3蛋白的表达情况。取组织标本常规脱水包埋,5 μm连续切片,二甲苯脱蜡5 min,重复3次。乙醇梯度水化,3%过氧化氢溶液室温孵育10 min,磷酸盐缓冲液(phosphate buffer solution,PBS)冲洗 5 min,重复 3次。滴加5%牛血清白蛋白(bovine serum albumin,BSA)溶液,37℃孵育30 min。滴加一抗(稀释浓度为1∶100),4 ℃孵育过夜,PBS冲洗5 min,重复3次,滴加二抗室温孵育30 min,DAB溶液显色,镜下观察显色反应,显色结束后置于流动水冲洗,苏木素复染。以PBS代替一抗作为阴性对照,以已知CDC7和PHH3阳性表达的宫颈病变组织作为阳性对照。采用累积光密度(integrated optical density,IOD)值表示 CDC7和 PHH3蛋白的表达水平。
1.4 结果判定
宫颈组织CDC7和PHH3蛋白均主要定位于细胞核,细胞核棕黄色染色为CDC7和PHH3表达阳性,其表达水平以阳性细胞数计算,即200倍显微镜下计数10个视野中阳性细胞数占总细胞数的百分比,<10%判定为阴性,≥10%判定为阳性。所有组织标本均由2名病理医师独立进行评定。
1.5 统计学方法
采用SPSS 13.0软件对数据进行统计分析。计数资料以例数和率(%)表示,组间比较采用χ2检验或Fisher确切概率法;相关性分析采用Spearman相关分析;以P<0.05为差异有统计学意义。
2 结果
2.1 CDC7和PHH3蛋白的阳性表达情况
正常宫颈组织中未见CDC7和PHH3蛋白阳性表达;CINI~Ⅲ组织中,CDC7和PHH3蛋白阳性表达,阳性细胞数逐渐增多;宫颈腺癌和宫颈鳞癌组织中,CDC7和PHH3蛋白阳性表达细胞数明显增多且染色逐渐加深。(图1、图2)
2.2 CDC7和PHH3蛋白阳性表达率的比较
病理学检测结果中,CDC7和PHH3蛋白在正常宫颈组织、CINI级、CINⅡ~Ⅲ级、宫颈腺癌和宫颈鳞癌中的阳性表达率明显升高,组间比较差异均有统计学意义(χ2=61.509,P<0.01;χ2=54.966,P<0.01)。在宫颈脱落细胞学检查结果中,CDC7和PHH3蛋白在正常宫颈组织、ASCUS、LSIL、ASC-H和HSIL中的阳性表达率明显升高,组间比较差异均有统计学意义(χ2=50.406,P<0.01;χ2=54.761,P<0.01)。(表1)
2.3 不同临床特征宫颈癌组织中CDC7和PHH3蛋白的阳性表达情况
不同临床分期的宫颈癌患者的CDC7蛋白阳性表达率比较,差异有统计学意义(P<0.05);不同年龄、淋巴结转移情况、病理分型和病理分级的宫颈癌患者CDC7蛋白阳性表达率比较,差异均无统计学意义(P>0.05)。不同淋巴结转移情况和临床分期的宫颈癌患者PHH3蛋白阳性表达率比较,差异均有统计学意义(P<0.05);不同年龄、病理分型及病理分级的宫颈癌患者的PHH3蛋白阳性表达率比较,差异均无统计学意义(P>0.05)。(表 2)
2.4 不同程度宫颈病变组织中CDC7和PHH3蛋白阳性表达的相关性分析
Spearman相关分析结果显示,CDC7阳性表达与PHH3阳性表达呈明显正相关(r=0.390,P<0.01)。
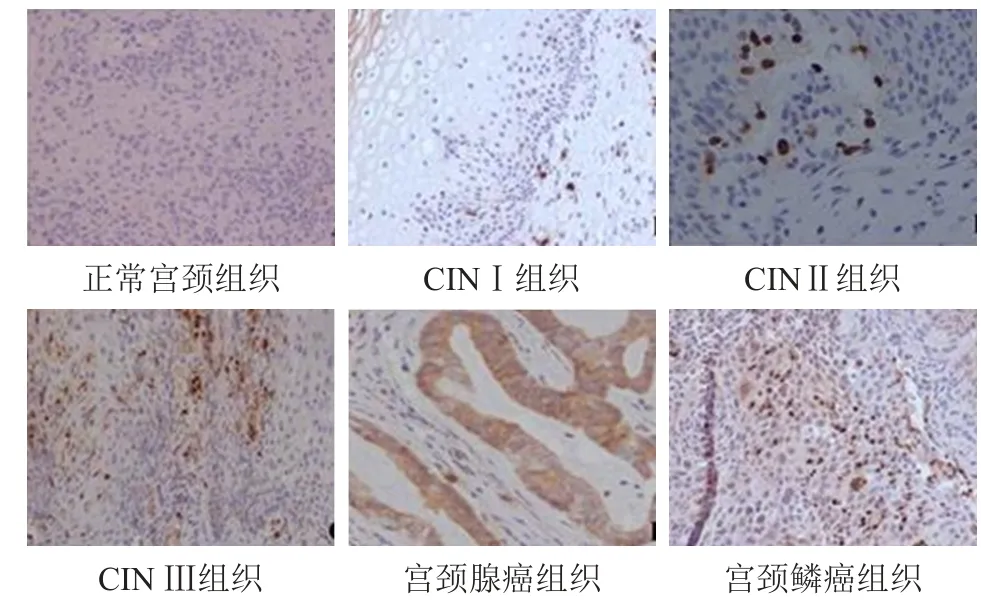
图1 正常宫颈组织及不同程度宫颈病变组织中CDC7蛋白的表达情况(免疫组织化学染色,×200)
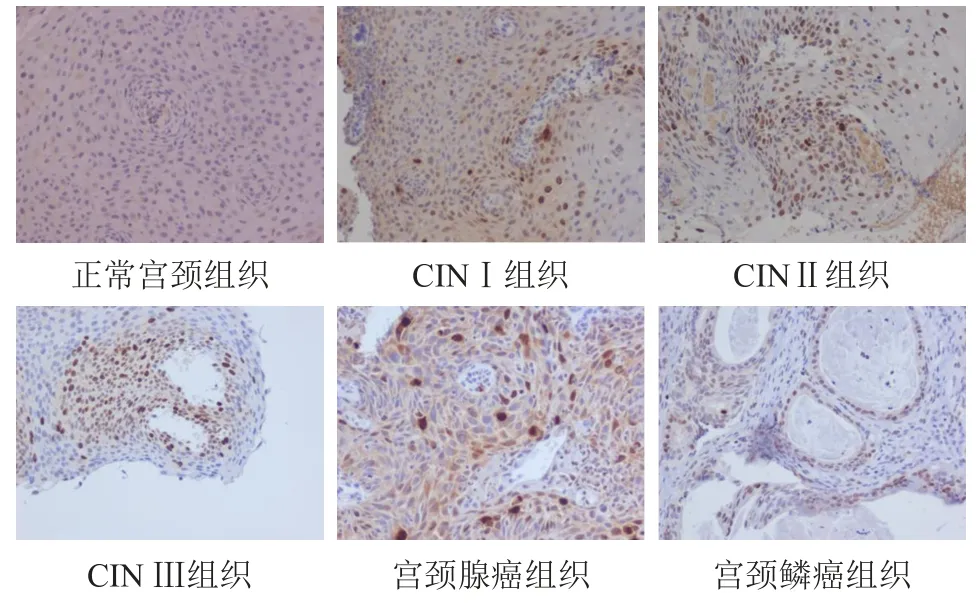
图2 正常宫颈组织及不同程度宫颈病变组织中PHH3蛋白的表达情况(免疫组织化学染色,×200)
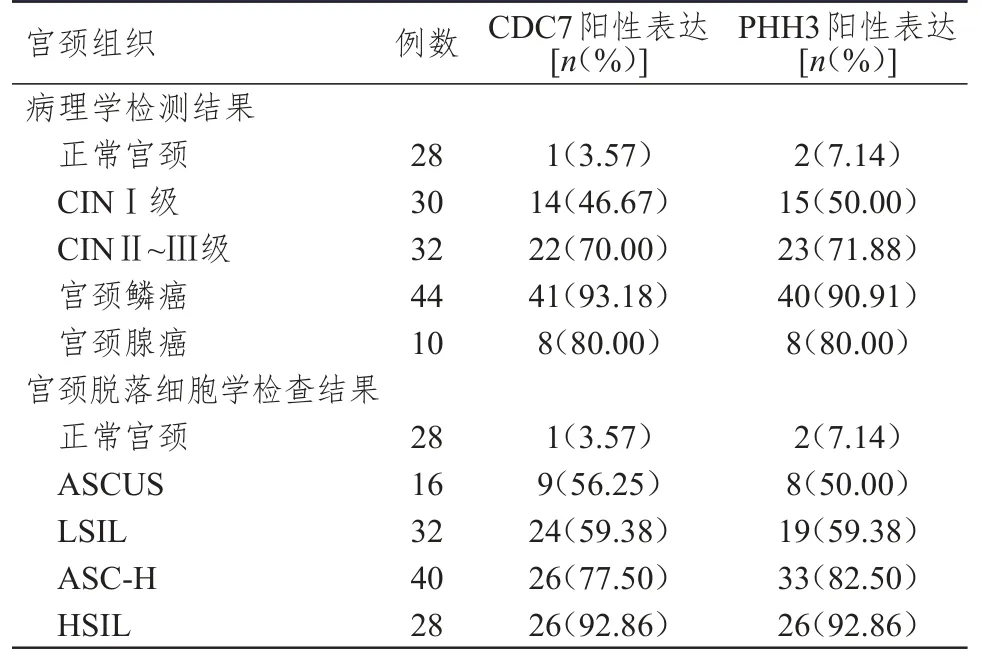
表1 144例宫颈疾病患者的宫颈组织中CDC7和PHH3蛋白阳性表达情况
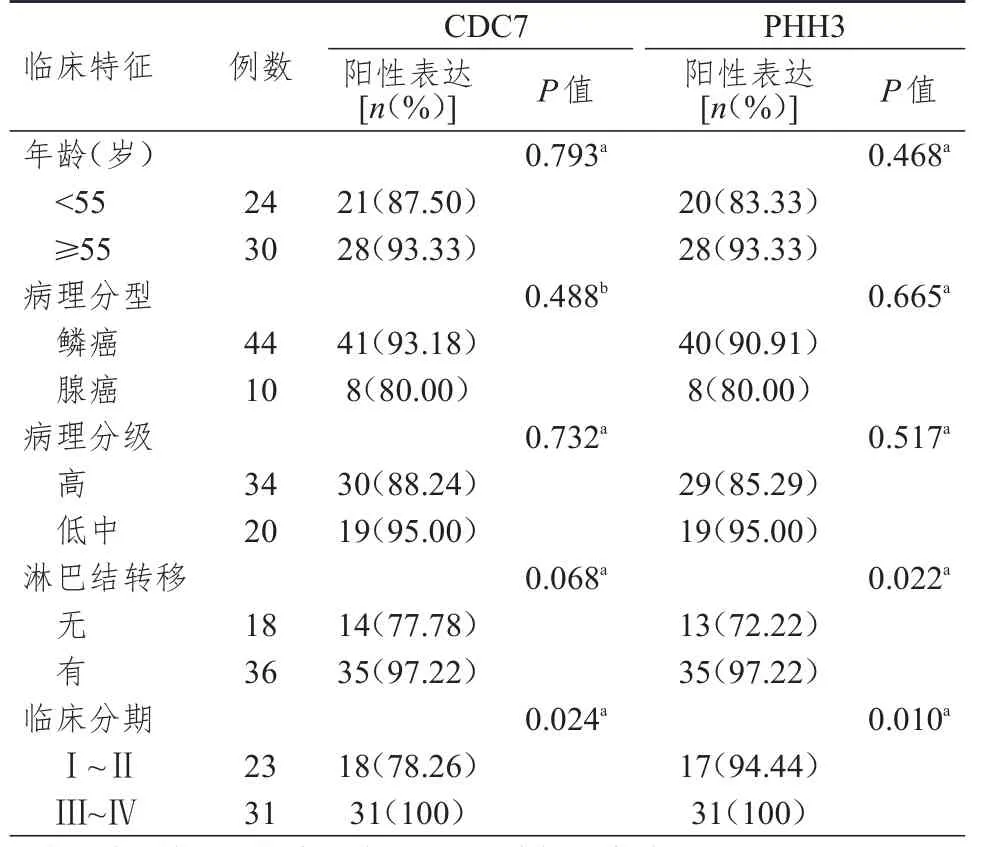
表2 不同临床特征宫颈癌组织中CDC7和PHH3蛋白的表达情况(n=54)
3 讨论
细胞分子生物学研究认为,肿瘤的发生本质上是由于细胞周期的调控紊乱导致,与参与DNA复制的相关蛋白密切相关[3]。检测影响细胞周期调控的生物标志物,可以预测肿瘤的发生发展。
CDC7蛋白是参与DNA复制的重要蛋白之一。CDC7蛋白在细胞有丝分裂进入S期时发挥重要作用,且该蛋白的表达在整个细胞周期中相对恒定,但其活性会随细胞周期的变化而改变。RNA 干扰(RNA interference,RNAi)沉默CDC7的表达,可导致肿瘤细胞凋亡,抑制肿瘤细胞的增殖。Rodriguez-Acebes等[5]对乳腺癌进行了重点研究,结果发现,CDC7蛋白高表达可导致细胞周期进展加速、肿瘤细胞分化阻滞、基因组不稳定等,表明CDC7蛋白的异常表达与肿瘤的发生发展相关。因此,可采用CDC7蛋白作为生物学标志物,评估肿瘤细胞的增殖状态,CDC7蛋白可能具有作为一类新的抗肿瘤药物模型的潜能。
研究显示,CDC7和PHH3蛋白在部分肿瘤中的表达具有相关性[6]。PHH3蛋白可协助评估子宫内膜癌的病理分级,并可作为核分裂的标志物,定量分析细胞的增殖情况[7]。PHH3蛋白定位于细胞有丝分裂早期的细胞核,能明确反映正常、凋亡和退变的细胞核,提高辨认细胞核分裂的灵敏度及特异度。PHH3蛋白高表达可以促进细胞增殖和肿瘤生长,因此,检测PHH3蛋白在肿瘤细胞中的表达情况,可降低细胞学检测中的假阴性率,并可鉴别ASC-H和HSIL的患者。目前,ASC-H一般采用阴道镜活检确诊,部分临床医师建议保守治疗,定期复查,有可能延误了最佳治疗时间。
临床上可采用宫颈脱落细胞学检查CDC7和PHH3蛋白的阳性表达情况,进行早期筛查宫颈癌,做到早发现、早治疗。细胞分子生物学研究认为,肿瘤发生的本质上是由于细胞周期的调控紊乱,呈现出过度增殖和凋亡不足的状态。随着对细胞周期调控研究的不断深入,多数学者认同了肿瘤的发生多与细胞周期调控有关的观点[8]。本研究结果显示,CDC7和PHH3蛋白的阳性表达率均随宫颈病变的严重程度而逐渐升高,表明CDC7和PHH3蛋白的表达情况可能与宫颈癌的发生发展有关。
CDC7和PHH3蛋白均可促进肿瘤细胞的增殖,CDC7是丝氨酸/苏氨酸激酶,反映细胞周期中的S期,可调控微小染色体维持蛋白(minichromosome maintenance protein,MCM)的N端氨基酸磷酸化,磷酸化后的MCM可失活,并结合于染色质上的转录起始位点,启动DNA复制过程,通过调控细胞周期促进肿瘤细胞增殖[9]。由于CDC7在所有转移肿瘤细胞中均高表达,使其成为目前关于肿瘤研究的重要标志物和靶点[10]。目前,国内外的相关研究多集中于CDC7和PHH3蛋白在乳腺癌、前列腺癌、食管癌、胃癌、肝癌和非小细胞肺癌等恶性肿瘤中的表达,且已经发现其与临床疗效及预后有一定关系。虽然,徐瑞云等[11]采用实时逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)检测子宫内膜腺癌组织中CDC7mRNA的表达水平,结果显示,子宫内膜癌组织中CDC7mRNA的表达水平明显高于正常子宫内膜组织(P<0.05)。但对于宫颈病变组织中CDC7和PHH3蛋白促进肿瘤发展的作用机制及其与临床特征的关系尚未明确。此外,部分宫颈病变的病理学诊断及鉴别非常困难,主要原因包括以下3个方面:①绝经后女性的鳞状上皮萎缩及CIN病变,尤其是高度的CIN病变;②宫颈腺体的鳞化及化生性增生与CIN病变;③严重的宫颈炎可能刺激上皮反应性增生或掩盖高度的CIN。因此,寻找更为准确的标志物量化、辅助病理学诊断,提高其诊断的准确度至关重要。
本研究结果显示,CDC7蛋白的阳性表达可能与宫颈癌临床分期有关,与年龄、淋巴结转移、病理分型和病理分级无关;PHH3蛋白的阳性表达可能仅与宫颈癌淋巴结转移有关。表明CDC7和PHH3蛋白可能与宫颈癌的浸润、转移和预后有关,有望成为评估宫颈癌临床进展及预后的指标。但本研究仅纳入了10例宫颈腺癌患者,结果可能存在偏差,需进一步扩大样本量深入研究。
综上所述,CDC7和PHH3蛋白的高表达与宫颈癌的发生、发展、侵袭和转移有关,有望成为评估、预测宫颈癌侵袭转移的指标。
