腹腔镜辅助胃癌根治术和常规开腹胃癌根治术对患者免疫指标及微转移的影响
2019-03-14王晓明孙贺孟刚王伟明王岩
王晓明,孙贺,孟刚,王伟明,王岩
吉林省肿瘤医院结直肠胃腹部外科,长春 1300120
胃癌是消化系统常见的恶性肿瘤,其发病率和病死率均较高。早期诊断并采用合理的治疗方法有助于改善患者的预后和延长患者的生存时间[1]。手术治疗是临床上治疗胃癌的主要方法。常规开腹胃癌根治术较为成熟,疗效可靠,但其缺点为手术切口大,组织创伤大,术中出血量大。随着腹腔镜技术的发展和进步,腹腔镜辅助胃癌根治术逐渐应用于临床,克服了胃周解剖层次多、周围结构复杂、术后重建技术高的困难,获得了良好的临床效果[2-3]。手术创伤对机体免疫功能及腹腔内微转移的影响是目前胃癌研究领域的热点。本研究通过回顾性分析70例胃癌患者的临床资料,比较了腹腔镜胃癌根治术和常规开腹胃癌根治术对患者免疫指标及微转移的影响,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2016年2月至2017年2月于吉林省肿瘤医院诊治的胃癌患者的临床资料。纳入标准:①年龄<80岁;②经组织病理学检查证实为胃癌;③TNM分期为Ib~Ⅲc期;④术前美国麻醉医师 协 会(American Society of Anesthesiologists,ASA)评分≤3分;⑤初次就诊,既往未接受过放疗和化疗;⑥术前未使用过免疫调节剂。排除标准:①术前及术后合并感染;②合并其他部位恶性肿瘤;③有腹部手术史;④胸腹部先天畸形;⑤合并血液系统疾病;⑥合并严重肝肾功能不全;⑥合并穿孔、大出血等严重并发症。根据纳入和排除标准,本研究共纳入70例胃癌患者,根据治疗方法的不同将其分为观察组和对照组,每组35例。其中,观察组患者行腹腔镜辅助胃癌根治术,对照组患者行常规开腹胃癌根治术。观察组中,男21例,女14例;年龄为43~69岁,平均年龄为(56.3±11.6)岁;肿瘤分期:Ib期4例,Ⅱ期14例,Ⅲ期17例;手术方式:毕I式吻合4例,毕Ⅱ式吻合18例,Roux-Y吻合11例,食管残胃吻合2例。对照组中,男24例,女11例;年龄为45~72岁,平均年龄为(57.6±10.2)岁;肿瘤分期:Ib期5例,Ⅱ期14例,Ⅲ期16例;手术方式:毕I式吻合3例,毕Ⅱ式吻合17例,Roux-Y吻合12例,食管残胃吻合3例。两组患者的性别、年龄、手术方式、肿瘤分期比较,差异均无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 手术方法 观察组患者行腹腔镜辅助胃癌根治术,全身麻醉后采用五孔法操作,腹腔镜下探查胃癌病灶及其周围情况,利用超声刀对病灶及区域淋巴结进行切除,根据病变情况采用不同的术式及消化道重建方式。对照组患者行常规开腹胃癌根治术,全身麻醉后采用腹部正中切口,通过直视探查胃癌病灶及其周围情况,利用超声刀对病灶及区域淋巴结进行切除,根据病变情况采用不同的术式及消化道重建方式。
1.2.2 检测方法 观察组患者于建立气腹后,对照组患者于开腹时及两组患者于关腹前收集腹腔冲洗液。收集方法:向腹腔内注射0.9%NaCl溶液250 ml,3 min后抽取100 ml腹腔冲洗液,经Eppendorf台式高速离心机离心处理,离心半径为13.5 cm,1500 r/min下离心5 min,取上清液冷藏备检。于术后即刻、术后1天、术后3天和术后7天清晨收集腹腔引流液100 ml,离心及储存方式同上所述。分别于术前、术后即刻及术后1天、3天、7天清晨抽取全部患者的空腹外周静脉血,经Eppendorf台式高速离心机离心处理,离心半径为13.5 cm,1500 r/min下离心5 min,取上清液冷藏备检。检查设备:化学发光分析仪购自美国Thermo公司,试剂盒购自中国USCNK公司。检测范围为7.3~1000.0 pg/L。采用双抗体夹心酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)法检测腹腔引流液中的白细胞介素-10(interleukin-10,IL-10)和腹腔冲洗液中的癌胚抗原(carcinoembryonic antigen,CEA)及多巴脱羧酶(dopadecarboxylase,DDC)水平,采用单向免疫扩散法检测外周血补体C3、C4水平,采用免疫共沉淀法检测免疫球蛋白G(immunoglobulin G,IgG)、免疫球蛋白 A(immunoglobulin A,IgA)、免疫球蛋白M(immunoglobulin M,IgM)水平。
1.3 观察指标
比较手术前后两组患者外周血免疫指标IgG、IgA、IgM、C3及C4水平,腹腔引流液中微转移指标IL-10水平以及腹腔冲洗液中微转移指标CEA、DDC水平的变化情况。
1.4 统计学方法
采用SPSS 18.0软件对-数据进行统计分析。计量资料以均数±标准差(x±s)表示,多组间比较采用重复测量方差分析,两组间比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 手术前后IgG、IgA、IgM、C3及C4水平的比较
术后即刻,两组患者外周血中的IgG、IgA、IgM、C3及C4水平均降至最低,术后1天、3天均开始呈现逐渐升高的趋势,至术后7天均接近术前水平。经重复测量方差分析,两组患者的C3水平比较,差异有统计学意义(F组间=3.548,P组间<0.05);不同时间点(术前、术后即刻、术后1天、术后3天、术后7天)的C3水平比较,差异有统计学意义(F时间=6.541,P时间<0.05);组间与时间存在交互作用(F交互=4.267,P交互<0.05)。两组患者的IgG、IgA、IgM及C4在不同时间点比较,差异均有统计学意义(F时间=15.231、9.564、25.889、17.568,P<0.05),但组间、组间·不同时间点的交互作用比较,差异均无统计学意义(P>0.05)。(表1)
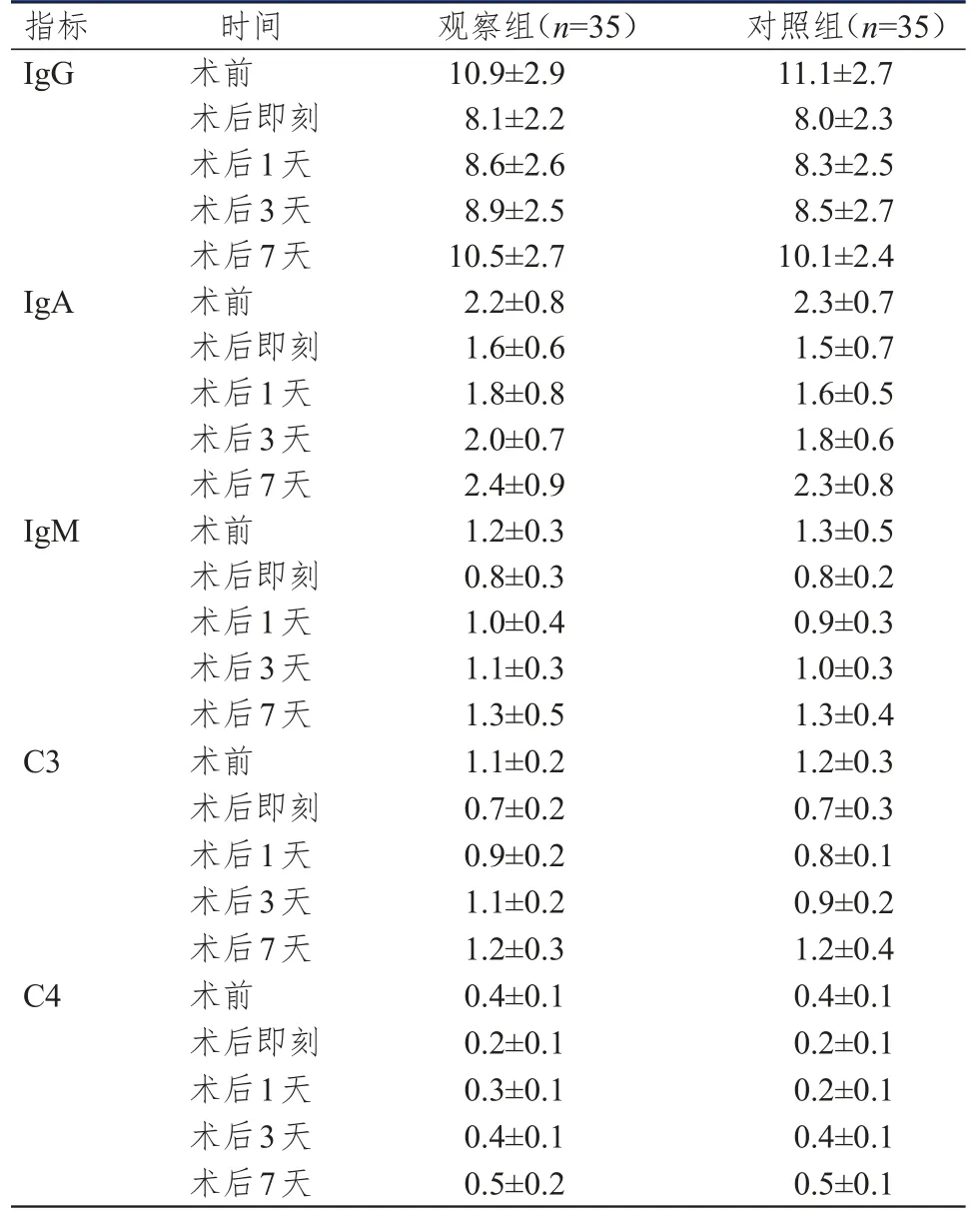
表1 手术前-后两组患者的IgG、IgA、IgM、C3及C4水平(g/L,x±s)
2.2 术后各个时间点腹腔引流液中IL-10水平的变化
术后1~3天,两组患者腹腔引流液中的IL-10水平均高于术后即刻,且至术后1天达最高水平,术后2天及3天逐渐降低。术后,两组患者腹腔引流液中的IL-10水平在组间、不同时间点、组间·不同时间点比较,差异均有统计学意义(P<0.05)。(表2)

表2 两组患者腹腔引流液中的IL-10水平比较(pg/ml,x-±s)
2.3 手术前后腹腔冲洗液中CEA、DDC水平的比较
观察组患者手术结束时腹腔冲洗液中的CEA、DDC 水平分别为(1418.9±572.2)ng/L、(115.2±42.1)ng/L,均高于手术开始时的(210.3±92.5)ng/L、(7.7±2.9)ng/L,差异均有统计学意义(t=12.336、11.695,P<0.05);对照组患者手术结束时腹腔冲洗液中的CEA、DDC水平分别为(2145.7±962.8)ng/L、(162.2±60.8)ng/L,均高于手术开始时的(231.7±102.5)ng/L、(7.3±2.7)ng/L,差异均有统计学意义(t=15.071、15.057,P<0.05)。手术开始时,两组患者的CEA、DDC水平比较,差异均无统计学意义(t=0.917、0.597,P>0.05)。手术结束时,观察组患者的CEA、DDC水平均低于对照组患者,差异均有统计学意义(t=3.839、3.759,P<0.05)。
3 讨论
胃癌根治术对机体的创伤会导致患者的免疫功能异常,主要原因为手术创伤、麻醉、出血及应激反应等,使患者体内的细胞因子、炎性介质及免疫调节机制平衡被打破,通过神经内分泌及免疫系统影响机体功能及术后恢复[4]。
IgG、IgA、IgM均为重要的免疫球蛋白,与机体免疫功能密切相关。补体C3和C4为人体免疫调节中的主要效应因子。当机体处于创伤应激的状态下时,IgG、IgA、IgM、C3及C4水平均会有所降低。本研究中,术后即刻,两组患者的外周血IgG、IgA、IgM、C3及C4水平均降至最低水平;术后1天、术后3天,两组患者的外周血IgG、IgA、IgM、C3及C4水平均逐渐升高,至术后7天接近术前水平。提示手术创伤后,患者机体免疫功能相关指标IgG、IgA、IgM、C3及C4水平均降低,术后其均呈逐渐升高趋势。IgG、IgA、IgM均由浆细胞合成和释放,其中,IgG、IgM相关浆细胞主要分布于脾脏及淋巴结;IgA相关浆细胞主要分布于呼吸道、消化道黏膜。C3和C4主要由肝脏合成,并以C3的含量最高。既往研究显示,行腹腔镜根治性全胃切除术后,患者的免疫球蛋白水平明显下降,且恢复较快[5]。有研究指出,开腹手术组与腹腔镜手术组的胃癌患者术后免疫功能监测显示第24、72小时免疫指标(C3、C4、IgG、IgA、IgM)水平较术前均明显下降,第72小时后逐渐恢复,但腹腔镜组术后变化平缓,与术前比较,差异无统计学意义,提示虽然两种手术方式对胃癌患者的免疫功能均具有抑制作用,但行腹腔镜手术后,患者机体免疫功能波动小[6]。本研究中,两组患者的C3水平在组间、不同时间点、组间·不同时间点比较,差异均有统计学意义(P<0.05),提示腹腔镜手术有利于胃癌患者免疫功能的恢复。分析其原因,可能与腹腔镜手术创伤较小、术中出血量少和相关组织损伤小有关,另外,对照组患者的术中出血量较大,也会影响患者的相关免疫功能指标。
IL-10为抗炎因子,通过与白细胞介素-6(interleukin-6,IL-6)相互抑制而发挥作用,包括抑制炎性反应和免疫细胞活性的生物学功能。IL-10水平的升高有利于改善患者预后,为影响患者预后的重要保护因素[7]。研究显示,IL-10还具有抑制肿瘤细胞增殖及浸润的作用。本研究中,两组患者腹腔引流液中的IL-10水平于术后升高,至术后1天达最高水平,术后2天及3天逐渐降低,提示行胃癌根治术后,患者的IL-10水平较高,这可能与机体炎性反应被激活有关[8]。而IL-10在抑制炎性反应的同时也抑制了肿瘤细胞的侵袭与转移。且本研究显示,术后两组患者腹腔引流液中的IL-10水平在组间、不同时间点、组间·不同时间点比较,差异均有统计学意义(P<0.05),说明腹腔镜辅助胃癌根治术对微转移的抑制作用更强。CEA是胃肠道肿瘤最重要的肿瘤标志物,以往研究显示,CEA水平与胃癌腹膜转移密切相关,尤其是能够很好地预测胃癌的腹腔播散[9]。DDC为多巴胺类酶,与肿瘤细胞的增殖、凋亡有关。研究显示,DDC预测胃癌腹膜转移的灵敏度和特异度分别高达87%和97%[10]。本研究结果显示,两组患者手术结束时腹腔冲洗液中的CEA、DDC水平均高于本组手术开始时;观察组患者手术结束时的CEA、DDC水平均低于对照组患者,说明与常规开腹胃癌根治术比较,腹腔镜辅助胃癌根治术能够降低腹腔冲洗液中的CEA、DDC水平,从而降低患者发生微转移的概率。
综上所述,腹腔镜辅助胃癌根治术对胃癌患者的免疫功能影响小,且患者腹腔冲洗液中的CEA、DDC等微转移相关指标的水平较低,较常规开腹胃癌根治术具有优势。
