依维莫司治疗激素受体阳性、HER2阴性进展期乳腺癌的疗效及安全性研究
2019-03-14张霖惠李惠平邵彬宋国红黄文发冉然刘笑然孔维垚
张霖惠,李惠平,邵彬,宋国红,黄文发,冉然,刘笑然,孔维垚
北京大学肿瘤医院暨北京市肿瘤防治研究所乳腺肿瘤内科,恶性肿瘤发病机制及转化研究教育部重点实验室,北京1001420
乳腺癌是一种女性常见的恶性肿瘤,对女性的健康造成了极大的威胁[1-2]。许多乳腺癌患者表现为激素受体(hormone receptor,HR)阳性,包括雌激素受体(estrogen receptor,ER)和孕激素受体(progesterone receptor,PR)阳性,而且可以从内分泌治疗中获益[3]。然而,大约25%的HR阳性患者对内分泌治疗产生原发性或继发性耐药[4]。依维莫司作为一个选择性雷帕霉素靶蛋白(mechanistic target of rapamycin kinase,MTOR)抑制药,联合内分泌治疗会延长HR阳性、人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阴性进展期乳腺癌患者的无进展生存期(progression-free survival,PFS)[5-7]。多项临床前研究表明,依维莫司可恢复肿瘤细胞对内分泌治疗的敏感性,且联合内分泌治疗时的作用更明显[8-10]。在临床工作中,有些患者经过多线化疗及内分泌治疗后一般状况仍然很好,且希望获得进一步治疗,依维莫司联合内分泌治疗为这些患者提供了继续治疗的可能性,但目前依维莫司在国内乳腺癌患者中的应用仍处于初期且缺乏临床经验。本研究回顾性分析41例HR阳性、HER2阴性、既往应用过内分泌治疗的进展期乳腺癌患者的临床资料,探讨依维莫司联合内分泌治疗的疗效及安全性,以为依维莫司的进一步临床应用提供参考。
1 资料与方法
1.1 一般资料
回顾性分析2013年8月至2018年4月在北京大学肿瘤医院乳腺肿瘤内科接受依维莫司治疗的41例HR阳性、HER2阴性进展期乳腺癌患者的病历资料。入组患者首次诊断乳腺癌年龄28~65岁,中位年龄45岁,均经病理检查证实为乳腺癌。其中2例为初治的晚期乳腺癌患者(1例为初发骨转移,1例为初发骨、肺转移),其他39例为术后转移患者(影像学检查均有可评估病灶),14例患者转移部位经穿刺病理证实为乳腺癌转移。原发灶或转移灶均经免疫组化证实HR阳性,免疫组化或荧光 原 位 杂 交(fluorescence in situ hybridization,FISH)检测提示HER2阴性或无扩增。患者使用依维莫司时美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体能状态评分为0~2分(表1)。
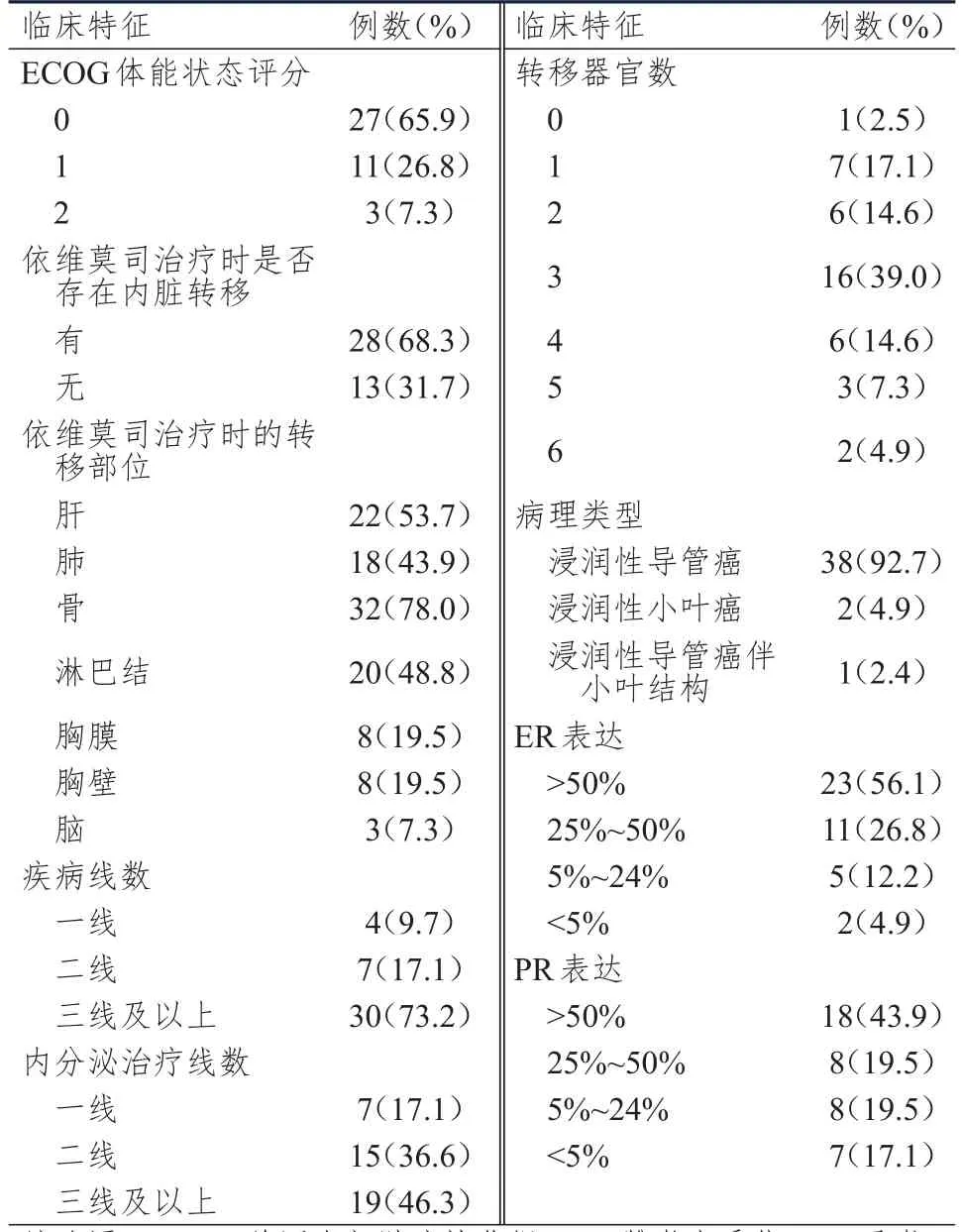
表1 HR阳性、HER2阴性进展期乳腺癌患者的临床特征(n=41)
1.2 既往治疗情况
在接受依维莫司治疗前,除2例患者外,余39例患者均接受过化疗,其中辅助化疗后进展3例,一线化疗后进展7例,二线化疗后进展10例,三线及以上化疗后进展19例。一线、二线、三线及以上内分泌治疗后进展的患者分别为7、15、19例。
1.3 依维莫司治疗方案的制定及调整
根据患者一般状况及经济条件,依维莫司的起始用量为10 mg qd 20例,7.5 mg qd 1例,5 mg qd 20例,根据患者不良反应程度及疗效评价结果进行加量(加量至10 mg qd 2例)或减量(减为5、10 mg qd交替2例,7.5 mg qd 1例,5 mg qd 9例,5 mg qod 3例)。联合用药:依西美坦(25 mg qd)16例,来曲唑(2.5 mg qd)12例,氟维司群(500 mg qm,第1周期第1天、第15天分别肌内注射500 mg,以后每周期第1天肌内注射500 mg)7例,托瑞米芬(60 mg qd)4例,阿那曲唑(1 mg qd)2例。
1.4 疗效及不良反应评价
患者接受依维莫司治疗前均进行影像学检查,治疗后每2~3个月行影像学检查评估,按照实体瘤疗效评价标准[11]进行疗效评价。客观缓解率(objective response rate,ORR)为经过治疗后完全缓解和部分缓解病例数占可评价病例数的比例;疾病控制率(disease control rate,DCR)为经过治疗后完全缓解、部分缓解及疾病稳定病例数占可评价病例数的比例;PFS定义为使用依维莫司治疗开始至第一次发生疾病进展或任何原因死亡的时间间隔;总生存期(overall survival,OS)定义为使用依维莫司治疗开始至死亡或末次随访之日的时间间隔。不良反应评估采用常见不良反应事件评价标准[12]进行评估,并根据不同级别不良反应给予相应治疗。
1.5 统计学方法
采用SPSS 25.0统计软件对数据进行统计学分析,计数资料以例数及率(%)表示;采用Kaplan-Meier法绘制生存曲线,运用Log-rank检验进行分析,以P<0.05为差异有统计学意义。
2 结果
2.1 疗效评价
41例患者使用依维莫司治疗的时间为0.1~23.0个月,其中9例患者因不良反应停药,2例患者因经济原因停药,30例患者可评估疗效(治疗时间≤1个月的患者均因不良反应停药,均未纳入疗效评估)。使用依维莫司治疗期间最佳疗效:4例(13.3%)患者部分缓解,16例(53.4%)患者疾病稳定,10例(33.3%)患者疾病进展,其中4例患者使用依维莫司时间超过12个月。ORR为13.3%(4/30),DCR 为 66.7%(20/30);中位无进展生存期(mPFS)为5.2个月(1.2~22.2个月),中位总生存期(mOS)为12.0个月(1.3~30.0个月)。(表2、图1、图2)
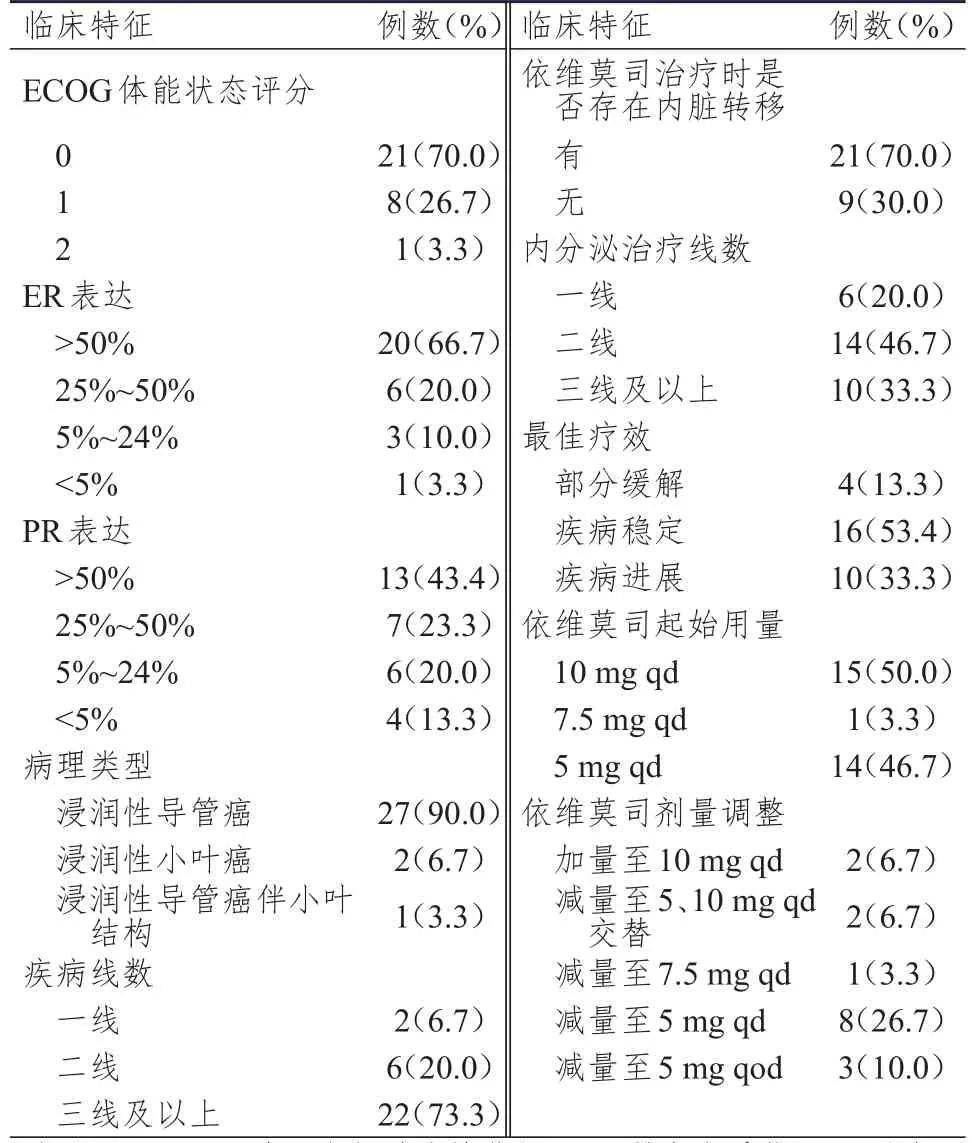
表2 可评估疗效患者的临床特征(n=30)
2.2 不良反应评价
2例患者因经济原因停药,故有39例患者可评估不良反应。最严重的不良反应为呼吸困难,共6例(15.4%),其中2例患者出现肺间质病变(经计算机体层摄影确诊),其中1例为严重的肺间质病变;皮疹8例(20.5%),其中2例为4级皮疹;骨髓抑制1例;几乎所有患者都有不同程度的口腔溃疡,2级以上病变者22例(56.4%),其中4例患者为4级口腔溃疡伴发热,其余患者口腔溃疡较轻。(表3)
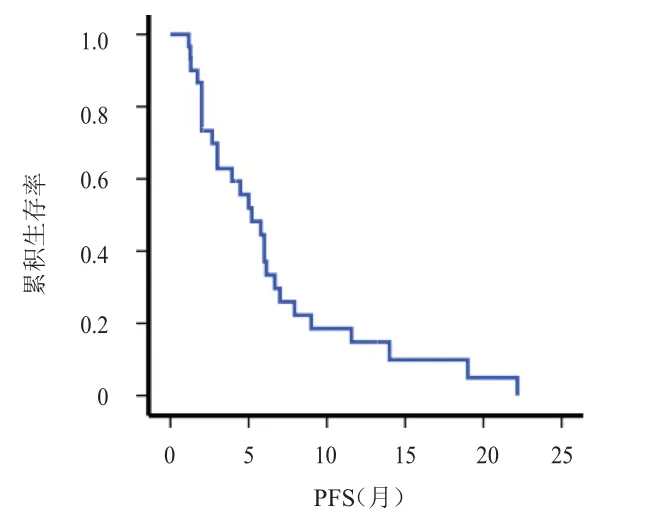
图1 30例可评估疗效患者的PFS曲线
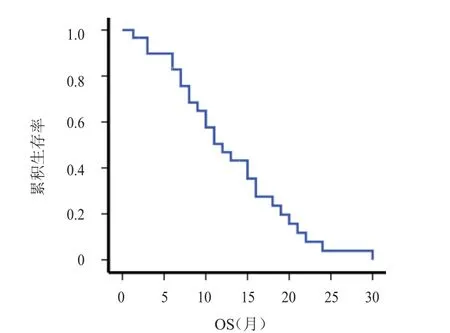
图2 30例可评估疗效患者的OS曲线

表3 依维莫司治疗后进展期乳腺癌患者的不良反应发生情况(n=39)
2.3 生存分析
2.3.1 不同ER、PR表达情况患者的PFS比较ER≤50%患者的 mPFS为 3.0个月(95%CI:0.4~5.6),短于 ER>50%患者的 6.0个月(95%CI:4.3~7.7),差异有统计学意义(χ2=4.178,P=0.041)(图3)。PR≤50%患者的mPFS为6.0个月(95%CI:2.6~9.4),与PR>50%患者的5.0个月(95%CI:3.5~6.5)比较,差异无统计学意义(χ2=0.096,P=0.756)(图4)。

图3 不同ER表达水平乳腺癌患者的PFS曲线
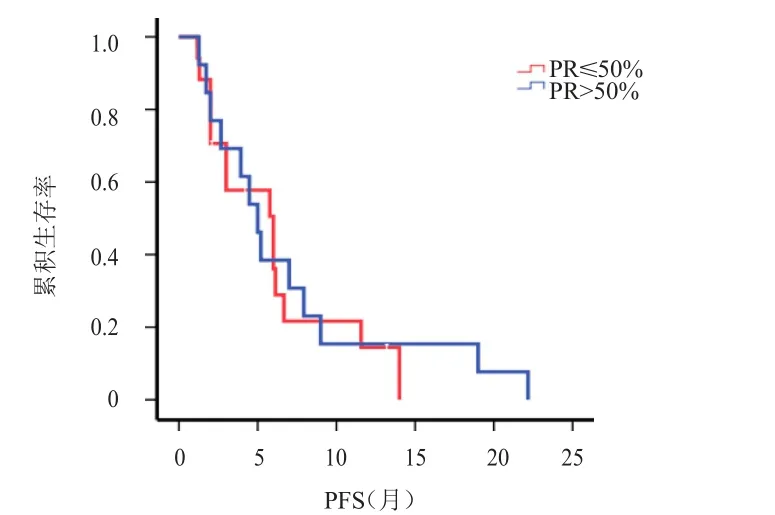
图4 不同PR表达水平乳腺癌患者的PFS曲线
2.3.2 开始治疗时有无内脏转移患者的PFS比较有内脏转移患者的mPFS为5.0个月(95%CI:2.0~8.0),与无内脏转移患者的5.2个月(95%CI:2.0~8.4)比较,差异无统计学意义(χ2=0.340,P=0.560)。(图 5)
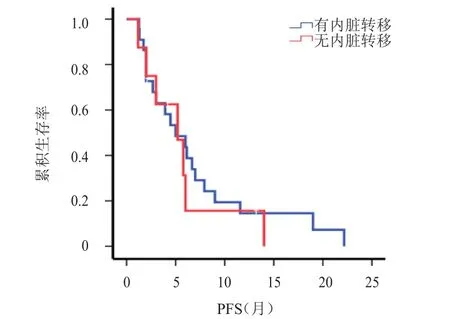
图5 开始治疗时有无内脏转移乳腺癌患者的PFS曲线
2.3.3 开始治疗时不同疾病线数患者的PFS比较疾病线数为一线、二线、三线及以上患者的mPFS分别为3.0、5.8、4.5个月,差异无统计学意义(χ2=1.017,P=0.600)。(图6)
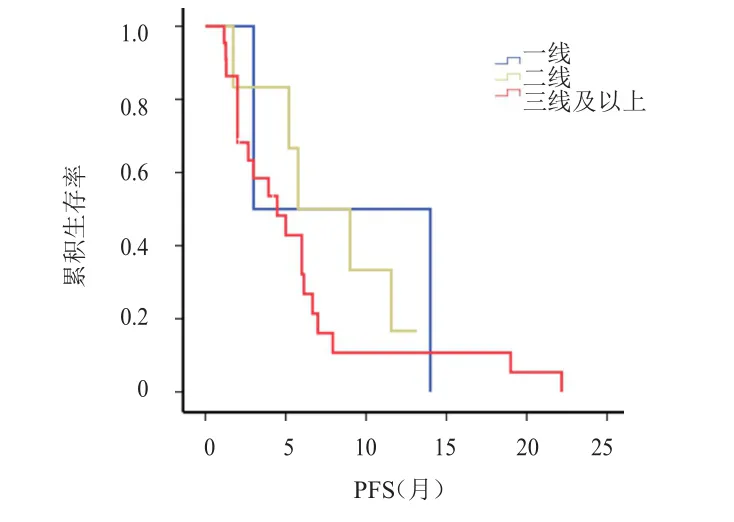
图6 开始治疗时不同疾病线数乳腺癌患者的PFS曲线
3 讨论
内分泌治疗是HR阳性进展期乳腺癌患者的基础治疗方案,绝经后乳腺癌患者推荐应用芳香化酶抑制剂,但不是所有患者对内分泌治疗均敏感(原发性耐药),还有一些患者开始使用敏感,在治疗过程中出现耐药(继发性耐药)[13-14]。疾病进展后,进一步内分泌治疗的选择包括其他种类的芳香化酶抑制剂(甾体或非甾体)、ER拮抗剂(氟维司群、他莫昔芬)、CDK4/6抑制剂、MTOR抑制剂,但是可选择的药物如何联合应用及最佳用药顺序很复杂,取决于不同因素,包括之前的辅助治疗、无病生存期、不良反应及患者的生活质量[15-18]。关于HR阳性的乳腺癌患者内分泌治疗耐药的研究致力于寻找新的治疗策略加强内分泌治疗的疗效。一个熟知的内分泌治疗耐药机制是PI3K/AKT/MTOR通路的异常激活,越来越多的证据证明MTOR通路与ER信号存在相互作用,S6激酶1是MTOR复合物1的一个亚基,它可以使ER的功能阈1磷酸化从而激活,而ER的功能阈1的激活导致了配体相关受体的激活,从而导致内分泌治疗的耐药[19]。依维莫司是一种雷帕霉素的衍生物,它通过与MTORC1变构结合抑制MTOR,从而恢复内分泌治疗的敏感性[20-21]。
在许多临床前的研究模型中,依维莫司联合芳香化酶抑制剂会同时抑制肿瘤细胞增殖和促进其凋亡[22]。而且一些临床试验也证实了依维莫司联合内分泌治疗可加强内分泌治疗的疗效且有可能克服耐药。一项Ⅱ期临床随机对照研究结果显示,在HR阳性、HER2阴性的乳腺癌患者的新辅助治疗中,来曲唑联合依维莫司较来曲唑联合安慰剂提高了临床缓解率,且明显降低Ki-67的表达水平[23]。Bachelot等[7]进行的一项Ⅱ期临床试验表明,在既往芳香化酶抑制剂耐药的晚期转移性乳腺癌患者中,依维莫司联合他莫昔芬较单用他莫昔芬可将意向治疗人群6个月的临床获益率提高至61%,死亡风险降低了55%,并将mPFS由4.5个月延长至8.6个月。在亚洲人的亚组分析中显示,依维莫司联合依西美坦在亚洲人和非亚洲人之间均有临床获益,没有种族差异[24]。国内回顾性研究也显示,HR阳性进展期乳腺癌患者可以从依维莫司联合内分泌治疗中获益[25]。最有力的证据是2012年的BOLERO-2研究,它是一项大型、多中心、随机对照、双盲Ⅲ期临床试验,研究结果表明在HR阳性、HER2阴性、既往使用非甾体芳香化酶抑制剂复发或进展的乳腺癌患者治疗过程中,依维莫司联合依西美坦可以明显改善PFS(中心分析显示试验组较对照组mPFS延长6.5个月),这一试验为内分泌治疗联合依维莫司治疗非甾体类芳香化酶抑制剂治疗失败的HR阳性晚期乳腺癌提供了循证医学证据[6,26]。
本研究mPFS较国际大型临床研究BOLERO-2的mPFS短(BOLERO-2研究的中心分析显示使用依维莫司联合依西美坦治疗组mPFS为10.6个月)[5],考虑与本研究入组患者数量较少(可评估疗效患者30例)、患者所处疾病线数较晚(三线及以上比例为73.2%)、依维莫司使用剂量为10 mg qd的患者较少(50.0%)、在治疗过程中因不良反应等原因依维莫司减量患者较多(46.7%)等因素有关;不良反应方面,本研究中依维莫司联合不同内分泌治疗药物出现相同的不良反应:口腔溃疡、皮疹、肺间质病变、呼吸道感染、代谢相关不良反应、血液系统不良反应,较国际临床大型研究相比不良反应发生率较高且较严重,考虑与入组患者存在内脏转移患者较多(BOLERO-2研究中56%患者有内脏转移,本研究68.3%患者有内脏转移)、既往接受多线化疗(BOLERO-2研究中68%患者既往接受过化疗,本研究所有患者既往均接受过化疗且接受过三线及以上化疗者占73.2%)等因素有关;不良反应处理方面,按照不良反应评估对不良反应进行分级后给予相关对症治疗,必要时调整依维莫司用量或停止使用依维莫司。进一步分析发现ER表达情况与依维莫司疗效可能存在一定关系,其原因考虑与依维莫司作用机制有关,但在本研究中可分析疗效的患者中ER≤50%患者仅有10例,ER>50%有20例,虽两组mPFS比较,差异有统计学意义,但因病例数有限且组间不平衡,该结论有待包含更多病例的大型临床研究来证实。
综上所述,经多线化疗和内分泌治疗后,依维莫司联合内分泌治疗对HR阳性、HER2阴性的进展期乳腺癌患者仍有一定疗效,但需密切监测患者不良反应。
