CD151对结肠癌细胞WNT信号通路的影响机制分析△
2019-03-14刘学刚刘艳彩吴春平李景光赵岭岭张振亚
刘学刚,刘艳彩,吴春平,李景光,赵岭岭,张振亚#
衡水市第四人民医院1普外科,2病理科,河北 衡水 0530000
结肠癌是目前最常见的恶性肿瘤之一,其发病率和病死率一直居高不下。多项研究均证明,在结肠癌的发生与发展中,WNT信号转导通路发挥了重要的作用[1-2]。WNT信号转导通路是由一系列癌基因和抑癌基因编码的蛋白质组成,在调节胚胎发育、细胞转运及细胞调亡等过程中发挥了显著作用[3]。肿瘤转移是导致结肠癌患者病死率较高的主要原因之一[4],研究表明,CD151在肿瘤的转移过程中发挥着重要的作用[5]。CD151属于4次跨膜结构超家族(transmembrane 4 superfamily,TM4SF)成员之一,是TM4SF中唯一的癌基因,能够促进细胞的运动,肿瘤的侵袭和转移,并且能够通过稳定新生血管的结构,为肿瘤的侵袭及转移提供必要条件[6]。然而目前CD151与WNT信号通路的关系少见报道。本实验通过比较裸鼠移植瘤中的人结肠癌细胞HT29、敲除CD151基因的HT29细胞(CD151--HT29)的β-catenin基因及蛋白的表达变化,探究CD151对结肠癌细胞WNT信号通路的影响机制。
1 材料与方法
1.1 主要试剂及细胞
RPMI1640培养基购自杭州四季青生物工程材料有限公司,胰蛋白酶购自上海源叶生物科技有限公司,二氨基联苯胺(diaminobenzidine,DAB)试剂盒购自北京索莱宝科技有限公司,荧光二抗购自广州华拓生物科技有限公司,β-catenin抗体以及β-actin抗体均购自美国Abcam公司。HT29细胞以及CD151--HT29细胞均购自上海信裕生物科技有限公司。
1.2 实验动物
20只BALB/c-nu/nu雄性裸鼠[购自上海斯莱克实验动物有限责任公司,SCXK(沪)2012-0002)],体重(22±2)g,在无菌环境中饲养,裸鼠所用饲料、饮用水、垫料均经过高压灭菌处理。
1.3 实验方法及观察指标
1.3.1 细胞培养 从-80℃冰箱中取出HT29和CD151--HT29细胞冻存管,放在37℃恒温水浴锅中快速解冻,将解冻好的细胞快速放入事先准备好的装有10 ml RPMI1640培养基的15 ml离心管中,离心去上清,重新加入5 ml新培养基,用吹打管小心吹打混匀细胞,转移至100 cm3的细胞培养瓶中,补足培养液,放入细胞培养箱中培养。待细胞培养瓶中的细胞长满至80%时,即可传代培养,用于后续实验。
1.3.2 荷瘤鼠模型的建立 将状态良好的裸鼠随机分为两组,每组10只,分别设为对照组及观察组,对照组裸鼠注入HT29细胞,观察组裸鼠注入CD151--HT29细胞。建模前需要将处于对数生长期的HT29、CD151--HT29细胞用胰蛋白酶消化,收集细胞,再用磷酸盐缓冲液(phosphate buffered saline,PBS)使细胞重新分散,细胞终浓度为1×107/ml。将准备好的细胞悬液注射入裸鼠腋下,一切操作在无菌环境下进行。1周后可明显观察到肿瘤形成,3周后处死裸鼠,取出肿瘤组织,放入-20℃冰箱中保存,备用。
1.3.3 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳和蛋白质印迹(Western blot)技术检测蛋白表达水平采用Western blot技术检测HT29、CD151--HT29细胞形成的肿瘤组织中CD151、β-catenin和β-actin蛋白表达情况。具体操作步骤如下:先制备分离胶、浓缩胶,待浓缩胶凝固后,竖直向上拔起齿梳;将计算好体积的蛋白样品通过移液枪转入至加样孔中,开始电泳,待电泳结束后,开始转膜,再与抗体发生免疫反应,最后放入至电化学发光(electrochemiluminescence,ECL)试剂盒中显色及显影。将胶片放入凝胶成像系统中拍照,用Quantity One图像分析软件分析目标条带的分子量和光密度值。
1.3.4 免疫组化技术检测蛋白表达情况 采用免疫组化技术检测肿瘤组织中Wnt1a蛋白、Oct4蛋白的表达情况。将离体不超过30 min的肿瘤组织置入4%的多聚甲醛中固定24 h,取固定后的肿瘤组织依次经30%、50%、70%、80%及90%的梯度乙醇脱水,每次30 min。再用二甲苯脱乙醇,20 min后放入石蜡中包埋。将制备好的肿瘤组织石蜡切片分别采用100%、95%及80%的乙醇进行脱蜡,放入3%H2O2溶液中孵育5~10 min,以灭活内源性过氧化物酶。使用蒸馏水冲洗,抗原修复,PBS冲洗3次,滴加一抗,室温孵育2 h,PBS冲洗3次,二抗孵育20 min后,再用PBS冲洗3次。DAB染色,染到适宜程度时,使用蒸馏水冲洗终止染色,苏木精染色1 min,1%盐酸乙醇浸泡30 s,1%氨水乙醇浸泡45 s,再分别用85%、90%及100%梯度乙醇各处理切片1 min,二甲苯透化2次。根据阳性细胞(以出现灰黄色、金黄色或棕黄色颗粒记为阳性细胞)所占比例及染色强度对切片共同评分,即采用双评分半定量法。根据阳性细胞所占比例,将切片划分为4个等级:<25%为1分,25%~49%为2分,50%~75%为3分,>75%为4分;根据切片的染色强度,将切片划分为4个等级:基本无色为0分,浅黄色为1分,黄色为2分,棕褐色为3分。将两种评分相加得最终总分,总分≤3分为阴性,总分>3分则为阳性。分别对肿瘤组织中的Wnt1a蛋白、Oct4蛋白的表达情况进行初步评估。
1.3.5 实时定量聚合酶链式反应技术检测基因表达情况 采用实时定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qRT-PCR)技术检测HT29、CD151--HT29细胞形成的肿瘤组织中β-catenin基因的表达情况。将取出的肿瘤组织匀浆,向其中加入1 ml的TRIzol试剂提取细胞总RNA,反复吹打使细胞从培养瓶壁上完全脱落。将培养瓶中剩余液体全部转移至EP管中,匀浆,离心取上清转移至新EP管中,向其中加入0.5 ml异丙醇,混匀后在室温下放置10 min,离心后可在EP管的底部和侧壁上观察到胶状沉淀,即为RNA,弃去上清,加入1 ml 75%乙醇对RNA沉淀进行漂洗后离心收集纯净的RNA,室温下干燥,放于-80℃下保存备用。每20 μl反转录体系中加入1 μl的RNA,振荡摇匀,短暂离心富集RNA,将EP管放入至自动PCR仪中检测基因表达情况。以βactin作为内参,β-actin上游引物序列为5'-TGACGTGGACATCCGCAAAG-3',下游引物序列为5'-CTGGAAGGTGGACAGCGAGG-3';β-catenin上游引物序列为5'-TTGAAAATCCAGCGTGGACA-3',下游引物序列为5'-TCGAGTCATTGCATACTGTC-3'。
最终采用2-△△Ct法计算目的基因的表达量。计算公式:△Ct=Ct目的基因-Ctβ-actin,△△Ct=△Ct观察组-△Ct对照组。2-△△Ct表示观察组目的基因的表达相对于对照组的变化倍数,当2-△△Ct>1时,表明观察组目的基因水平高于对照组,基因表达上调;当2-△△Ct=1时,表明观察组目的基因水平等于对照组,基因表达未发生改变;当2-△△Ct<1时,表明观察组目的基因水平低于对照组,基因表达下调。
1.4 统计学分析
采用SPSS 17.0统-计软件进行数据分析,计量资料以均数±标准差(x±s)表示,组间比较采用t检验,计数资料以率(%)表示,组间比较采用χ2检验;以P<0.05为差异有统计学意义。
2 结果
2.1 CD151、β-catenin和β-actin蛋白表达情况的比较
采用Western blot技术分别检测对照组和观察组裸鼠肿瘤组织中CD151、β-catenin和β-actin蛋白的表达情况,结果显示对照组裸鼠肿瘤组织中存在明显的CD151、β-catenin和β-actin蛋白的表达,而观察组裸鼠肿瘤组织中并不存在CD151蛋白的表达(图1),证明CD151-荷瘤鼠模型建立成功。在此基础上,对两组裸鼠肿瘤组织中的β-catenin相对表达量(与β-actin的比值)进行比较,结果显示,对照组β-catenin相对表达量为(0.18±0.02),与观察组的(0.13±0.01)比较,差异无统计学意义(P>0.05)。

图1 Western blot技术检测两组裸鼠肿瘤组织中CD151、β-catenin和β-actin蛋白的表达情况
2.2 Wnt1a、Oct4蛋白表达情况的比较
采用免疫组化法分别检测对照组和观察组裸鼠肿瘤组织中Wnt1a蛋白、Oct4蛋白的表达情况,结果显示观察组裸鼠的肿瘤组织中Wnt1a蛋白、Oct4蛋白表达量均低于对照组,差异均有统计学意义(P<0.05)。(图2、表1)
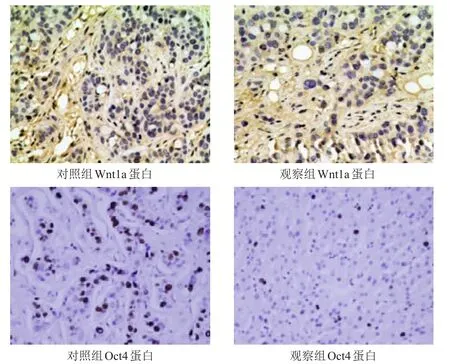
图2 免疫组化法检测两组裸鼠肿瘤组织中Wnt1a、Oct4蛋白表达情况(SP染色,×200)
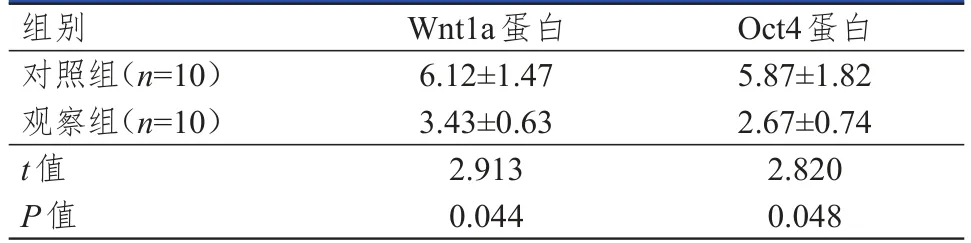
表1 两-组肿瘤组织中Wnt1a、Oct4蛋白表达情况的比较(x±s)
2.3 β-catenin mRNA相对表达量的比较
采用qRT-PCR技术检测对照组与观察组裸鼠肿瘤组织中β-cateninmRNA的表达情况,对照组β-cateninmRNA的表达量为(1.01±0.05),明显高于观察组的(0.43±0.04),差异有统计学意义(t=22.188,P<0.01)。
3 讨论
随着人类社会的发展和生活水平的不断提高,结肠癌的发病率也在逐年升高,目前临床上治疗结肠癌的主要手段为手术切除肿瘤部位,但是在患者手术前,肿瘤很可能已经发生转移,因此肿瘤无法得到根除并且复发率高[7-8]。目前,探究肿瘤的发生、发展以及转移机制已经成为治疗结肠癌的热点问题,如何抑制肿瘤的转移很可能会成为结肠癌治疗的下一个突破口。
众所周知,肿瘤的转移机制十分复杂,目前有研究表明,肿瘤的转移与肿瘤内部微血管的形成有关且与WNT信号通路密切相关[9-10]。WNT信号通路是由一系列癌基因以及抑癌基因编码表达的蛋白质组成,能够抑制β-catenin的降解,导致细胞质内的β-catenin增多,引起T细胞因子转录水平提高,促进多种靶基因激活,如原癌基因c-Jun、可异位基因c-myc和基质金属蛋白酶7(matrix metalloproteinase 7,MMP7)等,这些靶基因在肿瘤的生成、发展以及转移中发挥了重要作用[11-13]。而CD151蛋白能够促进肿瘤血管的生成,并且能够形成CD151-整合素复合体系统维持新生血管的稳定[14-15]。本实验结果发现,与对照组相比,观察组裸鼠肿瘤组织中β-catenin蛋白及mRNA表达均有下降,初步推测CD151可能是WNT信号通路的上游基因,对WNT信号通路相关蛋白表达有调控作用。本研究结果还表明,对照组裸鼠肿瘤组织中存在明显的CD151蛋白表达,而观察组肿瘤组织中并不存在CD151蛋白的表达,这一结果说明CD151基因缺失的结肠癌荷瘤鼠模型建立成功。采用Western blot技术检测β-catenin和β-actin蛋白的表达水平,发现观察组裸鼠肿瘤组织中的β-catenin相对表达量低于对照组,但差异无统计学意义,这可能与样本量较少有关。当WNT信号通路尚未被激活时,β-catenin蛋白能够维持细胞上皮的完整性,降低肿瘤转移成功率,一旦WNT信号通路被激活,β-catenin蛋白在细胞核中大量表达并发生集聚,从而失去维持细胞上皮完整性的功能,并且β-catenin蛋白能够促进血管内皮生长因子的表达[16-17]。本研究结果同样发现,对照组裸鼠肿瘤组织中Oct4蛋白表达量高于观察组。Oct4蛋白在维持干细胞的正常功能以及自我更新中发挥了重要的作用,也是WNT信号通路中的重要成员[18-19]。
肿瘤的发生、发展及转移之间的机制构成了一个复杂的网络体系。目前,WNT信号通路的作用机制及相互作用也并未全部诠释出来,本文从研究CD151与WNT信号通路之间关联的角度出发,以期能够揭示结肠癌的发生、发展过程,为临床上结肠癌的治疗寻找新的突破口。
