LINC00152通过调节VEGFR2的表达对血管瘤内皮细胞生长、增殖、迁移和侵袭的影响
2019-03-14马从乾王雅王娜杨柯陈德才
马从乾,王雅#,王娜,杨柯,陈德才
郑州大学附属南阳市中心医院1血管外科,2血液净化科,河南 南阳 4730000
血管瘤是一种常见的良性肿瘤,对于导致患者出现溃疡、功能障碍、瘢痕等并发症的血管瘤,必须给予早期干预治疗[1]。研究血管瘤内皮细胞(hemangioma endotheliar cell,HemEC)的增殖、凋亡等生物学行为的机制,可为研究血管瘤的发生、发展和退化奠定一定的基础[2]。血管内皮生长因子(vascular endothelial growth factor,VEGF)是一种高度特异性的促血管内皮细胞生长因子,具有促进血管形成、血管内皮细胞迁移及增殖等作用[3-4]。Ou等[5]发现血管内皮生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR2)在血管瘤组织中的表达水平高,且与血管瘤细胞的存活和凋亡密切相关。Teng等[6]研究发现,长链非编码RNA(long chain non-coding RNA,lncRNA)可抑制血管内皮细胞的凋亡并促进其迁移。LINC00152是一种lncRNA,结合诸多相关研究,筛选出与LINC00152结合的miRNA均可靶向抑制VEGFR2基因的表达[7-12],提示 LINC00152 与VEGFR2可能具有相关性。因此,本研究分析了LINC00152在不同时期血管瘤组织和癌旁正常皮肤组织中的表达情况,并探讨LINC00152对Hem-EC生长、增殖、迁移和侵袭的影响及具体作用机制,现报道如下。
1 材料与方法
1.1 病理组织收集
收集2010年10月至2016年10月于郑州大学附属南阳市中心医院保存的婴幼儿血管瘤患者的血管瘤组织标本。纳入标准:①均经术后病理诊断确诊为婴幼儿血管瘤;②术前均未行任何辅助性治疗。排除标准:①存在哮喘、严重先天性心脏病、低血糖等服药禁忌证;②合并严重肝、肾功能不全;③出生时合并新生儿窒息或新生儿缺血缺氧性脑病。根据纳入和排除标准,本研究共纳入27例婴幼儿血管瘤患者的血管瘤组织标本(血管瘤增生期组织标本15例,血管瘤退化期组织标本12例)。27例婴幼儿血管瘤患者中,男10例,女17例;年龄为1个月~2岁,平均年龄为(1.2±0.1)岁;依据Mulliken分类标准[13]:处于增生期血管瘤患者15例,处于退化期血管瘤患者12例;另选取相应的癌旁(距肿瘤边缘5 cm以上)正常皮肤组织标本27例作为对照。
1.2 试剂与仪器
Endothelial Basal Medium-2培养基购于上海华雅思创生物科技有限公司;二喹啉甲酸(bicinchoninic acid,BCA)蛋白含量检测试剂盒购于南京碧云天生物技术有限公司;Trizol试剂盒购于美国Promega公司;SYBR Green Gene Expression Assay购于日本TaKaRa公司;胰蛋白酶购于美国Gibco公司;CCK-8检测试剂盒购于日本Dojindo研究所;基质胶Matrigel购于美国BD Biosciences公司;MMLV反转录试剂盒购于北京索莱宝科技有限公司;荧光定量逆转录聚合酶链反应(quantitative reverse transcription polymerase chain reaction,qRTPCR)检测试剂盒购于上海生工生物工程有限公司;EdU增殖检测试剂盒购于广州锐博生物科技有限公司;Lipofectamine 2000转染试剂盒购于 美 国 Invitrogen 公 司 ;sh-LINC00152、pcDNALINC00152、miRNA-inhibitor、miRNA-mimic、pcDNA和siRNA Control均购于上海吉玛制药技术有限公司;miRNA-200c-5p agomir和miRNA-195-5p agomir购于广州锐博生物科技有限公司;细胞增殖和细胞凋亡免疫荧光试剂盒均购于广州复能基因有限公司。VEGFR2单抗、GAPDH单抗和辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗均购于美国Abcam公司。双荧光素酶报告基因试剂盒购于北京全式金生物技术有限公司;SKLB1002购于北京华夏远洋科技有限公司。
1.3 实验方法
1.3.1 qRT-PCR法检测组织中LINC00152的相对表达量 采用qRT-PCR法检测LINC00152的相对表达量。严格按照Trizol试剂盒说明书的步骤提取血管瘤增生期组织、血管瘤退化期组织和癌旁正常皮肤组织中的总RNA。采用M-MLV反转录试剂盒合成cDNA,以cDNA为模板,采用SYBR Green Gene Expression Assay进行荧光定量PCR,20 μl反应体系(SYBR Green 10 μl,cDNA 2 μl,正向引物2 μl,反向引物2 μl,DEPC-H2O 4 μl)。反应条件:94℃预变性5 min,94℃变性30 s,60℃扩增30 s,72℃延伸20 s,共40个循环。以GAPDH为内参,应用相对定量 2-△△Ct法计算LINC00152的相对表达量。实验重复3次。
1.3.2 HemEC培养 参考李鹏等[14]的方法进行HemEC原代培养,使用含10%胎牛血清(fetal bovine serum,FBS)和双抗的Endothelial Basal Medium-2培养基对HemEC进行体外培养。在37℃、体积分数为5%CO2、饱和湿度条件下的细胞培养箱中进行培养。
1.3.3 HemEC转染及分组 取处于对数生长期的细胞用于后续转染实验,将转pcDNA-LINC00152的细胞分别记为OE-Linc1组和OE-Linc2组(分别扩增两个含有LINC00152序列的不同片段进行过表达),将转染pcDNA空载体的细胞记为OE-NC组,将转染sh-LINC00152的细胞分别记为sh-Linc1组和sh-Linc2组(分别采用两个不同LINC00152片段进行干扰),将转染sh-LINC00152对照的细胞记为sh-NC组,细胞转染严格按照Lipofectamine 2000转染试剂盒说明书的步骤进行操作,经鉴定若转染效率大于90%,则用于后续实验。以过表达LINC00152(OE-Linc1组)的HemEC为基础,将细胞分为SKLB1002组(采用300 nmol/L SKLB1002处理)、miRNA-200c-5p组[采用400 nmol/L miRNA-200c-5p miRNA模拟物(agomir)处理]和miRNA-195-5p组(采用400 nmol/L miRNA-195-5p agomir处理),检测对各组细胞增殖、侵袭和迁移的影响。实验重复3次。
1.3.4 qRT-PCR检测转染后HemEC中LINC00152的相对表达量 HemEC转染48 h后,采用qRTPCR法检测HemEC中LINC00152的相对表达量,方法同1.3.1。
1.3.5 CCK-8法检测HemEC增殖能力 以CCK-8底物反应后的光密度测定细胞活力,即在待测的每孔细胞中加入10 μl CCK-8溶液,置于37℃下孵育2 h,在酶标仪450 nm处测定各孔细胞的吸光度值。以EdU免疫荧光强度测定细胞增殖,具体操作步骤参考EdU增殖检测使用说明书,制备EdU培养基,离心重悬并收集待测细胞,以加入1×Apollo染液500 μl避光染色10 min,磷酸盐缓冲液清洗后上流式细胞仪检测相对荧光强度,相对荧光强度越高表示增殖能力越强。
1.3.6 Transwell实验检测HemEC侵袭和迁移能力将Transwell上室滤膜经人工基底膜涂覆,置于培养箱中孵育2 h待用,将待检测的HemEC用胰蛋白酶消化,离心后采用无血清培养基重悬制成单细胞悬液,取出平衡后的Transwell小室,于下室加入含10%FBS的培养基600 μl,于上室加入细胞悬液200 μl,置于培养箱中培养48 h,取出小室,擦去上室细胞及细胞碎片,加入结晶紫溶液500 μl进行染色,清洗后,通过倒置显微镜观察并拍照,检测细胞的侵袭能力。检测细胞迁移能力时,Transwell上室滤膜未经人工基底膜涂覆,其余步骤同Transwell侵袭实验。
1.3.7 蛋白质印迹法(Western blot)检测细胞中VEGFR2的表达水平 收集转染后48 h各组Hem-EC,按照蛋白提取试剂盒说明书步骤提取细胞中蛋白,采用蛋白质定量检测(BradfordProteinAssay,BAC)法定量检测提取的蛋白浓度。采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)分离蛋白,将凝胶蛋白低温下转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,以5%脱脂奶粉室温封闭60 min,分别加入一抗VEGFR2(1∶800稀释),4 ℃孵育过夜,再加入1∶1000稀释的二抗,室温反应2 h。以HRP催化电化学发光(electrochemiluminescence,ECL)进行检测,应用Image J软件进行灰度分析,以GAPDH作为内参蛋白,计算细胞中VEGFR2蛋白的表达水平。
1.3.8 双荧光素酶报告基因实验 通过生物信息学在线数据库TargetScan预测发现LINC00152与miRNA-200c-5p和miRNA-195-5p存在靶向结合位点,分别扩增 LINC00152与 miRNA-200c-5p和miRNA-195-5p结合位点序列,分别构建到报告基因载体上,记为Linc-WT报告质粒,同时将LINC00152与miRNA-200c-5p和miRNA-195-5p结合位点紊乱序列构建到报告基因载体上,记为Linc-MUT报告质粒,按照双荧光素酶报告基因试剂盒说明书的步骤进行操作,在细胞转染48 h后收集细胞,加入细胞裂解液裂解细胞10 min,离心后取上清,加入50 μl荧光素酶检测试剂,振荡混匀10 min,分别测定双荧光素酶活性,根据荧光强度计算各组织细胞的相对荧光素酶活性。
1.4 统计学分析
采用SPSS 21.0软件对-数据进行统计分析,计量资料以均数±标准差(x±s)表示,两组间比较采用独立样本t检验或SNK-q检验,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。体外实验中,每个实验组设置3个生物学重复,每个生物学重复设置2个技术重复,每组数据代表6个独立数据。
2 结果
2.1 LINC00152在不同组织中的相对表达情况
qRT-PCR检测结果显示,LINC00152在血管瘤增生期组织和血管瘤退化期组织中的相对表达量分别为(1.91±0.28)、(3.20±0.66),均明显高于癌旁正常皮肤组织的(1.00±0.17),差异均有统计学意义(t=2.614、6.344,P<0.01)。LINC00152在血管瘤退化期组织中的相对表达量明显高于血管瘤增生期组织,差异有统计学意义(t=3.729,P<0.01)。
2.2 转染后细胞中LINC00152的相对表达量
NC组、sh-NC组和OE-NC组细胞中LINC00152的相对表达量比较,差异无统计学意义(P>0.05)。与sh-NC组相比,sh-Linc1组和sh-Linc2组细胞中LINC00152的相对表达量均降低,差异均有统计学意义(t=2.572、2.912,P<0.05)。与OE-NC组相比,OE-Linc1组和OE-Linc2组细胞中LINC00152的相对表达量均明显升高,差异均有统计学意义(t=7.619、6.648,P<0.01)。(图1)

图1 转染后细胞中LINC00152的相对表达量
2.3 过表达或敲低LINC00152对细胞增殖能力的影响
EdU细胞增殖检测结果显示,敲低LINC00152后,NC组、sh-NC组、sh-Linc1组和sh-Linc2组的相对荧光强度分别为(1.00±0.16)、(0.94±0.14)、(0.60±0.11)、(0.56±0.10)。NC组和sh-NC组的相对荧光强度比较,差异无统计学意义(P>0.05)。sh-Linc1组和sh-Linc2组的相对荧光强度均明显低于NC组,差异均有统计学意义(t=3.823、P=0.005;t=4.197、P=0.003)。过表达LINC00152后,NC组、OE-NC组、OE-Linc1组和OE-Linc2组的相对荧光强度分别为(1.00±0.16)、(0.95±0.16)、(1.68±0.25)、(1.63±0.24)。NC组和OE-NC组的相对荧光强度比较,差异无统计学意义(P>0.05)。OELinc1组和OE-Linc2组的相对荧光强度比较,差异无统计学意义(P>0.05)。
2.4 过表达或敲低LINC00152对细胞侵袭和迁移能力的影响
NC组、OE-NC组和sh-NC组细胞的侵袭比例和细胞迁移比例比较,差异均无统计学意义(P>0.05)。OE-Linc1组和OE-Linc2组细胞的侵袭比例均明显高于OE-NC组,差异均有统计学意义(t=3.573、3.736,P<0.01);OE-Linc1组和OE-Linc2组细胞的迁移比例均明显高于OE-NC组,差异均有统计学意义(t=4.067、3.742,P<0.01)。(图2)
2.5 LINC00152与miRNA-200c-5p、miRNA-195-5p间的相互作用
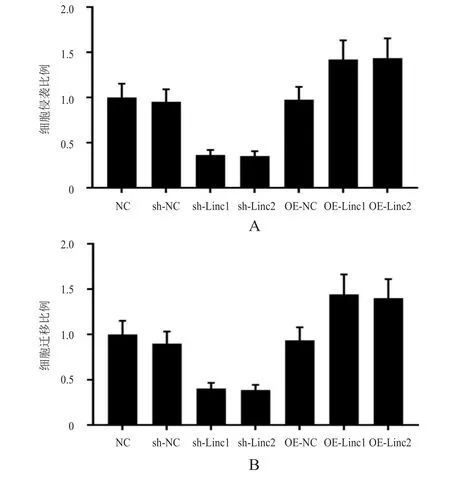
图2 过表达或敲低LINC00152对血管内皮细胞侵袭和迁移能力的影响
通过数据库预测LINC00152靶向结合位点,LINC00152能够与miRNA-200c-5p和miRNA-195-5p靶向结合(图3)。双荧光素酶报告基因实验结果显示,Linc-WT报告质粒组中miRNA-200c-5p mimic-NC、miRNA-200c-5p mimic、miRNA-195-5p mimic-NC、miRNA-195-5p mimic的相对荧光强度分别为(1.00±0.15)、(0.20±0.03)、(1.00±0.15)、(0.25±0.04),与mimic-NC相比,miRNA-200c-5p或miRNA-195-5p mimic共转染可明显降低报告质粒表达的荧光素酶活性(P<0.01),而报告质粒Linc-MUT中 miRNA-200c-5p mimic-NC、miRNA-200c-5p mimic、miRNA-195-5p mimic-NC、miRNA-195-5p mimic的相对荧光强度分别为(1.00±0.15)、(1.05±0.15)、(1.00±0.15)、(0.96±0.14);与mimic-NC相比,miRNA-200c-5p或miRNA-195-5p mimic共转染后荧光强度无明显变化。

图3 LINC00152与miRNA-200c-5p和miRNA-195-5p间结合位点预测结果示意图
2.6 过表达或敲低LINC00152对VEGFR2表达的影响
VEGFR2mRNA在正常组织、血管瘤增生期组织和退化期组织中的相对表达量分别为(1.00±0.16)、(1.30±0.19)、(1.13±0.17)。与癌旁正常皮肤组织相比,血管瘤增生期组织中VEGFR2mRNA的表达水平明显升高,差异有统计学意义(P<0.01);与血管瘤增生期组织相比,血管瘤退化期组织中VEGFR2mRNA的表达水平降低,差异有统计学意义(P<0.05)。
qRT-PCR检测结果显示,与NC组相比,OE-NC和sh-NC组细胞中VEGFR2 mRNA和蛋白的表达水平比较,差异均无统计学意义(P>0.05)。与OE-NC组相比,OE-Linc1组和OE-Linc2组细胞中VEGFR2 mRNA和蛋白的表达水平均升高,差异均有统计学意义(P<0.05)。与sh-NC组相比,sh-Linc1组和sh-Linc2组细胞中VEGFR2 mRNA和蛋白的表达水平均降低,差异均有统计学意义(P<0.05)。(表1)

表1 敲低或过表达LINC00152后Hem-EC中VEGFR2 mRNA和蛋白表达水平的比较(x±s)
OE-Linc1中,与mimic NC组相比,miRNA-200c-5p组、OE-Linc1 miRNA-16-5p组和OE-Linc1 miRNA-195-5p组细胞中VEGFR2蛋白的表达水平均明显降低(t=4.672、4.964、4.745,P<0.01)。sh-Linc2中,与inhibitor NC组相比,miRNA-200c-5p组、sh-Linc2 miRNA-16-5p组和sh-Linc2 miRNA-195-5p组细胞中VEGFR2蛋白的表达水平均明显升高(t=4.375、3.914、3.799,P<0.01)。(图4)
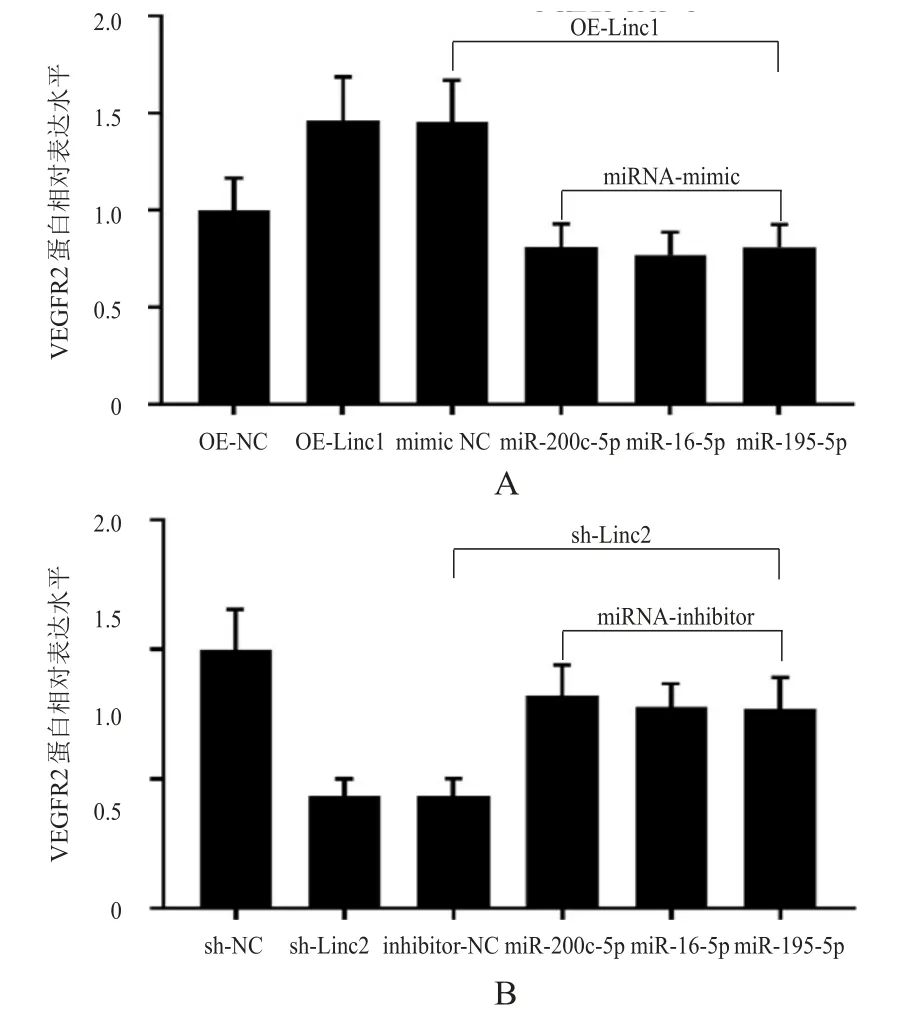
图4 LINC00152与miRNA-200c-5p、miRNA-195-5p和miRNA-16-5p间的相互作用
2.7 LINC00152通过VEGFR2促进HemEC的活性
与NC组相比,miRNA-200c-5p组、miRNA-195-5p组和SKLB1002组细胞在72 h时的光密度值均降低,差异均有统计学意义(t=4.430、3.563、5.874,P<0.05)。(图5)

图5 不同组别HemEC细胞的光密度值
2.8 LINC00152通过VEGFR2影响HemEC的侵袭和迁移
与NC组相比,miRNA-200c-5p组、miRNA-195-5p组和SKLB1002组HemEC在体外的迁移能力均明显降低,差异均有统计学意义(t=3.939、3.589、5.558,P<0.01);与 NC 组相比,miRNA-200c-5p组、miRNA-195-5p组和SKLB1002组Hem-EC在体外的侵袭能力均明显降低,差异均有统计学意义(t=4.736、4.208、5.894,P<0.01)。(表2)
表2 不同组别HemEC在体外侵袭和迁移能力的比较(±s)

表2 不同组别HemEC在体外侵袭和迁移能力的比较(±s)
注:*与NC组比较,P<0.01
组别NC组miRNA-200c-5p组miRNA-195-5p组SKLB1002组细胞迁移1.00±0.17 0.62±0.11*0.65±0.11*0.46±0.06*细胞侵袭1.00±0.16 0.59±0.09*0.63±0.10*0.49±0.07*
3 讨论
血管瘤常发生于婴幼儿的头颈部皮肤及皮下组织,大部分血管瘤可自行消退,但是大面积的血管瘤消退后可后遗浅瘢痕、局部色素沉淀、皮肤萎缩下垂等体征。血管瘤的病理学特点是HemEC增殖活跃,并伴有血管生成和肥大细胞的聚集。VEGFR2是蛋白酪氨酸激酶家族成员之一,具有蛋白酪氨酸激酶(protein tyrosine kinase,PTK)结构域,可与VEGF结合激活PTK的活性,通过磷酸化下游分子激活相关信号通路,调控细胞增殖、侵袭和迁移等生物学行为[15]。在胃癌细胞中,VEGFR2可促进胃癌细胞的增殖和转移[16]。通过细胞转染siRNA在肺癌细胞Calu-1中敲低VEGFR2的表达,发现肺癌细胞的增殖、侵袭和迁移能力明显受到抑制;此外,下调VEGFR2的表达还可提高放射后肺癌细胞的凋亡率[17]。研究表明,血管瘤细胞可以自分泌的形式分泌VEGF-A并激活自身的VEGFR2,导致细胞的存活、增殖和迁移能力提高[18]。本研究结果显示,LINC00152在血管瘤增生期组织和血管瘤退化期组织中的相对表达量均明显高于癌旁正常皮肤组织(P<0.01),提示VEGFR2可能促进血管瘤的生长。
最近的研究指出lincRNA可调控多种肿瘤的发生和发展过程。Zhao等[19]发现lncRNA SNHG16可通过竞争性结合miRNA-520d-3p降低后者对STAT3基因表达的靶向抑制能力,提高HemEC的增殖、迁移和侵袭能力。此前Liu等[20]通过微阵列比较了新生儿血管瘤病理组织和癌旁组织中mRNA及lncRNA的差异表达情况,发现FENDRR、MEG3、MEG8、LINC00152和H19等lncRNA在血管瘤中的表达量均升高。此外有研究表明,LINC00152可促进多种肿瘤的进展[21-22]。本实验结果显示,LINC00152敲低可抑制HemEC的生长、增殖、迁移和侵袭,促进HemEC的凋亡,过表达LINC00152则促进HemEC的生长、增殖、迁移和侵袭,正常肿瘤细胞体外培养的凋亡率为5%,过表达LINC00152细胞的凋亡率降低不明显,因此本实验未展示此组数据。通过LINC00152在血管瘤组织中的表达情况可知,LINC00152可促进血管瘤细胞的增殖、侵袭和转移,与上述报道相符。
LINC00152被鉴定为涉及多种恶性肿瘤的癌基因,例如胃癌、肝细胞癌、结肠癌、胆囊癌和肾细胞癌。LINC00152促癌的机制多为其作为竞争性内源RNA与特定的miRNA相结合,解除miRNA对相关原癌和促癌基因表达的抑制作用[23-24]。Chen等[25]首次报道了LINC00152与miRNA-16-5p间的相互作用,结果发现,LINC00152可通过竞争性结合miRNA-16-5p促进神经胶质瘤细胞的增殖、迁移和侵袭。本研究结合Li等[7]的研究,并通过数据库靶点预测,筛选出LINC00152与miRNA-200c-5p、miRNA-195-5p和miRNA-16-5p结合的作用靶点,其中,已有LINC00152与miRNA16-5p相结合的相关报道,本实验不再重复验证,而是通过双荧光素酶报告基因实验验证了LINC00152与miRNA-200c-5p、miRNA-195-5p相互结合的作用。敲低或过表达LINC00152可影响miRNA的表达,miRNA过表达对LINC00152的表达也产生影响。此外,本实验检测了敲低或过表达LINC00152对VEGFR2转录水平和蛋白表达水平的影响。过表达miRNA-200c-5p或miRNA-195-5p能够回调由LINC00152过表达导致的VEGFR2表达量升高。以上结果表明,LINC00152可竞争性地与miRNA-200c-5p、miRNA-195-5p和miRNA-16-5p结合,提高VEGFR2的表达水平。本研究发现,抑制VEGFR2的表达可降低由过表达LINC00152诱导的细胞增殖、侵袭和迁移,促进细胞凋亡;miRNA-200c-5p和miRNA-195-5p对应的agomir处理模拟miRNA的过表达,同样可降低由过表达LINC00152诱导的细胞增殖、侵袭和迁移,促进细胞凋亡,说明LINC00152通过VEGFR2促进HemEC的存活、迁移和侵袭。
综述所述,LINC00152可提高 VEGFR2在HemEC中的表达水平和转录活性,促进HemEC的生长、增殖、迁移和侵袭,其作用机制可能与LINC00152与 miRNA-200c-5p、miRNA-195-5p和miRNA-16-5p间的结合导致VEGFR2表达水平升高有关,证明了LINC00152促进血管瘤发生、发展的效果,抑制LINC00152的表达可能对血管瘤或其他肿瘤的治疗具有潜在的意义,为LINC00152可能作为血管瘤的诊断和预后生物标志物提供一定的理论基础。
