P21基因过表达对甲状腺癌细胞增殖和凋亡的影响及其作用机制
2019-03-14翟健胡万宁李军石福民
翟健,胡万宁,李军,石福民
唐山市人民医院头颈外科,河北 唐山 0630010
甲状腺癌是内分泌系统较为常见的一种恶性肿瘤,其发病率逐年增加,约占全身恶性肿瘤的3%,约占头颈部恶性肿瘤的5%[1]。据报道,全球甲状腺癌的发病率女性是男性的3.57倍[2]。目前,甲状腺癌的治疗手段主要包括手术治疗、内分泌治疗和131I治疗等,但治疗后易出现复发[3]。因此,寻找新的方法改善肿瘤的治疗和预后具有重要意义。肿瘤的发生是一个复杂的过程,受多种因素的影响,如癌基因和抑癌基因的异常表达等均可导致细胞的恶性增殖,严重威胁人类的生命健康。细胞周期蛋白依赖性激酶抑制剂1A(cyclindependent kinase inhibitor 1A,P21)可以抑制周期蛋白依赖性激酶的活性,对细胞周期发挥调控作用。相关研究表明,P21在细胞增殖过程中DNA的损伤、修复过程中发挥重要作用,P21过表达可以使细胞周期停滞在G1、G2或S期[4-5]。目前,关于P21在甲状腺癌中作用机制的研究相对较少,因此本研究通过过表达P21基因,探讨P21基因过表达对甲状腺癌细胞增殖、凋亡的影响及其作用机制,旨在为甲状腺癌的诊断、治疗及预后提供新的思路。
1 材料与方法
1.1 材料
人甲状腺癌细胞系SW579购自美国菌种保藏中心(American Type Culture Collection,ATCC)细胞库,胎牛血清(fetal calf serum,FBS)、L-15培养基、脂质体Lipofectamine 2000均购自美国Invitrogen公司,噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide,MTT)购自上海碧云天生物技术有限公司,膜联蛋白V(Annexin V)-异硫氰酸荧光素(FITC)/碘化丙锭(PI)细胞凋亡检测试剂盒购自上海翊圣生物科技有限公司,P21抗体购自美国BD公司,B细胞淋巴瘤/白血病-2(B cell lymphoma/leukemia-2,Bcl-2)抗体、Bcl-2相关X蛋白(B cell lymphoma/leukemia-2 associated X protein,BAX)抗体、细胞周期蛋白D1(cyclin D1)抗体均购自武汉博士德生物工程有限公司。
1.2 细胞培养
将SW579细胞冻存管迅速置于37℃水浴中,不停晃动使细胞尽快融化,800 r/min离心5 min,收集细胞,常规培养于含10%FBS和青链霉素的L-15培养基中,置于5%CO2、37℃饱和湿度的细胞培养箱中进行培养。采用0.25%胰蛋白酶消化细胞,按1∶3的比例每3~4天传代1次。
1.3 细胞转染
取生长状态良好的对数期SW579细胞,采用0.25%胰蛋白酶消化细胞,采用不含抗生素的L-15培养基重悬细胞,以2×105/孔细胞加入6孔板中,置于CO2孵箱中培养24 h,待细胞覆盖率为90%~95%时,将细胞分为对照组(未转染)、PCLneo-HK组(转染空载体PCLneo-HK)和PCLneo-P21组(转染真核过表达载体PCLneo-P21)。具体转染方法:将4 μg PCLneo-HK或PCLneo-P21质粒与10 μl Lipofectamine 2000混合液加入培养板中,在37℃培养箱中培养6 h,然后将培养基更换为含血清与双抗的培养基,采用蛋白质印迹法(Western blot)检测转染效果。
1.4 MTT法检测细胞增殖活力
取SW579细胞,调整细胞浓度至2×103/ml,将细胞接种于96孔板中,按照不同分组(对照组、PCLneo-HK组、PCLneo-P21组)分别处理后置于孵育箱中培养48 h,每孔加入20 μl 5 mg/ml MTT溶液,继续培养4 h后终止,小心弃去上清液,加入150 μl二甲基亚砜,振荡混匀10 min,使结晶物充分溶解,置于酶联免疫检测仪上检测各孔在490 nm处的光密度值(optical density,OD),每组织5个复孔,实验重复3次,处理组与对照组OD值的比值为细胞的增殖率。
1.5 流式细胞仪分析细胞的凋亡情况
取1×105个SW579细胞接种于6孔板上,按照不同分组(对照组、PCLneo-HK组、PCLneo-P21组)培养48 h后,采用胰蛋白酶消化,离心,收集细胞,磷酸盐缓冲液(phosphate buffer saline,PBS)清洗2次,采用1×binding buffer重悬细胞,在凋亡检测试剂说明书的指导下每孔加入5 μl Annexin V-FITC和5 μl PI,振荡混匀,常温避光反应10 min,置于流式细胞仪上检测细胞凋亡率。
1.6 Western blot检测细胞中 Bcl-2、BAX、cyclin D1蛋白的表达量
收集处理48 h后的对照组、PCLneo-HK组、PCLneo-P21组细胞,PBS清洗2次,加入细胞裂解液,12 000 r/min离心15 min,离心半径30 cm,保存于-80℃中,Bradford法检测蛋白浓度。取样本蛋白与1×蛋白上样缓冲液充分混合后,在100℃中变性5 min,将提前配置的10%的分离胶和5%的浓缩胶固定于蛋白电泳槽中,每孔加入30 μg蛋白样品,90 V电泳至染料前沿进入分离胶,将电压提高至110 V,待溴酚蓝到达分离胶的底端时,停止电泳。切去多余凝胶,在转移缓冲液中将蛋白凝胶转移至硝酸纤维素膜上,剪去多余部分,置于5~10 ml 5%脱脂牛奶封闭液中常温作用1 h,TBST缓冲液洗膜2次,加入脱脂牛奶稀释的一抗,4℃孵育过夜,TBST缓冲液室温下清洗3次,每次10 min,加入辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗,37℃持续振荡60 min,TBST缓冲液室温下清洗3次,每次10 min,滴加电化学发光显色试剂,暗箱中曝光,Image J软件观察蛋白的灰度值,目的蛋白的相对表达量=目的蛋白条带灰度值/内参蛋白条带灰度值。
1.7 统计学分析
采用SPSS 22.0统计软-件对数据进行分析。计量资料以均数±标准差(x±s)表示,两组间比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 P21蛋白表达水平的比较
PCLneo-HK组SW579细胞中P21蛋白的相对表达量与对照组比较,差异无统计学意义(P>0.05);PCLneo-P21组SW579细胞中P21蛋白的相对表达量明显高于对照组,差异有统计学意义(t=6.989,P<0.01)。(图1、表1)

图1 Western blot检测SW579细胞中P21蛋白的表达水平
表1 不同组别SW579细胞中P21蛋白的表达水平(±s)

表1 不同组别SW579细胞中P21蛋白的表达水平(±s)
组别对照组PCLneo-HK组PCLneo-P21组P21蛋白相对表达量0.335±0.052 0.417±0.063 0.733±0.089
2.2 沉默P21表达对细胞增殖率的影响
PCLneo-HK组SW579细胞的增殖率与对照组比较,差异无统计学意义(P>0.05);PCLneo-P21组SW579细胞的增殖率明显低于对照组,差异有统计学意义(t=4.596,P<0.01)。(表2)

表2 不同组别SW579细胞的增殖率(%,x-±s)
2.3 沉默P21表达对细胞凋亡能力的影响
PCLneo-HK组SW579细胞的凋亡率与对照组比较,差异无统计学意义(P>0.05);PCLneo-P21组SW579细胞的凋亡率明显高于对照组,差异有统计学意义(t=7.899,P<0.01)。(图2、表3)

图2 流式细胞仪检测SW579细胞的凋亡情况
表3 不同组别SW579细胞的凋亡率(%,±s)

表3 不同组别SW579细胞的凋亡率(%,±s)
组别 细胞凋亡率
2.4 沉默P21表达对细胞中Bcl-2、BAX、cyclin D1蛋白的影响
PCLneo-HK组SW579细胞中Bcl-2、BAX、cyclin D1蛋白的相对表达量与对照组比较,差异均无统计学意义(P>0.05);PCLneo-P21组SW579细胞中Bcl-2、cyclin D1蛋白的相对表达量均明显低于对照组,差异均有统计学意义(t=3.760、4.457,P<0.01);PCLneo-P21组SW579细胞中BAX蛋白的相对表达量明显高于对照组,差异有统计学意义(t=3.918,P<0.01)。(图3、表4)

图3 Western blot检测SW579细胞中Bcl-2、BAX、cyclin D1蛋白的表达情况
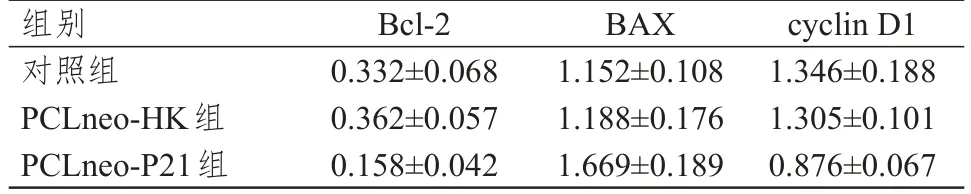
表4 不同组别SW5-79细胞中Bcl-2、BAX、cyclin D1蛋白的相对表达量(x±s)
3 讨论
基因的稳定性与细胞周期、细胞凋亡之间的相互作用,维持了细胞增殖的有序性,其中基因的稳定性对细胞的增殖调控起到根本作用[6]。G1/S和G2/M转换期是细胞周期中两个重要的时期,若G1/S和G2/M两个关键的转换期失控,则会导致本来应该终止增殖或凋亡的细胞重新进入细胞分裂过程,导致细胞恶性增殖,肿瘤进一步恶化[7]。P21是一个广谱的细胞周期依赖性激酶抑制剂和细胞周期的负调控因子,可通过阻碍细胞周期G1/S期的转化,从而抑制细胞的增殖及修复损伤的DNA或错误复制的DNA[8]。因此,通常情况下认为P21属于抑癌基因。相关研究表明,P21的表达水平与肿瘤的分化程度、浸润深度、临床分期、淋巴结转移有关[9];P21在甲状腺癌组织中的表达水平低于正常甲状腺组织[10]。本研究将过表达载体PCLneo-P21转染至人甲状腺癌细胞SW579中,结果显示PCLneo-P21组SW579细胞中P21蛋白的相对表达量明显高于对照组(P<0.01)。
细胞周期蛋白(cyclin)及其信号因子可以维持细胞增殖、分裂过程的有序性,对细胞周期的调控起重要作用[11]。cyclin D1是调控细胞周期的关键蛋白,其表达水平增加可以缩短细胞从G1期进入S期的时间,从而促进细胞的增殖[12]。相关研究表明,cyclin D1在甲状腺癌患者肿瘤组织中的阳性表达率明显高于癌旁正常组织,与甲状腺癌的预后密切相关[13]。Bcl-2、BAX是调控细胞凋亡的重要基因,已有研究指出,Bcl-2是抗凋亡因子,BAX是促凋亡因子,两者发生拮抗作用,共同调控肿瘤细胞的增殖、分化、侵袭、迁移等过程[14]。细胞内Bcl-2蛋白和BAX蛋白的表达水平及比例决定着细胞对凋亡因素的敏感性[15]。相关研究表明,甲状腺癌组织中Bcl-2、BAX蛋白的表达水平均明显增高,且均能够参与细胞凋亡相关过程[16]。本研究结果发现,PCLneo-P21组SW579细胞的增殖率明显低于对照组,凋亡率明显高于对照组(P<0.01),表明过表达P21基因可以抑制细胞增殖并促进其凋亡,但其作用机制尚不清楚,因此,本研究通过Western blot检测过表达P21基因的SW579细胞中凋亡调控相关的cyclin D1、Bcl-2、BAX蛋白的相对表达量,结果发现PCLneo-P21组SW579细胞中BAX蛋白的相对表达量较对照组明显增加(P<0.01),cyclin D1、Bcl-2蛋白的相对表达量较对照组明显降低(P<0.01),提示过表达P21基因可能是通过调控细胞周期蛋白和凋亡相关因子的表达来发挥作用。
综上所述,过表达P21基因可以抑制甲状腺癌细胞增殖,并促进细胞凋亡,其可能是通过阻止细胞周期的进程,进而抑制cyclin D1蛋白表达,下调Bcl-2蛋白表达,增加BAX蛋白表达水平来实现的。
