磁性Fe3O4纳米微球与H2O2类芬顿体系 催化氧化罗丹明B
2019-03-13王晓瑾李育珍孟亚楚
王晓瑾,李育珍,王 梅,李 震,孟亚楚
(1.太原理工大学 环境科学与工程学院,太原 030024;2.浙江工业大学 化学工程学院,浙江 杭州 310014)
随着当今社会的进步和人类文明的发展,世界各国对人类生存条件、健康状况和绿色清洁环境的关注度越来越高,且已认识到化工、印染、焦化、医药等工业废水对环境造成了不可逆转的伤害。研究人员采取了各式各样的方法来处理污染的水资源,其中高级芬顿氧化法因其操作简便、经济方便和处理效率高而被广泛应用于废水处理[1]。但传统芬顿法的pH值应用范围窄(pH=2~3),难回收且后续处理较为繁琐,类芬顿法则在一定程度上有效改善了这种状况[2]。
常被用来作类芬顿催化剂的铁基纳米颗粒有零价铁(Fe0)[3]、α-Fe2O3[4]、α-FeOOH[5]、Fe3O4[6]等。近年来,磁性Fe3O4纳米粒子由于尺寸小且可控、磁性强且易回收、表面光滑且面积较大、环保低毒且生物相容性高等优点,常与H2O2构成类芬顿体系,在Fe2+与H2O2的共同作用下产生催化活性较高的羟基自由基(·OH)来降解有机污染物[7-8]。CHEN et al[9]通过5种制备方法合成了具有相同立方反尖晶石结构和不同形貌(球形和碎砖形)的Fe3O4纳米粒子,其中S1(Fe3O4-op-DES)样品效果最佳,0.5 g/L S1样品在温度为55 ℃、pH值为6.4、H2O2用量为40 mmol/L时,可在2 h内去除97.8%的浓度为0.01 mmol/L的RhB.
本实验通过简单的溶剂热法制备出磁性Fe3O4纳米微球,并对其进行XRD和SEM表征。之后采用易操作的机械搅拌法研究了Fe3O4与H2O2类Fendon体系中影响RhB去除的因素。该方法操作简便,适用范围广,有助于在实际应用中大规模开展。
1 实验
1.1 实验试剂
本实验中所用水溶液均为蒸馏水,所用药品试剂均为分析纯,具体药品试剂有:三氯化铁(FeCl3·6H2O,天津市天力化学试剂有限公司),乙二醇(天津市进丰化工有限公司),无水乙酸钠(天津市大茂化学试剂厂),聚乙二醇1000(PEG1000,天津市光复精细化工研究所),无水乙醇(天津市致远化学试剂有限公司),过氧化氢(质量分数为30%,天津市科密欧化学试剂有限公司),罗丹明B(RhB,中国上海阿拉丁试剂有限公司),盐酸和氢氧化钠(天津市风船化学试剂有限公司)。
1.2 磁性Fe3O4纳米微球的制备及表征
根据李亚栋经典溶剂热法[10]制备磁性Fe3O4纳米微球,步骤如下:将2.7 g(10 mmol)FeCl3·6H2O加入80 mL乙二醇中,在磁力搅拌下形成澄清溶液,而后依次加入无水乙酸钠(7.2 g)和聚乙二醇1000(2.0 g),剧烈搅拌30 min后,将混合溶液密封于聚四氟乙烯不锈钢高压釜(容量为100 mL)中,之后放入烘箱,加热至200 ℃并保持8 h,冷却至室温后,用蒸馏水和无水乙醇各洗涤3次得到黑色产物。在60 ℃下真空干燥后,于4 ℃冰箱中保存。
采用DX2700B型X射线粉末衍射仪(XRD)对催化剂的结构性质进行测试,条件为:Cu Kα(λ=0.154 nm)靶,电压40 kV,电流30 mA,扫描范围10°~70°,步长0.06°,停留时间1 s,扫描速度为4(°)/min.采用日本SU8020型扫描电子显微镜(SEM)对催化剂的形貌进行表征。
1.3 单因素影响实验
本实验采用单因素法研究磁性Fe3O4纳米微球催化H2O2对RhB溶液的影响因素,即H2O2用量、Fe3O4粒子投加量、反应温度、pH值和RhB初始质量浓度。
以探究H2O2用量对去除RhB的影响为例,其实验步骤为:首先将0.3 g Fe3O4纳米粒子加入盛有250 mL 20 mg/L RhB溶液的三口烧瓶中,而后分别加入0(或1.00,2.00,3.00,3.25,3.50,3.75,4.00,4.50)mL H2O2(质量分数为30%)溶液,连续机械搅拌8 h后,停止搅拌。根据RhB溶液的标准工作曲线可获得其去除后的质量浓度,再根据式(1)即可获得RhB的去除率,根据式(2)可获得RhB的反应速率常数。
去除率R的公式如下:
(1)
反应速率常数k的公式如下:
(2)
式中:ρ0是RhB的初始质量浓度,mg/L;ρt是t时刻后RhB的质量浓度,mg/L.
在考察Fe3O4纳米粒子投加量对RhB去除率的影响时,投加量为0~2.0 g/L;在考察温度对RhB去除率的影响时,温度为20~60 ℃;在考察pH值对RhB去除率的影响时,pH值为3~11;在考察RhB初始质量浓度对RhB去除率的影响时,RhB初始质量浓度分别为5,10,20 mg/L.
2 结果与讨论
2.1 催化剂的表征
2.1.1 XRD分析
图1为所制备样品的XRD图谱。与标准卡片JCPDS(NO.65-3107)中的数据对比可知,未有其他杂峰,获得的是具有立方反尖晶石结构的纯相磁铁矿Fe3O4,其最高衍射峰为35.45°附近的(311)晶面的衍射峰,而且样品的衍射峰尖锐,信噪比较高,结晶度良好。

图1 磁性Fe3O4纳米微球的XRD图谱Fig.1 XRD patterns of magnetic Fe3O4 nanospheres
2.1.2 SEM分析
图2为所制备样品的SEM扫描图像。在图2(a)中随机选取200个粒子并测量其粒径(如图2(f)),经统计分析得出,样品的粒子直径多在150~600 nm之间,平均粒子直径约为420 nm.图2(c)、(d)和(e)表明Fe元素和O元素的EDS分布均匀,二者比例约为3∶4,表明制备的样品为Fe3O4.
2.2 实验结果
2.2.1 H2O2用量对RhB去除效果的影响
图3和图4分别显示了H2O2用量对8 h反应过程中RhB的去除率和反应速率的影响。由图3和图4可知,当H2O2用量为0 mmol/L时,反应8 h后的RhB去除率为13.70%,反应速率常数k仅为0.000 3 min-1,这可能是因为Fe3O4具有较大的比表面积,吸附了部分RhB溶液,但其比表面积一定,吸附的量一定,且吸附过程缓慢,8 h仍未达到吸附平衡。当加入H2O2后,两者发生催化反应,去除效率大大提高。当H2O2用量增为40 mmol/L时,RhB的去除率为58.97%,反应速率常数k为0.001 9 min-1;继续增加H2O2用量至140 mmol/L,RhB的去除率达到最大,为95.76%,反应速率常数k为0.006 6 min-1;之后再增加H2O2用量,RhB的去除率开始下降。这一结果说明,随着H2O2用量的增加,·OH的生成量增加,进而增加RhB的去除速率,但当H2O2用量过多时,它会消耗·OH产生氧化性较弱的HO2·,而HO2·既能与H2O2反应,阻止其生成·OH,又能与·OH反应,阻止其降解RhB[11]。因此,在利用Fe3O4与H2O2类Fenton体系催化氧化RhB时,H2O2的最佳用量为140 mmol/L.

图2 磁性Fe3O4纳米微球SEM及EDS分析Fig.2 SEM patterns of magnetic Fe3O4 nanospheres and EDS layered images of Fe and O elements; the EDS elements mapping; the particle diameter histogram
2.2.2 Fe3O4投加量对RhB去除效果的影响
图5和图6分别显示了Fe3O4投加量对8 h反应过程中RhB的去除率和反应速率的影响。由图5和图6可知,当Fe3O4投加量为0 g/L时,RhB的去除率为9.42%,反应速率常数k为0.000 2 min-1,说明H2O2单独作用虽然也能生成·OH降解RhB,但只是一小部分,效果缓慢。随着Fe3O4投加量的增加,RhB的去除率大幅度提高。当Fe3O4投加量增为0.4 g/L时,RhB的去除率为47.79%,反应速率常数k为0.001 4 min-1;继续增加Fe3O4投加量至1.2 g/L,RhB的去除率达到最大,为

图3 H2O2用量对RhB去除效果的影响Fig.3 Effect of the dosage of H2O2 on the remove of RhB

图4 H2O2用量对RhB反应速率的影响Fig.4 Effect of the dosage of H2O2 on the reaction rate of RhB
95.76%,反应速率常数k为0.006 6 min-1;之后再增加Fe3O4投加量,RhB的去除率开始下降。因此,在利用Fe3O4与H2O2类Fenton体系催化氧化RhB时, Fe3O4纳米粒子的最佳投加量为1.2 g/L.
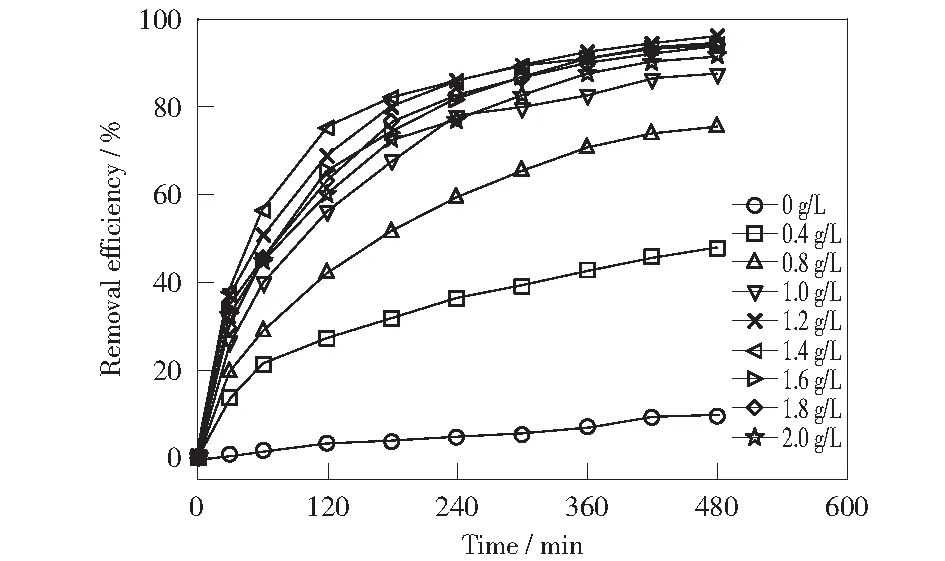
图5 Fe3O4投加量对RhB去除效果的影响Fig.5 Effect of the dosage of Fe3O4 on the remove

图6 Fe3O4投加量对RhB反应速率的影响Fig.6 Effect of the dosage of Fe3O4 on the reaction rate of RhB
2.2.3 温度对RhB去除效果的影响
图7和图8分别显示了温度对8 h反应过程中RhB的去除率和反应速率的影响。由图7和图8可知,当温度为20 ℃时,RhB的去除率为63.45%,反应速率常数k为0.002 1 min-1;当温度增加到30 ℃时,RhB的去除率显著增加,此时RhB的去除率达到最大,为95.76%,反应速率常数k为0.006 6 min-1;之后再增加反应温度,RhB的去除率开始下降,当温度增至60 ℃时,反应速率常数k为0.003 8 min-1.这一结果表明,在一定范围内,温度的升高有利于催化反应的进行,但温度过高时,会抑制催化反应。因此,可确定Fe3O4与H2O2类Fenton体系的最佳反应温度为30 ℃.
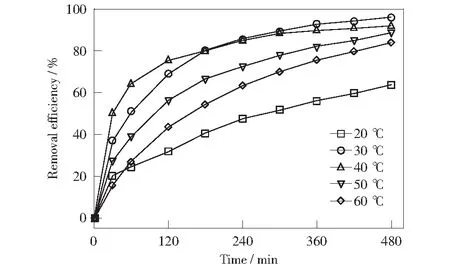
图7 温度对RhB去除效果的影响Fig.7 Effect of temperature on the remove of RhB

图8 温度对RhB反应速率的影响Fig.8 Effect of temperature on the reaction rate of RhB
2.2.4 反应体系pH值对RhB去除效果的影响
图9显示了反应体系pH值在8 h反应过程中对RhB去除率和反应速率的影响。可能是因为在RhB溶液中加入了Fe3O4,其初始反应体系的pH值为6.5~7.0.当调节pH值为5或4时,其去除率小幅度降低,说明在中性和弱酸性条件下,Fe3O4纳米微球颗粒具有较好的催化活性,相较于传统芬顿法而言,有效拓宽了芬顿反应的pH值范围;继续降低pH值为3时,反应效率显著增加,60 min后RhB几乎完全去除;而在pH值为9或11时,Fe3O4纳米颗粒的催化活性显著降低,这说明H2O2在碱性条件下很不稳定,易生成H2O和O2,再者,Fe2+和Fe3+易与OH-反应,从而降低反应效率[12]。因此,可确定Fe3O4与H2O2类Fenton体系的最佳反应pH值为3.

图9 pH值对RhB去除效果的影响Fig.9 Effect of pH values on the remove of RhB

图10 pH值对RhB反应速率的影响Fig.10 Effect of pH values on the reaction rate of RhB
2.2.5 RhB初始质量浓度对RhB去除效果的影响
为了探究RhB初始质量浓度对去除RhB的影响,在最佳反应条件下(即H2O2用量为140 mmol/L,Fe3O4纳米粒子投加量为1.2 g/L,温度为30 ℃,pH=3)进行了RhB初始质量浓度单因素影响实验。图11显示了RhB初始质量浓度在90 min反应过程中对RhB去除率的影响。由图11可知,随着RhB初始质量浓度的降低,其反应速率越来越快。当RhB的初始质量浓度分别为5,10,20 mg/L时,持续反应20,30,60 min后,RhB几乎完全去除。而刘焕联等[13]在最佳实验条件下,即Fe3O4纳米粒子投加量为2 g/L,n(H2O2)∶n(Fe3O4)=4∶1,pH=4时,3 h内能够完全移除5 mg/L RhB.

图11 RhB初始质量浓度对RhB去除效果的影响Fig.11 Effect of the initial concentration on the remove of RhB
2.3 降解机理分析
Fe3O4与H2O2类Fenton反应体系的机理示意图如图12所示,Fe3O4表面的Fe2+或Fe3+被H2O2氧化或还原生成氧化能力极强的·OH和氧化能力稍弱的·HO2来降解污染物RhB.
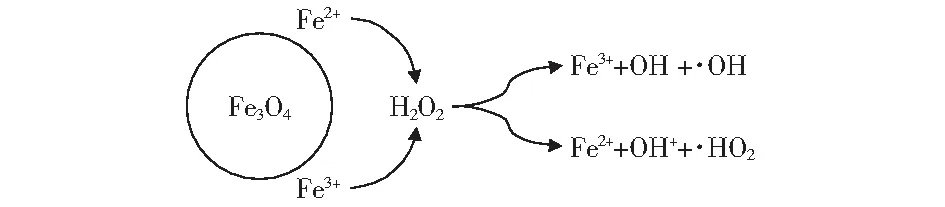
图12 Fe3O4与H2O2类Fenton体系机理示意图Fig.12 Mechanism diagram of the Fe3O4 and H2O2 Fenton-like system
3 结论
本文采用乙二醇溶剂热法制备出磁性Fe3O4纳米微球,经XRD测试表明制备的是纯相反尖晶石磁铁矿,经SEM测试表明制备的Fe3O4为均匀分布的微球状纳米颗粒。通过对磁性Fe3O4与H2O2类Fenton体系去除RhB的单因素影响实验研究可知,在30 ℃、强酸条件下(pH=3),H2O2用量为140 mmol/L,磁性Fe3O4纳米粒子投加量为1.2 g/L时,质量浓度分别为5,10,20 mg/L的RhB在反应20,30,60 min后几乎完全去除。这说明Fe3O4纳米微球颗粒对H2O2具有较好的催化活性,相较于传统芬顿法而言,有效拓宽了pH值应用范围,但它同时具有传统芬顿法的典型特点,即在强酸条件下具有极高的反应效率,而在碱性条件下,反应效率低下。
