小于1.0 cm的直肠类癌内镜治疗方法探讨
2019-03-13王亚丹郭春梅宿慧刘揆亮魏南刘红吴静
王亚丹,郭春梅,宿慧,刘揆亮,魏南,刘红,吴静
(首都医科大学附属北京世纪坛医院 消化内科,北京 100038)
直肠类癌是一种少见的低度恶性肿瘤,约占所有直肠肿瘤的1.80%,其中约15.00%的患者可能发生转移,因生长缓慢,早期常无特殊症状,临床上易漏诊或误诊[1-4]。该病变的组织学表现类似恶性肿瘤,但生物学行为更倾向于良性病变,故其治疗措施及预后明显不同于直肠腺癌[2-4]。有研究认为,不存在局部及远处转移的直肠类癌患者,局部完整切除即认为治 愈[4-5]。随着结肠镜检查治疗技术的进步,直肠类癌的内镜下治疗日趋成熟,主要治疗方法有内镜下黏膜切 除 术(endoscopic mucosal resection,EMR)、 内 镜下套扎切除术(endoscopic mucosal resection-ligation,EMR-L)和内镜黏膜下剥离术(endoscopic submucosal dissection,ESD),目前3种治疗方法的选择仍存在争议[6]。本研究通过对49例直肠类癌的内镜临床资料分析,探讨3种内镜治疗方法治疗直肠类癌的优缺点。
1 资料与方法
1.1 一般资料
2010年1月-2017年12月北京世纪坛医院共完成56 700例肠镜检查,发现直肠肿瘤412例,其中直肠类癌74例(<1.0 cm直肠类癌49例,≥1.0 cm直肠类癌25例),直肠癌338例,本研究纳入≤1.0 cm的直肠类癌49例。其中,男32例(65.31%),女17例(34.69%),平均(56.48±13.82)岁;临床症状为腹痛、腹泻、便秘和便血等,均无类癌综合征表现,15例伴有结肠息肉。直肠类癌病变平均大小为(5.96±1.01)mm,其中22例(44.90%)接受EMR术,20例(40.82%)接受EMR-L术,7例 (14.28%)接受ESD术。纳入标准:肠镜检查发现直肠病变,并行内镜下治疗(EMR、EMR-L或ESD),病理明确诊断为直肠类癌的全部患者。排除标准:发现病变未行内镜下治疗、病理资料不完整。
按照治疗方法不同分成3组(EMR组、EMR-L组和ESD组),以年龄、性别、病变大小、手术时间、助手人数、术后出血、穿孔、感染和完整切除率等为变量进行统计分析。其中22例接受EMR术,20例接受EMR-L术,7例接受ESD术。EMR术组中,男13例,女9例,平均(57.55±9.84)岁。EMR-L组中,男13 例,女7例,平均(54.26±12.30)岁。ESD术组中,男6例,女1例,平均(60.29±12.57)岁。3组性别构成和年龄比较,差异均无统计学意义(P>0.05)。见表1。
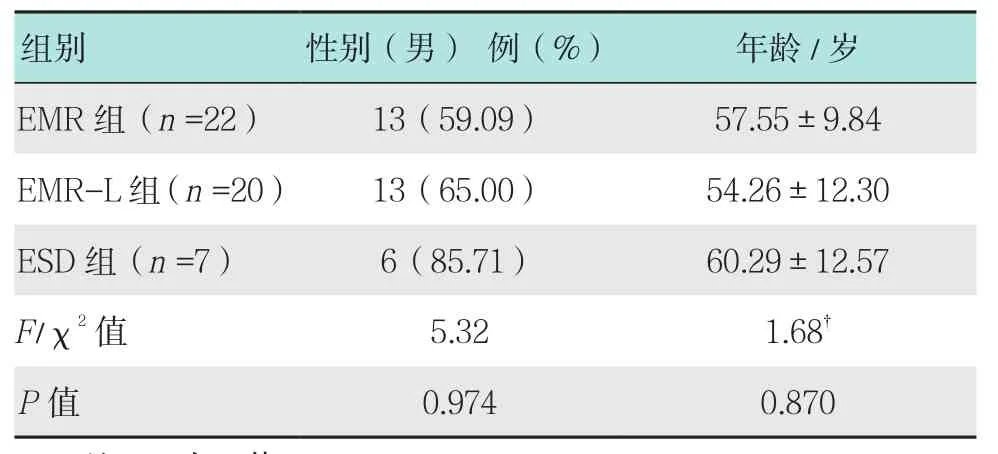
表1 3 组一般资料比较Fig.1 Comparison of general data among three groups
1.2 方法
1.2.1 术前情况 所有患者均由有经验的内镜医师进行全结肠镜检查及治疗,应用Olympus CV-260SL电子结肠镜(Olympus公司)。肠镜检查发现黏膜正常的直肠隆起性病灶后,对病灶进行超声扫描,观察病灶大小、外形、边界和内部回声强度,根据病灶和邻近正常肠壁的结构判断病灶所处的肠壁层次和起源,根据病灶所在肠壁的层次和回声强度判断其性质。根据普通肠镜检查和超声内镜检查结果,选择普通白光内镜观察病灶呈黄色或白色、起源于黏膜深层或黏膜下层、低回声或回声欠均匀、边界清晰、无固有肌层和血管浸润的小于1.0 cm的类癌患者,完善腹部CT检查排除肝转移、局灶转移等可能,行内镜下肿瘤切除。完整切除定义:内镜下切除标本侧切缘和基底切缘与肿瘤之间距离≥2 mm。
1.2.2 EMR术切除直肠类癌 肠镜下于肿瘤根部注射1∶10 000肾上腺素氯化钠注射液,使病变与肌层分开防止出血,再用圈套器圈套病变后用高频电将息肉电凝切除,残端清洁,创面视情况用钛夹夹闭。
1.2.3 EMR-L术切除直肠类癌 用透明帽对准病灶,吸引后释放橡皮圈套扎病灶,再用圈套器圈套病灶后高频电切除,残端清洁,创面视情况用钛夹夹闭。
1.2.4 ESD术切除直肠类癌 先于病灶基底部注射甘油果糖玻璃酸钠6∶1混合溶液,病灶及周围抬举好,即用Dual刀切开周围黏膜后,剥离黏膜下层,将病变完整切除。创面视情况用氩离子束凝固术(argon plasma coagulation,APC)处理或钛夹夹闭。
1.3 统计学方法
使用SPSS 17.0统计软件,符合正态分布的计量资料用均数±标准差(±s)描述,使用方差分析,计数资料用构成比及率描述,χ2检验或连续校正χ2检验进行统计学分析。以P<0.05具有统计学意义。
2 结果
2.1 3 组病变生物学特征及内镜表现
在本组数据中,类癌均位于直肠,距肛门5.0~15.0 cm,直径在1.0 cm以内,形态多为丘状或半球状隆起,表面被覆正常黏膜,呈黄色或白色,质地较硬,少数顶端发红、糜烂,易误诊。超声内镜观察,病灶呈低回声或不均匀回声,直径1.0 cm以内,起源于黏膜深层或黏膜下层,边界清楚,无固有肌层和血管浸润。3组病变生物学特征及内镜表现见图1~3。
2.2 3 组病变切除情况比较
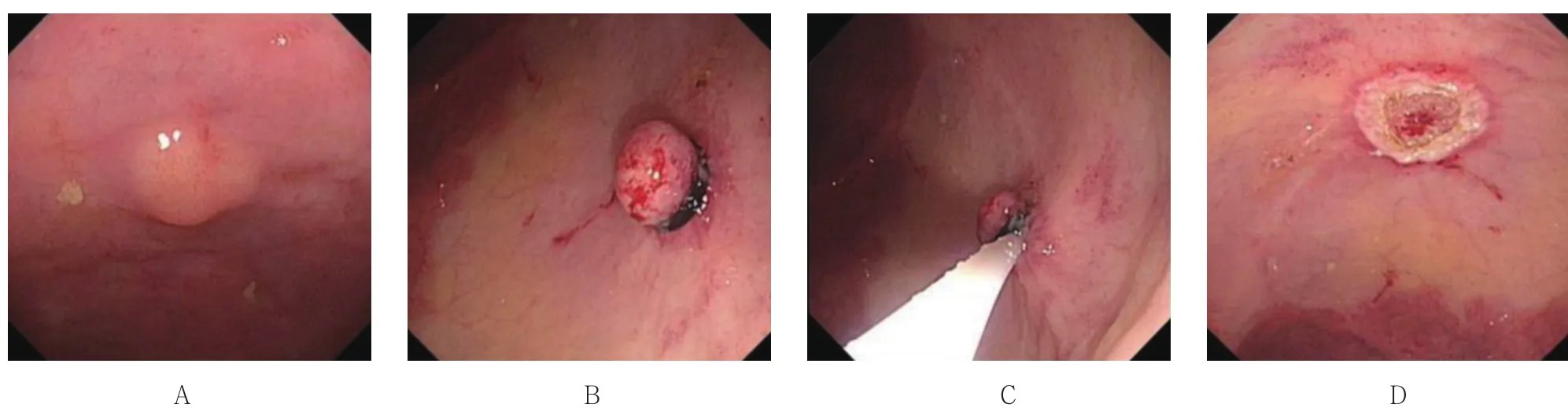
图1 EMR-L 术Fig.1 Endoscopic mucosal resection-ligation
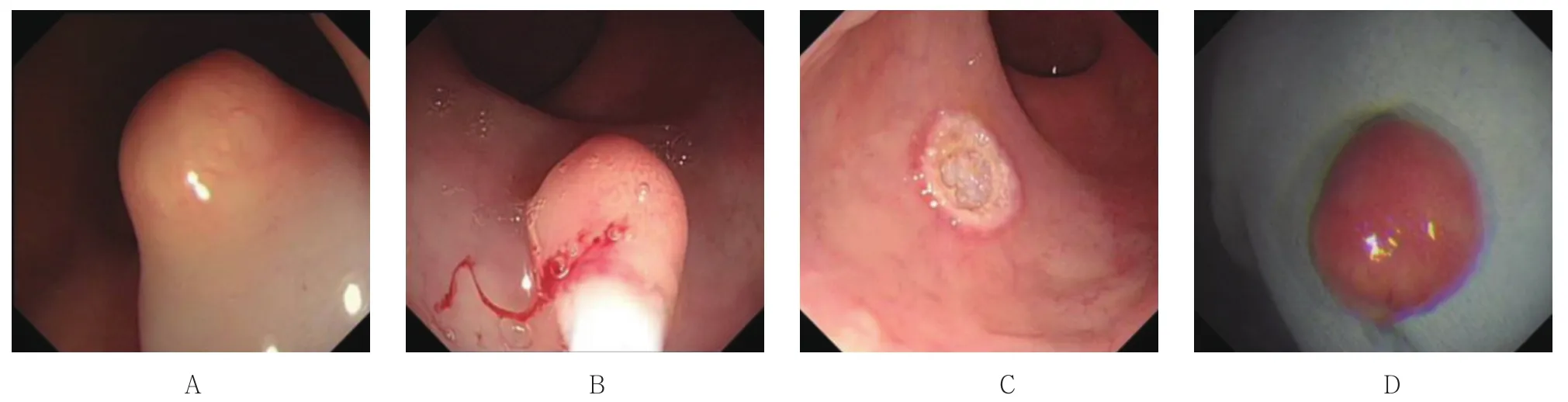
图2 EMR 术Fig.2 Endoscopic mucosal resection
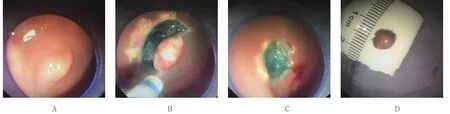
图3 ESD 术Fig.3 Endoscopic submucosal dissection
EMR术组中,病变平均大小(6.36±1.50)mm,起源于黏膜深层9例,黏膜下层13例,16例为完整切除,6例切除不完整,完整切除率72.73%,平均操作时间 1 min 38 s。EMR-L 组中,病变平均大小(5.95±1.08)mm,起源于黏膜深层6例,黏膜下层14例,完整切除率95.00%,1例紧邻切缘,平均操作时间 2 min 1 s。ESD 术组中,病变平均大小(6.86± 1.21)mm,起源于黏膜深层2例,黏膜下层5例,完整切除率100.00%,平均操作时间32 min 18 s。见表2。
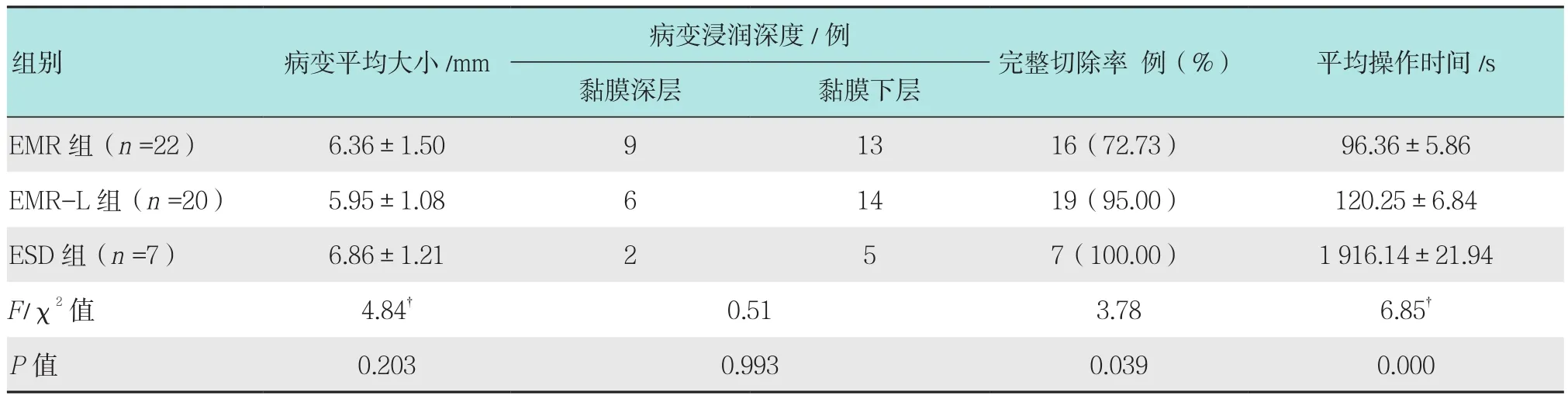
表2 3 组病变切除情况比较Fig.2 Comparison of excision lesions among three groups
2.3 3 组病理结果
本组患者的组织病理学检查结果证实均为典型的直肠类癌G1期,未见脉管瘤栓,无局部及远处转移,组织学上瘤细胞呈巢状、条索状。其中,EMR组6例患者病理回报示:肿瘤组织紧邻切缘和(或)基底,EMR-L组1例患者病理回报示:肿瘤组织紧邻切缘和(或)基底。以上情况判断为未完整切除,密切随访未发现复发、转移。
2.4 3 组并发症情况
直肠类癌内镜下治疗主要的并发症是出血、穿孔,EMR组共2例发生出血,均为术后即刻渗血,应用钛夹止血效果良好,无迟发性出血。EMR-L组1例发生术中穿孔,穿孔直径约0.5 cm,应用钛夹7枚缝合,因穿孔部位位于直肠下段,无腹膜炎症状及体征,术后恢复良好。
2.5 术后随访
术后患者规律复查肠镜,病变切除的残端形成光滑的瘢痕,目前无复发病例,最长者已随访6年。
3 讨论
西方国家研究发现,在所有神经内分泌肿瘤中,直肠类癌发病率约占12.60%,位于第3位,亚洲国家直肠类癌发病率更高[1-5]。一项日本研究发现,80.00%直肠类癌位于距肛门10.0 cm以内,平均发病年龄为55岁,肿瘤平均大小10 mm[7],本研究入组病例平均年龄56.48岁,与上述研究结果一致。直肠类癌组织结构似癌,但发展缓慢,多呈局部浸润性生长,很少发生转移,其恶性程度的判断主要取决于肿瘤的大小、表面情况、浸润深度和组织学分化程度,其中以肿瘤大小和是否侵入肌层最为重要[7-10]。有研究认为,以下是转移的危险因素:肿瘤大小>10 mm,表面有糜烂或溃疡,肌层浸润,低分化组织学表现,淋巴脉管浸润[9-10]。而内镜及超声内镜评估直肠类癌小于10 mm、局限于黏膜层或黏膜下层、无脉管淋巴转移,则提示病变发生转移的可能性较小,5年生存率可达98.90%~100.00%[6,11-12]。有研究认为,外科手术切除是治疗类癌的唯一有效方法,但是随着内镜治疗技术的不断提高,直肠类癌的内镜治疗已成为研究热点,对于发生转移可能性较小的直肠类癌,目前一般选择内镜下治疗[13-14]。内镜下治疗直肠类癌的优势是不言而喻的:操作相对简单、创伤小、术后处理简单、并发症少和保留肛门功能等。目前认为,75.00%的病变局限于黏膜下层,可行内镜下治疗,例如EMR术、EMR-L术和ESD术。然而,如果EMR术不能完整切除病变,需要再次内镜治疗时,因为纤维化等原因,EMR术完整切除病变存在困难,需行ESD术[12-14]。 而且有研究认为,ESD术治疗后可以显著降低病变复发率和转移率[11-14]。也有研究认为,EMR-L术相较于ESD术更为简单有效,且预后良好[15]。关于直肠类癌内镜治疗方法的选择仍存在争议。本研究共纳入49例直肠类癌,均行内镜下治疗,术后无复发及转移,预后良好。其中EMR组(完整切除率72.73%)、EMR-L组(完整切除率95.00%)内镜治疗术后分别有6和1例病变,病理回报示肿瘤组织紧邻切缘或(和)基底,判断为未完整切除,ESD组完整切除率为100.00%,3组之间比较,差异有统计学意义,ESD组和EMR-L组完整切除率比较,差异无统计学意义。ESD组手术时间较EMR和EMR-L组时间长(P<0.01),术后均无严重并发症。
综上所述,EMR-L治疗小于1.0 cm直肠类癌,操作相对于ESD术简单,完整切除率较EMR术高,且创伤小、术后处理简单、并发症少。小于1.0 cm直肠类癌男性多见,平均年龄56岁。尽管直肠类癌是一种潜在恶性肿瘤,但仍有复发、转移的可能,术后定期复查肠镜和腹部CT是最佳随访手段。
