食管黏膜下肿瘤的内镜下诊断与治疗
2019-03-13维妮热阿布都外力张志强高鸿亮姚萍
维妮热·阿布都外力,张志强,高鸿亮,姚萍
(新疆医科大学第一附属医院 消化科,新疆 乌鲁木齐 830054)
食管黏膜下肿瘤(submucosal tumors,SMTs)是一类以食管壁非上皮间叶组织为起源的肿瘤,在黏膜以下各层均可发生,其中多见于固有肌层及黏膜肌层,病理特征主要包括平滑肌瘤、血管瘤、脂肪瘤及间质瘤等[1]。约半数食管SMTs完全没有症状,体检或因其他疾病接受内镜检查时意外被发现。此类肿瘤内镜下表现极其相似,且普通内镜无法明确肿瘤起源及性质,又因表面覆有正常黏膜,常规穿刺活检不易获得肿瘤组织。近年来,随着超声内镜(endoscopic ultrasonography,EUS)的广泛应用,对病变性质及起源诊断的准确度明显提升,同时对SMTs的内镜下治疗起着指导作用。通常而言,直径<3.0 cm的食管SMTs被认为是良性肿瘤,故目前多建议对其进行定期随访,但长期随访给患者带来一定程度的精神和经济负担,并且随着瘤体的增大,压迫或浸润周围的组织器官或发生远处转移的可能性增加。因此,有必要对其进行早期诊断和治疗[2]。另外,还有一些肿瘤具有潜在的恶变可能(尤其是间质瘤),起源于固有肌层的食管SMTs恶变潜质尤为突出,故许多患者在诊断明确后要求手术治疗,但开胸手术及胸腔镜下治疗存在手术创伤性较大、手术并发症发生率高且术后住院时间较长等弊端[2]。内镜设备和内镜诊疗技术的持续发展,弥补了外科手术的不足之处,使内镜下诊治食管SMTs不断走向成熟。本文回顾性分析了经内镜下诊治的98例食管SMTs患者的病例资料。现报道如下:
1 资料与方法
1.1 一般资料
选择2012年1月-2017年12月我院消化科就诊并明确诊断为食管SMTs患者,共98例。其中,男43例(43.88%),女55例(56.12%),年龄15~74岁,平均51岁。所有患者中,93例患者既往无食管肿瘤家族史,余5例患者有食管肿瘤家族病史。74例患者诉不同程度的胃食管反流、咽部异物感、胸骨后不适和上腹部胀痛等症状,其中有胃食管反流症者最多,占出现症状者52.70%;另24例患者完全没有不适症状,通过常规体检被发现。食管SMTs位于食管下段者有43例,较食管中、上段多见,约占总数43.88%,食管上段27例(27.55%),中段28例(28.57%)。针对病变大小而言,有74例病变直径≤1.0 cm;直径>1.0 cm者有24例,其中>2.0 cm者仅4例。所有病变中,来源于黏膜肌层及固有肌层者占大多数,分别为42和53例,另3例来源于黏膜下层。所有患者均完善术前常规检查,排除手术绝对禁忌,并在术前详细告知患者手术风险,签署由本院伦理委员会审定通过的手术知情同意书。
1.2 食管 SMTs 内镜下诊断
1.2.1 电子胃镜 经常规胃镜检查能够观察食管壁局部隆起处黏膜颜色和形态,以及是否有糜烂性出血,同时也可使用活检钳检查隆起部位质地、活动度以及有无接触性出血等,见图1,进而可初步判断黏膜下肿瘤类型。然而,常规内镜往往不能判断病变的性质和来源,也无法将其与外压性隆起区分开,此时需进一步行EUS检查。
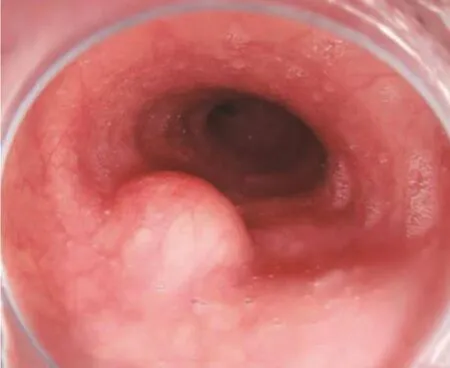
图1 平滑肌瘤普通内镜下表现Fig.1 The appearance of the esophageal leiomyoma under the endoscopy
1.2.2 EUS EUS 不仅频率高、分辨率好,而且可以辨别消化道壁各个层次,进而可以全面分析黏膜下病变的深度、性质、大小及周围情况等,见图2。腔内超声能清晰分辨出食管各层的组织结构,明确肿瘤是来源于黏膜下病变还是食管外压性病变。EUS能清楚显示肿瘤的范围和形状,并且能提供内部结构及明确其与邻近组织和器官的关系。
1.2.3 胸部CT 可协助明确肿瘤的具体大小、肿瘤向管外扩展的情况及准确部位,进而鉴别食管黏膜下肿瘤及其他外压性病变,为手术方案的制定及切口的设计提供指导依据。
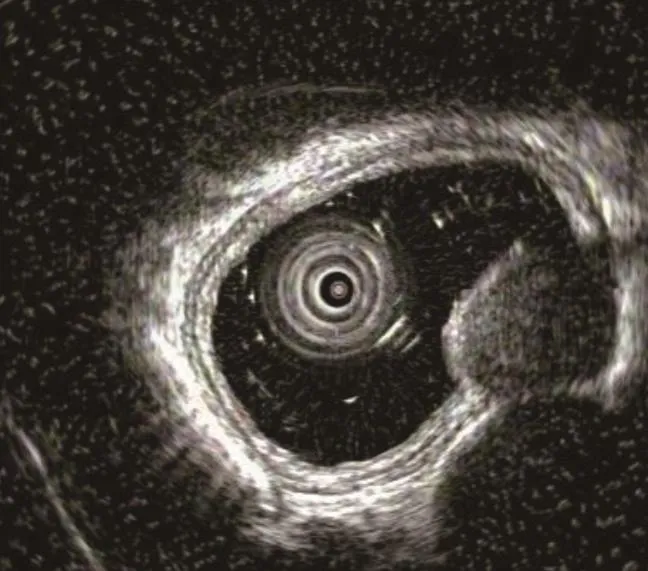
图2 平滑肌瘤在 EUS 下表现Fig.2 The appearance of the esophageal leiomyoma under the EUS
1.3 食管 SMTs 内镜下治疗
食管SMTs内镜下治疗,采用内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)、经内镜黏膜下肿瘤挖除术(endoscopic submucosal excavation,ESE)和经内镜黏膜下隧道肿瘤切除术(submucosal tunneling endoscopic resection,STER)等方式。
1.3.1 ESD 对于EUS确定位于黏膜肌层或固有肌层的肿瘤(源于固有肌层且向内生长的),先在肿瘤基底部位的黏膜下注入注射剂,如1∶10 000肾上腺素盐水等,使病灶隆起并与黏膜下层分离,剥去黏膜层及黏膜下层,充分暴露瘤体,再用IT刀或Hook刀进行瘤体的钝性剥离。
1.3.2 ESE 首先 Dual刀标记切除病灶周边,黏膜下多点局部注射亚甲蓝溶液,充分抬举病变后,其上方做一切口,再用IT刀或Dual刀逐步剥离、挖除瘤体,金属夹夹闭创面。如术中出血,给予去甲肾上腺素冲洗创面,并以电凝钳电凝止血;如术中发生穿孔,用金属钛夹封闭穿孔处,创面较大时应用金属夹闭合创面。
1.3.3 STER 以距肿瘤口侧约 4.0 ~ 5.0 cm 处黏膜作为切口,此处予靛胭脂生理盐水混合液黏膜下注射,使局部黏膜层隆起,再用TT刀沿食管纵轴切开黏膜约2.0 cm,钝性分离黏膜下层和肌层,并在两者之间建立黏膜下隧道,在隧道内逐步完整剥离瘤体后,用圈套器将瘤体取出,术后仔细观察创面,采用电凝钳止血,生理盐水反复冲洗并清理隧道内液体。最后以金属钛夹完整封闭隧道并夹闭黏膜切口,见 图3。
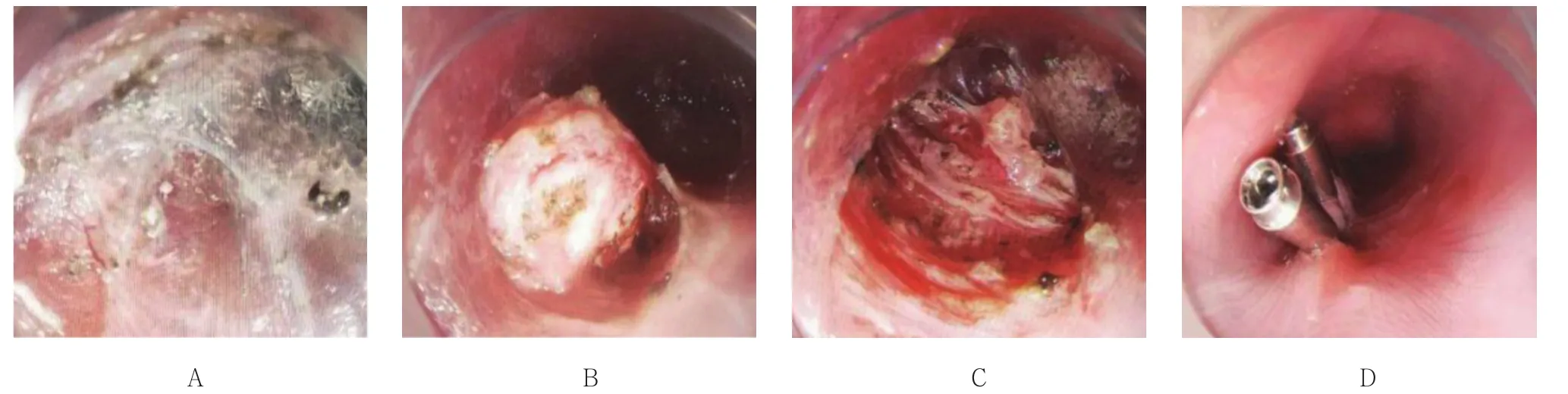
图3 STER 的部分过程Fig.3 Partial process of submucosal tunneling endoscopic resection treatment
1.4 术后处理与观察
术后常规留置胃管并禁食水24~72 h,期间密切观察患者有无发热、出血、腹痛腹胀和皮下气肿等情况出现,同时予以抑酸、抗感染和止血等治疗,若无特殊不适,术后第2或3天开始可进食流质饮食,继续巩固治疗3~7 d后可出院。
1.5 组织病理学检查
切除的肿瘤用10%福尔马林缓冲液固定并行苏木精-伊红(hematoxylin-eosin,HE)染色及免疫组化染色,进一步分析切除病变的组织病理学和免疫组化特点,并评估肿瘤危险级别。免疫组化结果表现为CD117(+)或CD34(+),且平滑肌肌动蛋白(smooth muscle actin,SMA)(-)者,考虑为食管间质瘤。免疫组化结果表现为 SMA(+)或 DES(+)、CD117(-),且CD34(-)者,考虑为食管平滑肌瘤。而S-100(+)者诊断考虑神经源性肿瘤。
1.6 随访
所有手术患者被告知术后3和12个月需就诊随访,并行普通内镜和EUS检查评估术后恢复情况、有无复发病变及残留病灶等,若有残留病灶,则需每年定期随访。
1.7 观察指标
收集并分析上述所有患者的一般临床病例特征资料,如:性别、年龄、伴随症状、病变位置、病变大小和病变来源等。记录手术相关资料并各手术组间分析比较相关指标,包括手术时间、术中出血量、并发症发生情况、术后禁食时间和术后住院天数等。其中手术时间定义为患者入手术室至出手术室所需时间;术中出血量是根据术中吸引器吸出的量由术者结合经验估算;术后禁食时间及术后住院天数定义为自手术结束当天至患者遵医嘱进食及遵医嘱出院所需时间;术后并发症包括穿孔、感染、瘘和食管狭窄等均有详细记录及分析。
1.8 统计学方法
采用SPSS 22.0统计软件进行统计分析。计数资料关联性分析行χ2检验。计量资料用中位数(P25-P75)表示,采用秩和检验。P<0.05认为差异有统计学意义。
2 结果
2.1 食管SMTs的生长部位与胃食管反流症状的关系
所有患者中,有39例出现不同程度的胃食管反流症状,且病变位于中下段食管者反流症状较上段多见。进一步对食管SMTs的生长部位与胃食管反流症状的发生情况进行统计学分析发现,两者相关性差异无统计学意义(P>0.05)。见表 1。
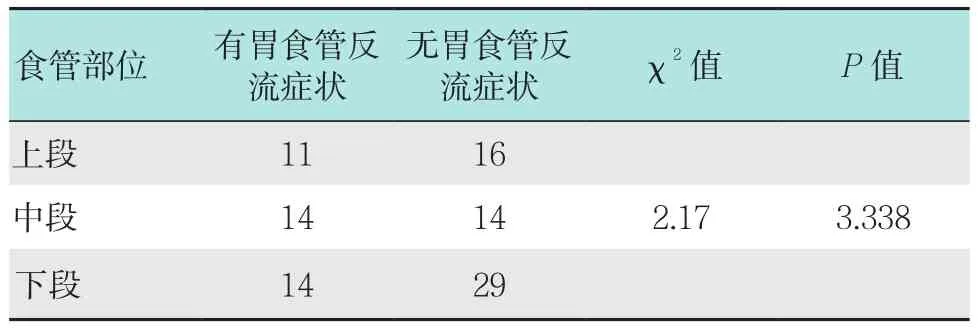
表1 食管SMTs生长部位及胃食管反流症状发生 情况 (n =98)Table 1 Tumor location and the occurrence of gastroesophageal reflux (n =98)
2.2 术前EUS诊断与术后病理诊断结果比较
98例食管SMTs患者中,术前EUS下诊断为平滑肌瘤者47例,其中45例术后病理结果仍提示平滑肌瘤,1例提示颗粒细胞瘤,1例提示先天性食管囊肿;术前EUS下诊断为间质瘤者6例,术后病理结果提示,其中4例为平滑肌瘤,1例为孤立性纤维瘤,1例为神经鞘瘤;1例术前EUS下诊断为脂肪瘤者,术后病理仍提示脂肪瘤;余44例,术前EUS下无法明确肿瘤类型,术后病理结果提示1例间质瘤,1例颗粒细胞瘤,1例海绵状淋巴瘤,另41例提示平滑肌瘤。故术后病理诊断明确平滑肌瘤者共有90例,占所有病例91.84%。EUS对平滑肌瘤的诊断与病理诊断符合率为97.87%。
2.3 内镜下治疗食管 SMTs
所有患者均于内镜下行肿瘤切除治疗,其中56例行ESD,25例行ESE,12例行STER。3种手术方式手术时间比较,差异有统计学意义(P<0.05),3种手术方式术中出血量、术后禁食时间和术后住院天数等比较,差异均无统计学意义(P>0.05),见表2。余5例患者因不同原因,未通过上述3种手术方式进行治疗。其中,1例孤立性纤维性肿瘤因术中发现肿瘤基底部深,病灶呈分叶状,考虑继续行内镜下治疗风险大,改为外科手术;1例平滑肌瘤因瘤体过大,内镜操作较困难,故中转胸腔镜治疗;3例平滑肌瘤给予内镜下电凝电切除术,手术成功率为97.96%(96/98)。1例神经鞘瘤ESD术后出现气胸、胸腔积液、ESD术后瘘及食管狭窄等并发症,1例胸腔镜下行摘除术的平滑肌瘤,术后出现气胸、胸腔积液,行胸腔镜下穿孔修补术及抗感染治疗后好转出院,另外2例平滑肌瘤术后出现纵隔气肿及皮下气肿,故内镜下治疗后穿孔发生率为3.13%(3/96)、食管狭窄发生率1.04%(1/96),余病例均无并发症发生。术后住院天数为 1 ~ 14 d,平均 4.1 d。
2.4 病理学检查结果及术后随访结果
病理学检查最后确诊平滑肌瘤90例。其中,上段26例,占食管平滑肌瘤总数28.89%(26/90),占食管上段SMTs的96.30%(26/27);中段26例,占平滑肌瘤总数28.89%(26/90),占食管中段SMTs的92.86%(26/28);下段38例,占平滑肌瘤总数的42.22%(38/90),占食管下段SMTs的88.37%(38/43)。颗粒细胞2例,间质瘤1例,神经鞘瘤1例,先天性食管囊肿1例,脂肪瘤1例,海绵状淋巴管瘤1例,孤立性纤维性肿瘤1例。68例(余病例术后未复查胃镜)患者3个月后复查胃镜,创面均愈合良好,32例(余病例术后未复查胃镜)术后12个月复查胃镜及EUS,均未提示复发病变或残留病灶,亦未发生食管狭窄。食管平滑肌瘤HE染色及不同免疫组化结果见图4。
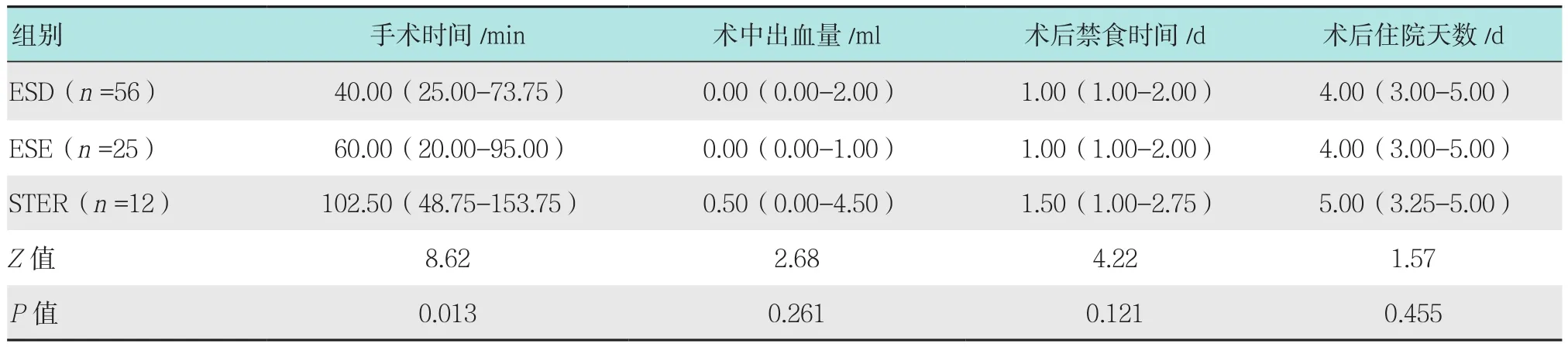
表2 3种手术方式治疗食管SMTs临床结局比较 (P25-P75)Table 2 Comparison of cilinical outcomes of different endoscopic therapies (P25-P75)
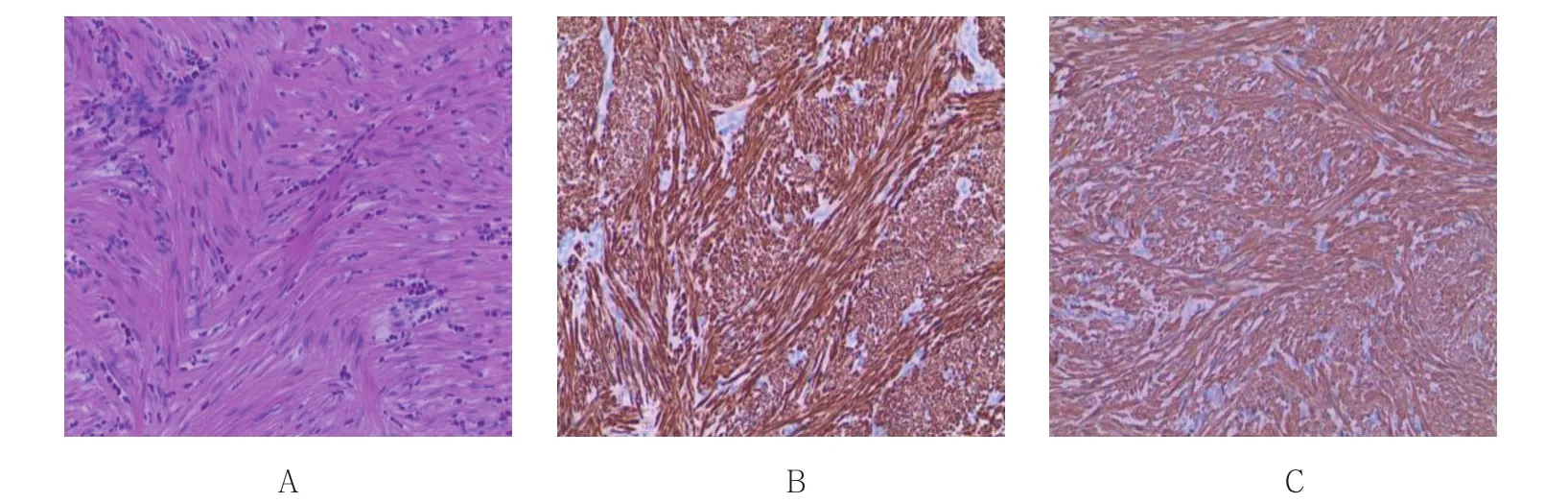
图4 食管平滑肌瘤HE染色及不同免疫组化结果Fig.4 HE stain and different immunohistochemial outcomes of the esophageal leiomyoma
3 讨论
食管SMTs属于食管良性病变,占所有食管肿瘤的比例<1%,因临床症状较轻或常无明显不适,易被患者或临床医生所忽视[2]。本研究中的24例患者完全没有不适症状,在常规体检中偶然被发现,余74例患者虽然出现不同程度的胃食管反流、咽部异物感、胸骨后不适和上腹部胀痛等症状,但以上症状在肿瘤体积较小时并不明显,随着瘤体的增大,才有可能出现较典型的不适表现。出现不适症状的患者中,大部分(39例)诉胃食管反流不适。进一步分析其发生与食管SMTs生长部位的关系发现,两者统计学上无关联,这可能与患者本身食管括约肌功能障碍等因素相关,而与食管SMTs病变位置没有明确因果关系。另外,本研究还发现,不同症状的出现可能与肿瘤发生部位有关,食管上段靠近咽部处的病变可能会引起咽部异物感,位于中段者则有可能导致胸骨后憋闷等不适,而位于下段靠近贲门处的病变则会引起不同程度的上腹部胀痛等症状。但总体而言,食管SMTs缺乏特异性临床症状,故早期发现较为困难,患者有可能错过最佳治疗时机,尤其对于像食管间质瘤一样存在恶变风险的肿瘤而言,早期发现并诊治更加重要。即使食管间质瘤没有胃间质瘤一样常见,但食管上段直径<3.0 cm的间质瘤被认为是良性肿瘤的概念,在MIETTINEN等[3]的3项大型回顾性研究发表之后已被推翻,根据美国国家综合癌症网上指南,所有间质瘤都具有潜在的恶变性质,而且所有直径>2.0 cm的间质瘤均需被切除,但是直径<2.0 cm的单发肿瘤可选择切除或严密随访[4]。近年来,由于消化内镜及影像学等检查技术的不断改善,食管SMTs的检出率得以大大提高,更多的食管SMTs患者能够在疾病早期即可被发现并及时治疗。
临床上常规胃镜下即可发现各类型的食管SMTs,它们在内镜下有以下特点:①突出于食管腔中;②表面黏膜完整光滑;③皱襞消失,边缘隐约可见;④随吞咽活动或用活检钳触之时可上下轻度活动;⑤不易导致管腔狭窄等共同特点,所以经普通胃镜彼此间难以鉴别。再者,由于肿物生长在食管壁内,穿刺活检很难深达肌层,导致无法取得肿瘤组织,故对明确肿瘤性质意义不大。而EUS技术的诞生与不断发展,实现了食管SMTs无创临床诊断的术前推断。它既能够清晰地显示食管壁的各层次结构,还能准确判断肿瘤的大小、性质和来源部位,甚至可以推测肿瘤和周围组织器官的关系。不仅能给临床医生提供制定最佳治疗方案的思路,还可以提高疗效并降低术后并发症的发生率[5-6]。尽管EUS诊断率较高,但其在病变性质的诊断价值方面仍有争议,单凭EUS结果鉴别良性肿瘤和有恶变可能的其他类型食管SMTs仍较为困难。本研究结果显示,EUS下诊断食管SMTs的种类有平滑肌瘤、间质瘤、脂肪瘤和囊肿等,术前有47例诊断为食管平滑肌瘤,其中46例术后病理结果仍提示平滑肌瘤;而术前EUS下诊断的6例间质瘤,术后病理结果均未提示相同结果。结合术前EUS及术后病理结果发现,EUS对于平滑肌瘤的诊断率较高,而对于食管间质瘤诊断率则较低,其原因可能为:①操作过程中超声探头可能受气体干扰或病灶压迫,使病灶无法清晰显示;②病灶本身不易区分,食管间质瘤在EUS下与平滑肌瘤一样表现为黏膜光滑的低回声隆起性病变,不易与平滑肌瘤区分,给EUS的诊断带来了难度[7]。术前一般不建议对病变常规行EUS引导下穿刺活检,否则将有可能导致黏膜与黏膜下组织粘连,从而加大手术难度,严重时可能会引起出血、穿孔和肿瘤播散等后果。组织病理学结果和免疫组化方法对于任何可疑恶性食管SMTs的确诊都是至关重要的。因此,术后病理检查作为诊断的金标准,在提供完整的病理诊断资料的同时,还能通过切缘的阳性与否评估有无残余肿瘤组织。
在过去,外科治疗是食管SMTs的首选治疗方式,肿瘤摘除术是被广泛认可的标准治疗手段[8]。随着内镜治疗技术的迅速发展,近年来更多食管SMTs可在内镜下被发现并及时进行干预和治疗。目前,临床上常见的治疗方法主要有:内镜下套扎术、ESD、ESE和STER等[9]。本研究中,98例患者术前均完善EUS检查,较大病变进一步行胸部CT,通过结合两者结果明确肿瘤大小、形态、来源部位和生长方式等,以此来确定内镜下治疗方式。有研究[10]显示,ESD针对较大肿物虽然可以实现一次性完整剥离,同时可提供病变组织完整的病理资料,但遇到肿瘤起源于固有肌深层及与浆膜紧密相连时,ESD对其进行整块切除在操作上困难度大;另外,因需剥离食管黏膜,术后较易发生创面溃疡、穿孔及出血等并发症,其中出血最常见,术中灵活使用热活检钳和高频电刀及时止血是防止出血的关键。本研究中,1例神经鞘瘤患者因肿瘤位于固有肌深层,但术前EUS检查并未明确提示,且病灶较大(大小3.0 cm×1.0 cm),剥离术后发生创面溃疡导致食管狭窄,穿孔导致胸腔积气、胸腔积液和食管胸膜瘘等,后于胸腔镜下行食管穿孔修补术及食管球囊扩张术,同时给予抗感染和抑酸等治疗,患者术后住院天数长达14 d方好转出院。ESE在技术上与ESD极其类似,只有在操作深度上有所不同,但是往往由于病灶粘附在固有肌层过于太强而导致病灶切除不完整,或者为提高完整切除率有可能会导致穿孔风险增加[11]。本研究中,25例ESE手术患者均未发生穿孔相关并发症。STER技术作为一项新近发展的内镜技术,在切除来源于固有肌层的食管SMTs领域已被证实是安全有效的技术[12]。相比ESD,STER在维持食管黏膜的完整性、促进伤口的快速愈合上有优势,并在不影响肿瘤完整切除率或者不增加并发症发生率的基础上,能够缩短手术所需时间[13-15]。本研究中,应用STER技术切除的病变中,有11例食管STMs均起源于固有肌层,病变直径多<2.0 cm,术后仅有皮下气肿等气体相关性并发症,未发生穿孔、出血和胸腹腔感染等严重并发症,术后患者恢复较快故而缩短住院时间。本研究显示,上述3种手术方式的手术时间比较,差异有统计学意义,而术中出血量、术后禁食时间和术后住院天数等方面比较,差异均无统计学意义。但由于内镜下治疗食管SMTs时,手术方式的选择在严格掌握各类手术适应证的前提下,应综合考虑病变本身的大小、位置、起源部位、浸润深度及生长方向等诸多因素,而且本研究收集的病例数量较少缺乏代表性,故这几种手术方式在上述几项指标间的统计学差异仅供参考,并非能具体指导临床上治疗方式的选择。这几种手术方式的关键点均在于完整切除肿瘤的同时,保留食管的迷走神经和血供,术中还需要保护肿瘤周围的正常组织,切忌锐器分离,以免损伤食管黏膜[16]。
食管SMTs并不常见,缺乏特异性临床症状,但近年来随着辅助诊断技术,尤其是EUS技术的突飞猛进,其检出率明显上升,并呈现逐年增长趋势。目前,食管SMTs的公认治疗标准仍为胸腔镜下肿瘤摘除术,但随着内镜技术和内镜器械的进一步改进,临床经验的不断积累及对此类肿瘤的深入研究,内镜下治疗手段以其创伤小、痛苦少、操作简便、手术时间及术后住院时间短、术后恢复快、并发症少和经济实用等诸多方面的优势,将广泛应用于深层、巨大甚至突出于食管腔外的食管SMTs的治疗,未来有望成为治疗此类肿瘤的优先选择[17]。
