单次小剂量匹罗卡品对实验大鼠杏仁核电活动及海马组织的影响**
2019-03-12康杨婷黄媛馨伍国锋
康杨婷,黄媛馨,伍国锋
(1.贵州医科大学,贵州贵阳 550004;2.贵州医科大学附院急诊神经科,贵州贵阳 550004)
癫痫(epilepsy,EP)是多种原因导致的以脑部神经元高度同步化异常放电为主要表现的临床综合征[1],伴有短暂的运动、感觉、意识及自主神经功能异常,具有病因多样性、发作反复性、症状复杂性、表现形式单一等特点[2]。目前常用氯化锂-匹罗卡品腹腔注射建立EP大鼠模型,使用单次大剂量匹罗卡品腹腔注射可以获得较高的致痫性动物模型,但致死率较高[3-4]。相关文献报道,小剂量反复腹腔注射匹罗卡品可建立大鼠颞叶EP模型,能够获得较高致痫率及较低致死率[4-6],但关于单次小剂量匹罗卡品对大鼠大脑影响的研究目前尚未发现。本研究旨在探讨单次予以小剂量匹罗卡品对实验大鼠杏仁核电活动及海马组织的影响。
1 材料与方法
1.1 动物
健康成年雄性SD大鼠40只、SPF级、体质量180~220 g、日龄60~90 d,由贵州医科大学实验动物中心提供。保持实验室内温度22~26℃,湿度恒定。采用单笼喂养、自由进食,让动物适应环境。
1.2 方法
1.2.1 分组、给药及记录脑电波 将40只大鼠随机均分为正常对照组(NC组)与小剂量匹罗卡品实验组(PC组),立即在两组动物中分别在杏仁核植入记录电极。PC组大鼠在术后第7天腹腔注射氯化锂125 mg/kg,18 h后再给予腹腔注射10 mg/kg匹罗卡品;NC组在术后第7天仅予以相同次数、相同剂量的生理盐水腹腔注射,不予注射氯化锂-匹罗卡品。
1.2.2 标本处理 于药物处理后2周末,采集SD大鼠杏仁核区的脑电图。用10%的水合氯醛麻醉大鼠后,将大鼠固定、暴露胸腔,用眼科剪剪开大鼠的右心耳处,经大鼠左心室快速灌注0℃预冷的生理盐水500 mL置换出体内的血液,待右心耳缺口处流出清亮液体后,用预先配置好的PBS 500 mL灌注,灌注结束后断头取脑,迅速分离出海马组织。将一侧海马组织浸泡于4%多聚甲醛EP管中,4℃冰箱中固定过夜;另一侧海马组织冷冻之后装入无酶的EP管中,于-80℃冰箱中保存备用做Western Blot检测γ-氨基丁酸A(GABAA)受体。
1.3 观察指标
1.3.1 记录脑电图波幅及频率 两组大鼠均在药物注射后第7天描记脑电图1 h,首先连续记录15 min,然后每隔5 min记录10 min,1 h内完成。脑电图资料用随机软件计算出波幅和频率。
1.3.2 海马神经元细胞数及GABAA受体 将予以多聚甲醛处理的组织用自来水反复冲洗后,用75%的酒精中行常规脱水24 h,分别浸泡在二甲苯Ⅰ透明化处理60 min和二甲苯Ⅱ中透明化处理40 min,再进行包埋切片。将组织蜡块切成5μm厚的薄片置于用多聚赖氨酸包被的载玻片上,放在60℃的恒温烤箱中烘烤1 h,室温下复温1 h后透明处理15 min,将脱蜡后的切片经100%、95%、85%、75%的酒精分别浸泡5 min,纯水冲洗10 min,并将切片放入事先预热至60℃1%甲苯胺蓝染液中浸染30 min。浸染结束后,纯水冲洗6 min,然后经95%的酒精迅速分化1 min,无水乙醇脱水、透明、中兴树胶封片。通过显微镜拍照,观察海马细胞数以及GABAA受体的表达。
1.3.3 检测GABAA受体 称取约10 mg的海马组织置于事先预冷的EP管内,向EP管中加入200μL预冷的蛋白裂解液、再加入蛋白酶抑制剂2μL,充分混匀后置于冰上超声破碎仪破坏海马组织。用高压灭菌后的移液器枪头将研磨好的组织液转移至一个新的预冷的EP管中,配平后放入4℃离心机中,14 000 r/min离心5 min,将上清液转移至新的离心管中进行蛋白质含量的测定,采用 BCA分光光度法来测定蛋白质含量。测量完毕后置于-80℃冰箱中冷冻保存,然后制胶、加样,通过凝胶电泳、转膜、孵育抗体及曝光处理后观察两组大鼠的海马组织中的GABAA受体的表达。
1.4 统计学处理
应用SPSS13.0软件分析数据,所测得数据采用独立样本t检验,结果用均值±标准差(±s)表示,以P<0.05为差异有统计学意义。
2 结果
2.1 行为学表现
PC组大鼠予以小剂量匹罗卡品腹腔注射后,未发现大鼠有点头、肢体抽搐等行为学改变;NC组予以相同剂量的生理盐水处理后也未观察到异常行为学变化。
2.2 脑电图波幅及频率
两组大鼠药物处理后第7天,PC组大鼠杏仁核后放电的频率及波幅均明显高于NC组,差异有统计学意义(P<0.05),见表1。
表1 两组大鼠腹腔注射后杏仁核后放电的波幅及频率(±s)Tab.1 Amplitude and frequency of posterior amygdaloid discharges after intraperitoneal injection in rats of both groups
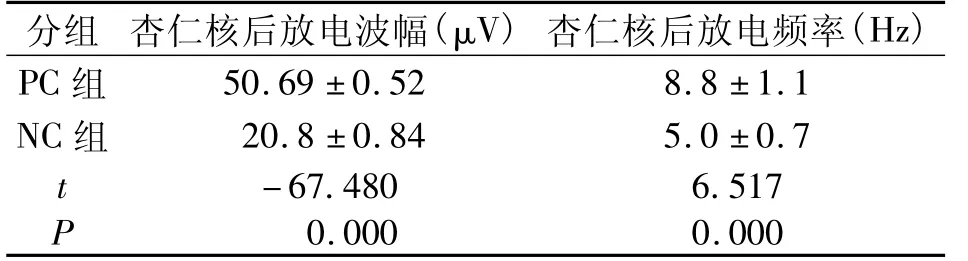
表1 两组大鼠腹腔注射后杏仁核后放电的波幅及频率(±s)Tab.1 Amplitude and frequency of posterior amygdaloid discharges after intraperitoneal injection in rats of both groups
分组 杏仁核后放电波幅(μV)杏仁核后放电频率(Hz)PC组50.69 ±0.52 8.8 ±1.1 NC 组 20.8 ±0.84 5.0 ±0.7 t-67.480 6.517 P 0.000 0.000
2.3 海马神经元细胞数
注射2周后,PC组SD大鼠在CA1、CA3、CA4区的海马神经元细胞数较NC组明显减少,海马椎体细胞数量也明显减少,差异有统计学意义(P<0.05),见图1、图 2。
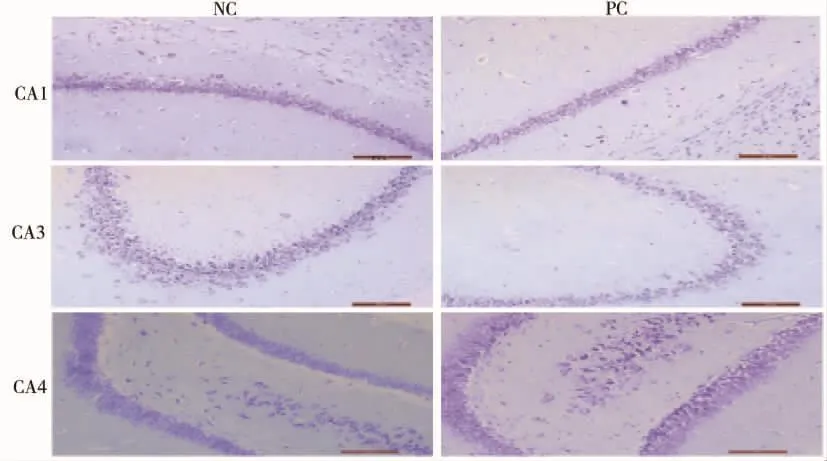
图1 注射两周后两组大鼠海马神经元(×200)Fig.1 Hippocampal neuron of rats in both groups
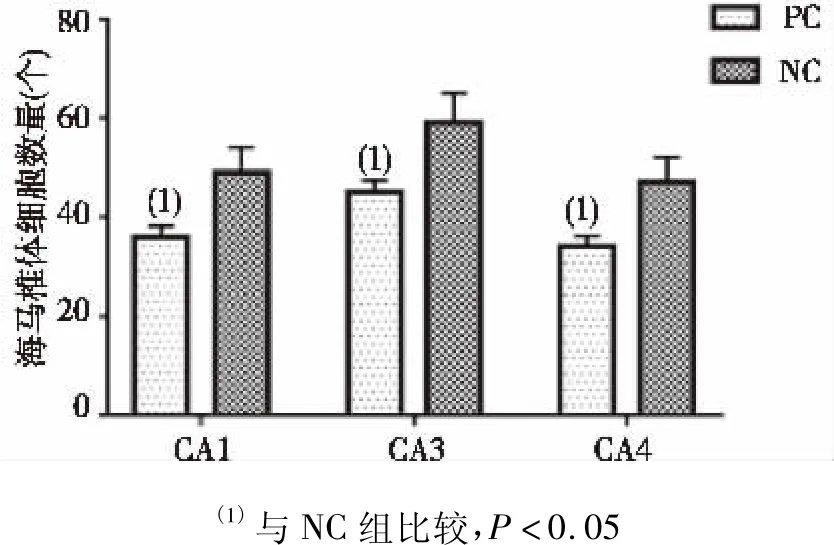
图2 注射两周后两组大鼠海马椎体细胞数Fig.2 Number of hippocampal vertebrae cells of rats in both groups
2.4 海马GABAA受体
对两组大鼠海马组织GABAA受体的免疫荧光发现,PC组大鼠海马细胞总数较NC组减少,且PC组海马组织GABAA受体的表达量明显低于NC组,差异有统计学意义(P<0.05),见图3。Werstern blot检测GABAA受体表达结果显示,PC组大鼠海马组织GABAA受体表达较NC组明显减少,差异有统计学意义(P<0.05),见图4。
3 讨论
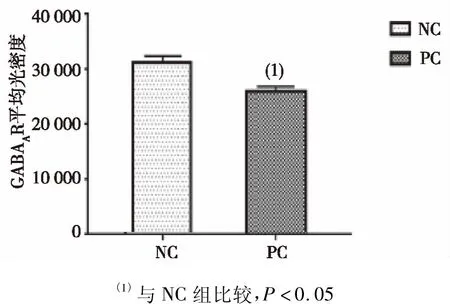
图3 两组大鼠海马组织GABAA受体平均光密度(免疫荧光)Fig.3 Average optical density of GABAA receptor in hippocampus of rats in both groups(immunofluorescence)
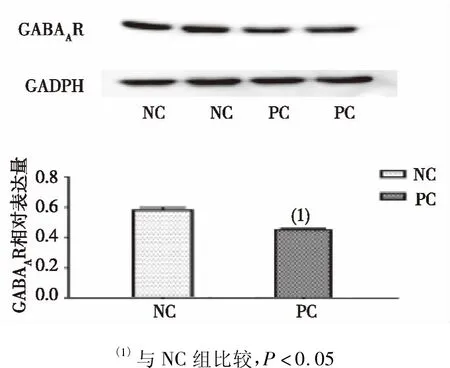
图4 两组大鼠海马组织GABAA受体表达(Werstern blot)Fig.4 Expression of GABAA receptor in hippocampus of rats in both groups
EP是国内外常见的中枢神经系统疾病,成功地建立EP动物模型对于探讨EP的病因、发病机制、治疗具有重大意义。国内外研究中已成功建立多种EP动物模型,如杏仁核点燃模型、海人酸模型、匹罗卡品模型等,查阅相关文献表明匹罗卡品EP大鼠模型的病理特征与人类颞叶EP非常相似[7],是最理想的颞叶 EP 动物模型之一[8-9],它的优势在于在制造EP模型时,该模型不用经大脑给药,仅通过腹腔注射便能诱发EP发作。因此,对于在后续实验中需要进行大脑内慢病毒注射及颅内给药治疗的实验,该模型是最佳选择。在正常大鼠中依次予以氯化锂-大剂量匹罗卡品后,可引起大脑的局限甚至广泛性损伤,而这种局限或者广泛性损伤有可能作为EP发作的病灶,从而引发慢性EP的自发性发作。大鼠氯化锂-匹罗卡品EP模型在行为学、脑电图、病理特性上与人类颞叶EP非常相似,并且具有制作简单、诱发迅速、表现典型、痫性发作容易确认等优点,因此近年来一直被用于EP发病机制和抗EP药物的研究的较为理想的颞叶 EP模型[10-11]。虽然单次予以大剂量(30 mg/kg)的匹罗卡品致痫性高,但同时死亡率高,不利于用于EP模型的研究[12-13],因此较高的死亡率成为该模型的最大弊端。大量的文献报道制备EP模型的匹罗卡品的剂量接近其致死量,从而导致了该模型的较高的死亡率,因此国内外学者致力于如何减少氯化锂-匹罗卡品EP模型的死亡率。国内外的相关报道发现氯化锂-反复小剂量(10 mg/kg)匹罗卡品制备EP模型可以明显降低大鼠的死亡率,提高大鼠的EP发病率,使急性期大鼠EP持续状态的发生率明显提高,而死亡率有所下降[14]。国内外研究主要致力于氯化锂-大剂量匹罗卡品EP模型和氯化锂-反复小剂量匹罗卡品模型的研究,而单次小剂量匹罗卡品对大鼠杏仁核后放电以及海马组织的影响的研究尚未发现。给予小剂量的匹罗卡品后,根据相关文献报道几乎未发现大鼠会有相关痫性发作[14-15]。本研究通过对小剂量匹罗卡品大鼠的海马组织的研究,结果发现小剂量匹罗卡品可以损伤大鼠的的海马组织,从而证明反复小剂量匹罗卡品模型可以引起大鼠大脑的广泛性损伤,使大鼠EP发作;反复小剂量给予匹罗卡品可以减少匹罗卡品药物过量的发生率,降低匹罗卡品模型的死亡率;通过研究表明小剂量匹罗卡品给予后可以使大鼠杏仁核后放电的频率及波幅均明显增加,海马神经元细胞的数量以及GABAA受体的表达均明显减少,从而说明小剂量匹罗卡品能增强大鼠的杏仁核电活动并导致海马神经元的丢失,减少GABAA受体的表达,从而可能提高大鼠的EP易发性。
综上,单次小剂量氯化锂-匹罗卡品腹腔注射更容易诱发实验大鼠的EP发作。这是因为单次小剂量匹罗卡品能增强大鼠的杏仁核电活动并导致海马神经元的丢失,减少GABAA受体的表达,这可能是小剂量单次注射匹罗卡品致癫痫发生的机制之一。
