FcγRIIB缺失促进顺铂诱导的急性肾损伤小鼠肾组织巨噬细胞浸润**
2019-03-12金筱茜吴通前周海燕
金筱茜,吴通前,马 岚,袁 锐,杨 丹,周 玲,高 健,王 珺,周海燕,余 芳,***
(1.贵州医科大学临床微生物及免疫学教研室,贵州贵阳 550004;2.贵州医科大学附院临床医学研究中心,贵州 贵阳 550004;3.贵州医科大学附院临床检验中心,贵州贵阳 550004)
顺铂是治疗卵巢癌、睾丸癌等多种癌症最有效的细胞毒性药物之一[1-2],具有较好的疗效,但可引起以肾小管坏死为主要病理改变的急性肾损伤(acute kidney injury,AKI)[3],这一副作用限制了顺铂在化疗中的使用。AKI病理生理学涉及免疫细胞激活[4],巨噬细胞作为免疫细胞,在肾损伤中发挥重要作用[5]。肾损伤时单核细胞迅速浸润肾脏,分化为巨噬细胞,导致肾小管早期损伤[6-8]。免疫球蛋白 Fc受体IIB(FcγRIIB)属于免疫球蛋白家族,可表达于巨噬细胞表面,因其特有的结构免疫受体酪氨酸抑制基序(immunoreceptor tyrosine-based inhibitory motifs,ITIM),可通过磷酸化过程传递抑制性信号[9-10]。在肾小球肾炎动物模型中,降低单核/巨噬细胞系表达FcγRIIB可减轻肾小球白细胞浸润,从而减轻病情[11]。巨噬细胞可分为促炎性巨噬细胞(M1)抗炎巨噬细胞(M2)[12],持续损伤反应中,M1通过分泌炎症因子,引起肾小管细胞凋亡,诱导肾损伤和纤维化;在一定的微环境中,抗炎巨噬细胞(M2)分泌可再生的营养因子,减少炎症,促进伤口愈合和肾脏恢复[13]。目前在顺铂诱导急性肾损伤中FcγRIIB缺失对巨噬细胞及AKI病情的影响还不明确,因此本研究通过顺铂构建野生型及FcγRIIB基因敲除小鼠AKI模型,探究FcγRIIB在AKI中的作用。
1 材料与方法
1.1 实验动物、材料与试剂
8~10周的雄性C57BL/6背景下FcγRIIB基因敲除小鼠(FcγRIIB-/-)由哥德堡大学 MIVAC医学实验动物中心赠予,10周的雄性C57BL/6野生型小鼠(Wildtype,WT)购自北京华富康生物科技有限公司。实验小鼠饲养于特定无病原体(SPF)的动物实验室,22℃恒温、相对湿度为50%~70%、12 h光/暗周期。本实验方案经贵州医科大学动物保护委员会伦理指导批准并实施(证号NO 2517098)。顺铂(美国Sigma公司),血清肌酐试剂盒(南京建成生物有限公司),血清尿素氮试剂盒(南京建成生物有限公司),酶联免疫吸附试验(ELISA)试剂盒(武汉华美),多聚甲醛(美国Sigma公司),苏木素-伊红(HE)试剂盒(中国索莱宝有限公司),CD68(Proteintech Group,Inc,武汉),山羊抗兔二抗(中国中杉金桥 ZB-2301);引物(上海生工),The SYBR Green real time PCR kit(Applied Biosystems),总RNA提取试剂盒(Tian-GenDp 419),The PrimeScript RT reagent Kit with a gDNA Eraser(TAKARA BIO INC RR047A),PerCP-cy5.5 Anti-F4/80(eBioscience),PE-CD86(BD Biosciences),APC-CD206(BD Biosciences)。
1.2 方法
1.2.1 分组及动物模型 雄性WT小鼠和FcγRIIB-/-小鼠,体质量约 20 g,按照每组 5 只随机分为 WT 对照组(WT-Control,WC),WT AKI模型 组 (WT-Model,WM),FcγRIIB-/-对 照 组(FcγRIIB-/--Control,FC)和 FcγRIIB-/-AKI模型组(FcγRIIB-/--Model,FM)4 组。WM 和 FM 组腹腔注射20 mg/kg体质量的顺铂,WC和FC组腹腔注射等量生理盐水。
1.2.2 样本采集 造模72 h后麻醉后处死小鼠,采集小鼠腋动脉血,离心后取血清用于生化测定。分离小鼠左肾,置于10%中性福尔马林溶液中保存,用于病理苏木素-伊红(HE)染色和免疫组化检测。分离小鼠右肾,以冠状面等分成3等分,其中1/3提取肾脏单个细胞用于流式细胞术检测、1/3冰上匀浆后检测组织局部炎性因子、1/3匀浆后提取肾脏mRNA。
1.2.3 生化测定 按照生化试剂盒操作检测血清尿素氮(BUN)和血清肌酐(Scr),评估小鼠AKI模型是否成功。
1.2.4 HE染色 肾组织HE染色评估顺铂诱导AKI模型是否成功,以肾小管上皮肿胀、刷状缘脱落、空泡变性为基础,采用半定量评分法,每张切片(400×)取相同组织结构部位随机10个视野,0、1、2、3、4 分分别表示损伤面积 <10%、10% ~ <25%、25~<50%、50~ <75%、≥ 75%,评分后计算其平均值,评估肾小管坏死(ATN)程度[14]。
1.2.5 肾组织巨噬细胞浸润情况检测 免疫组织化学检测(CD68)肾组织巨噬细胞浸润情况,随机选取4个高倍视野,根据阳性细胞百分比及阳性细胞染色强弱进行评分,无阳性细胞为0分,阳性细胞总数<25%为1分,25% ~49%为2分,≥50%为3分;无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。两项乘积即为其评分,<3分为阴性,≥ 3 分为阳性[15]。
1.2.6 肾组织肿瘤坏死因子α(TNF-α)、单核细胞趋化因子(MCP-1)检测 酶联免疫吸附试验(ELISA)检测肾脏组织匀浆TNF-α及MCP-1,按试剂盒说明书进行操作。
1.2.7 肾组织MCP-1、MCP-1α、MCP-1β mRNA检测 提取肾脏mRNA,应用荧光定量聚合酶链反应(Q-PCR)检测MCP-1(CCL2)、MCP-1α(CCL3)及MCP-1β(CCL4)相对表达量。CCL2引物序列为 F-GCCTGCTGTTCACAGTTGC,R-CAGGTGAGTGGGGCGTTA,CCL3引物序列为 F-ATGAAGGTCTCCACCACTGC,R-CCCAGGTCTCTTTGGAGTCA;CCL4引物序列为F-CAAACCTAACCCCGAGCAACAC,R-GGTCTCATAGTAATCCATCCAAAGC。
1.2.8 肾组织巨噬细胞亚型检测 提取肾脏单个细胞后,流式细胞仪(Navios,Backman)检测 F4/80+CD86+(M1)、F4/80+206+(M2)巨噬细胞。抗-小鼠 PerCP-cy5.5 Anti-F4/80、PE-CD86、APCCD206单克隆抗体4℃避光孵育30 min,与同种属来源阴性抗体作为阴性对照,上机检测,使用Flowjo软件(Tree Star Inc.,Ashland,OR)进行分析。
1.3 统计学方法
应用SPSS22.0及GraphPad Prism6软件进行数据分析,计量资料采用均数±标准差(±s)表示,数据比较采用单因素方差分析,组间比较采用t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 血清Scr及BUN
与FC组和WC组相比,FM组和WM组Scr及BUN均明显升高,差异有统计学意义(P<0.01);FM组Scr和BUN较WM组显著升高,差异有统计学意义(P<0.01),提示顺铂已诱导小鼠AKI,且FcγRIIB缺失可加重AKI。见表1。
表1 各组小鼠血清Scr及BUN(±s)Tab.1 The effect of FcγRIIB loss on serum Scr and BUN
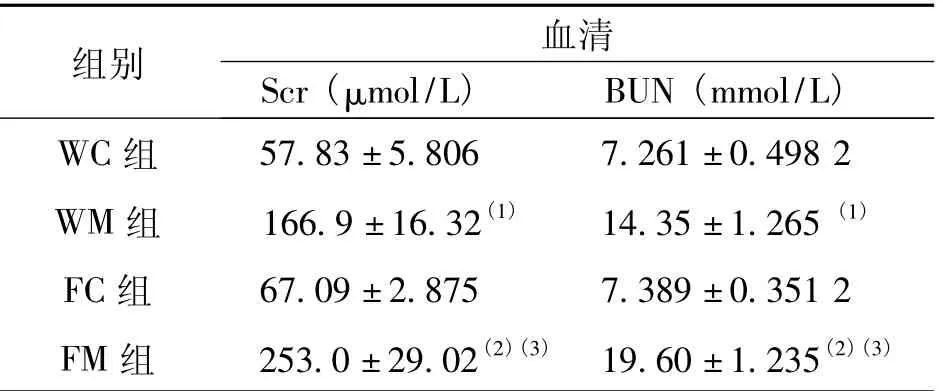
表1 各组小鼠血清Scr及BUN(±s)Tab.1 The effect of FcγRIIB loss on serum Scr and BUN
(1)与WC组比较,P<0.05;(2)与FC组比较,P<0.05;(3)与WM组比较,P<0.05
组别 血清Scr(μmol/L) BUN(mmol/L)WC组57.83±5.806 7.261±0.498 2 WM组 166.9±16.32(1) 14.35±1.265(1)FC组 67.09±2.875 7.389±0.351 2 FM组 253.0±29.02(2)(3) 19.60±1.235(2)(3)
2.2 肾组织学
FM组和WM组肾小管上皮肿胀、刷状缘脱落、空泡变性,其肾小管坏死(ATN)评分明显高于FC组和WC组,差异具有统计学意义(P<0.01);且FM组ATN评分高于WM组,差异具有统计学意义(P<0.01)。提示顺铂已诱导小鼠AKI,且FcγRIIB缺失可加重AKI。见图1。
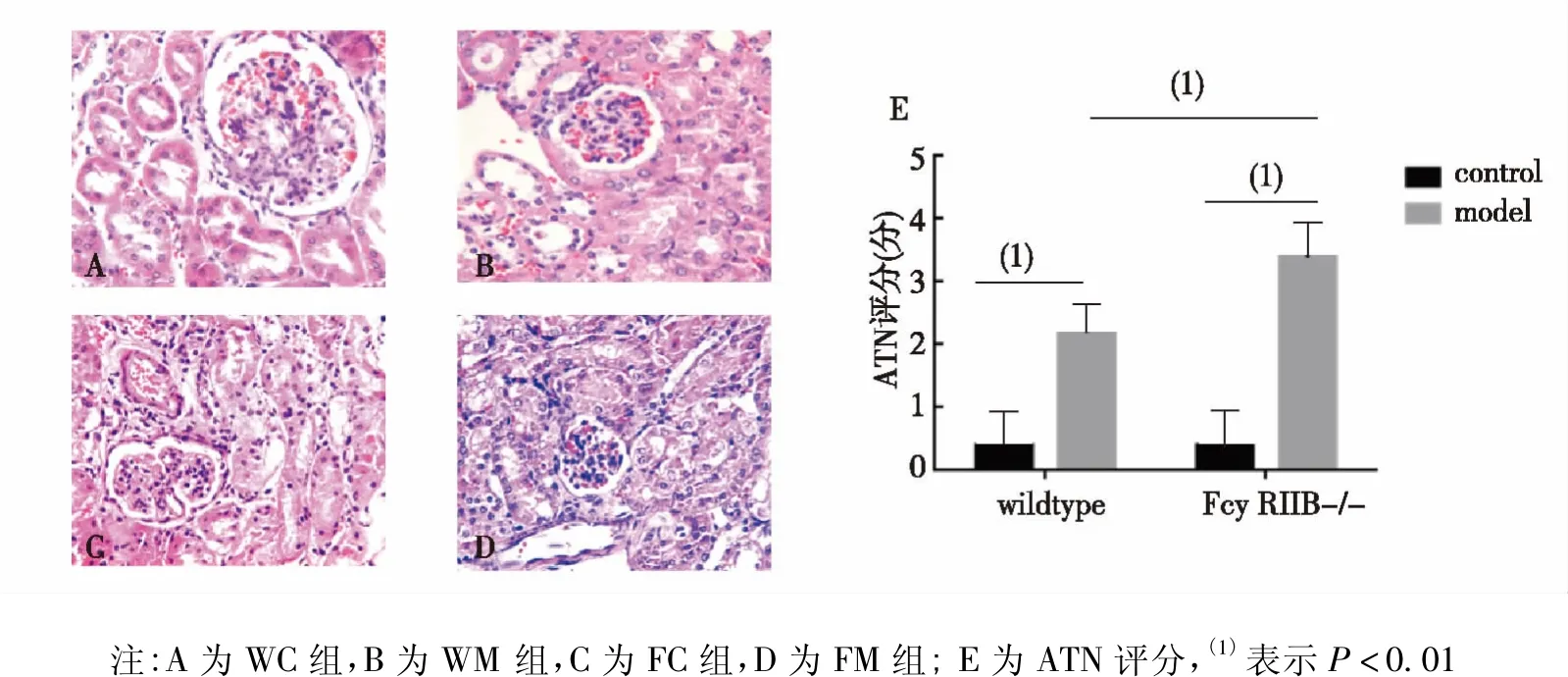
图1 各组小鼠肾脏组织(HE,×400)及ATN评分Fig.1 The effect of FcγRIIB loss on kidney tuber damage
2.3 肾脏组织TNF-α、MCP-1表达
FM组、WM组肾脏组织TNF-α、MCP-1表达水平显著高于FC组和WC组,差异有统计学意义(P<0.01);且FM组肾脏组织TNF-α、MCP-1表达水平较WM组显著升高,差异有统计学意义(P<0.01),见图2。
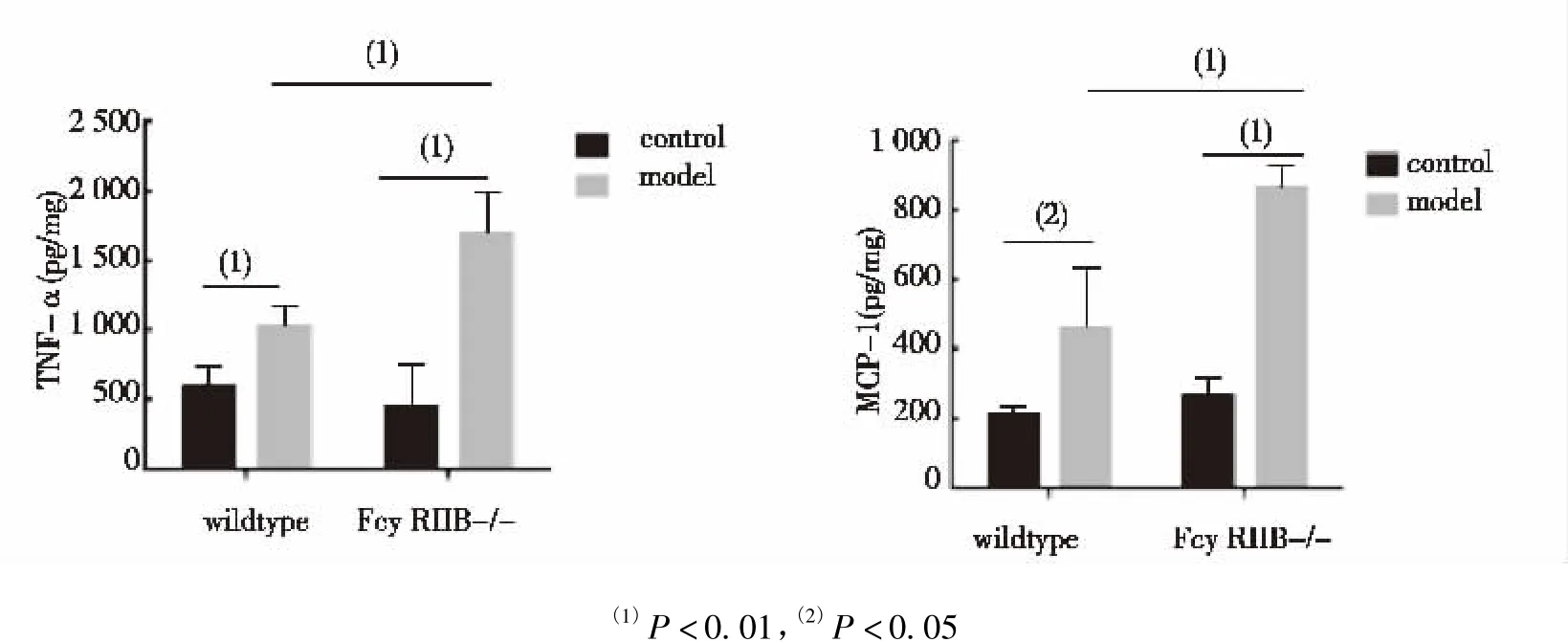
图2 肾脏组织匀浆中TNF-α,MCP-1表达水平Fig.2 The effect of FcγRIIB loss on levels of TNF-α,MCP-1 in kidney homogenates
2.4 肾脏组织巨噬细胞浸润情况及类型
免疫组织化学结果显示,FM组、WM组肾组织巨噬细胞浸润增多(图3A),并且FM组浸润更多(图3B),差异具有统计学意义(P<0.01)。肾脏单个细胞流式细胞术检测结果显示,与对照组相比,M1类细胞在FM组及WM组有增多趋势,但差异无统计学意义(图3C),M2类巨噬细胞表达未见明显差异(图3D)。
2.5 肾组织CCL2、CCL3、CCL4 mRNA表达
与WC组和FC组相比,WM组和FM组CCL2、CCL4 mRNA表达增加(P<0.05),CCL3 mRNA表达有增高的趋势,但差异无统计学意义(P>0.05)。FM组肾组织CCL2、CCL4 mRNA表达水平增加较WM组更为明显(P<0.05),CCL3 mRNA表达较WM组有增高的趋势,但差异无统计学意义(P>0.05)。见图4。
3 讨论
顺铂联合其他药物在临床治疗中有一定的副作用,如肾毒性[1,16]。临床上通过水合作用减少肾毒性,但是仍有超过1/4患者出现肾功能障碍,继而进展为急性肾损伤,甚至肾功能衰竭[17]。因此,探讨顺铂引起肾损伤机制,可为减轻化疗患者不良发应提供相应策略。本实验中,顺铂诱导后,肾功能及肾脏病理提示顺铂导致实验小鼠肾损伤,并且FcγRIIB缺失时症状更严重。同时观察到肾组织相关巨噬细胞趋化因子和炎性因子升高,以及巨噬细胞活化等变化,提示FcγRIIB可通过促进巨噬细胞浸润活化而导致急性肾损伤病情的进展。FcγRIIB通过其特有的ITIM结构传递抑制性信号,抑制PIP3活性,可引起细胞膜离子流变化,从而改变效应细胞功能状态,如抑制细胞活化作用,减少抗体及炎性因子生成等[18-19]。
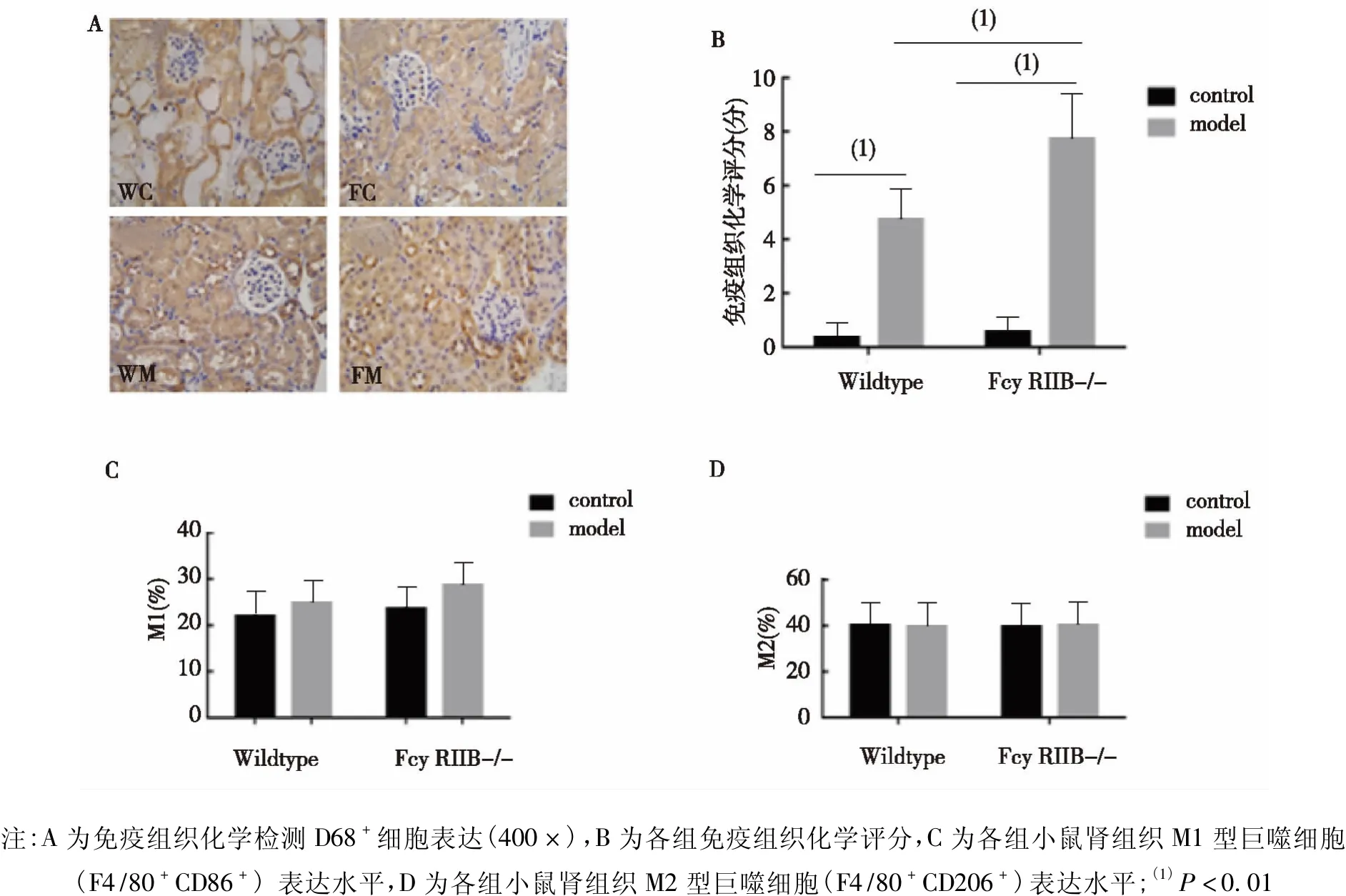
图3 各组小鼠肾组织巨噬细胞浸润及亚型Fig.3 The effect of FcγRIIB loss on macrophage infiltration and subtypes in renal tissues
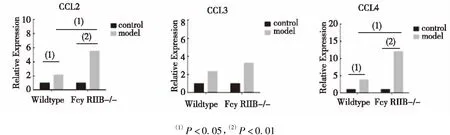
图4 各组小鼠肾组织CCL2、CCL3、CCL4 mRNA表达Fig.4 The effect of FcγRIIB loss on mRNA levels of CCL2,CCL3 and CCL4 in kidney tissues
巨噬细胞是免疫应答中的重要细胞,在固有性免疫和获得性免疫中均发挥重要作用,参与多种病理生理过程,如急性肾损伤[20]。CCL2是肾损伤后募集巨噬细胞迁往损伤组织的重要趋化因子[6]。组织发生损伤时,CCL2通过介导骨髓释放单核细胞,在细胞生成的多糖-蛋白质复合物浓度梯度下,引导单核细胞到达损伤组织[21]。在膜性肾病、IgA肾病、肾小球硬化症中可见 CCL2含量增高[21]。本实验发现AKI小鼠肾组织匀浆CCL2含量增加,而且FcγRIIB缺失时增加更为明显。研究表明,给予顺铂的小鼠模型中可见肾脏巨噬细胞增多[22],这与本实验中模型鼠肾脏组织中出现CD68+巨噬细胞浸润相一致,同时可见FcγRIIB-/-模型鼠CD68+巨噬细胞浸润较WT模型鼠更多,这可能与FcγRIIB-/-模型鼠肾组织匀浆CCL2更高的表达量有关。
炎性因子的活化在顺铂诱导的急性肾损伤中其起重要作用[8],单核细胞效应趋化因子 CCL3、CCL4是由激活的单核细胞分泌产生,以吸引其他免疫炎性细胞进入损伤组织[23]。本实验中可见模型组肾组织CCL3、CCL4相对表达量高于对照组,在FcγRIIB-/-模型鼠更为明显。TNF-α在急性肾损伤中扮演重要角色,TNF-α不仅可导致肾小管上皮损伤[24],而且可促进其他炎性因子和趋化因子,如IL-1β、MCP-1表达,从而使更多炎细胞迁移到损伤肾组织中[8]。本研究结果可见模型组肾脏组织匀浆中 TNF-α 明显高于对照组,且 FcγRIIB-/-模型鼠明显且高于WT模型组,炎性因子以及趋化因子高表达可能是造成FcγRIIB-/-模型鼠肾损伤症状更严重的原因之一。
有研究表明,缺乏PI3K小鼠在肾损伤时可诱导巨噬细胞极化为M1类细胞,从而加重病情进展[4]。本研究在肾脏巨噬细胞分选检测结果提示,M1类细胞在AKI组略增多,且FcγRIIB缺失时增多趋势更明显,而M2类巨噬细胞表达无明显差异。这表明FcγRIIB-/-在顺铂诱导急性肾损伤中可能通过诱导巨噬细胞向M1类型极化而加重病情。
综上所述,巨噬细胞参与顺铂引起的的肾损伤的发展,FcγRIIB可能通过抑制细胞因子及趋化因子的产生,减少巨噬细胞向M1类巨噬细胞极化的趋势,从而减轻顺铂引起的肾损伤进展。但本研究主要集中于FcγRIIB对顺铂引起急性肾损伤中巨噬细胞的影响,其他炎细胞(如中性粒细胞等)可能也不同程度参与疾病过程,将下一步研究。
