多重PCR 同时检测食品中4 种细菌与常见霉菌
2019-03-11熊苏玥米瑞芳李金春李家鹏乔晓玲王守伟
熊苏玥,米瑞芳,陈 曦*,戚 彪,李金春,李家鹏*,乔晓玲,王守伟
(中国肉类食品综合研究中心,北京食品科学研究院,国家肉类加工工程技术研究中心,肉类加工技术北京市重点实验室,北京 100068)
食源性致病菌引发的食品安全事件一直是公共卫生领域关注的焦点[1-2]。由金黄色葡萄球菌、沙门氏菌、单核细胞增生李斯特氏菌和大肠杆菌O157:H7等细菌性食物中毒引起的疾病在我国约占食品安全事件的30%~90%,也是世界范围内的主要公共卫生问题[3-4]。曲霉和青霉是食物成品贮藏过程中出现的主要致腐菌[5-7],其次级代谢产物通常是容易引起疾病的致癌、致畸、致突变的霉菌毒素。因此,加强食品中致病微生物检测技术的研究对预防和控制食源性疾病具有重要意义。
传统检测方法时间长,工作量大,准确度较低[8]。近年来,随着针对食源性致病菌的分子生物学检测手段快速发展与应用,多重聚合酶链式反应(polymerase chain reaction,PCR)检测技术取得很大进展。在食源性致病细菌检测方面,Wei Caijiao等[9]利用多重PCR同时检测牛乳中的大肠杆菌O157:H7、金黄色葡萄球菌和沙门氏菌,检测方法的灵敏度为103CFU/mL,与食品样品中的单重PCR灵敏度结果相同。Nguyen等[10]通过12 h的增菌培养可将鸡肉等食品中PCR检测沙门氏菌、大肠杆菌O157:H7与单核细胞增生李斯特氏菌的检出限由增菌前的102CFU/mL降低至101CFU/mL。闫琳等[11]将人工染菌的禽肉食品样本在增菌12 h后,利用PCR检测沙门氏菌的检出限可低至100CFU/25 g。增菌-PCR检测方法可显著提高致病菌的检出限,然而由于不同微生物生长特性存在差异,需要研究开发通用型培养基应用于多种致病菌的同时增菌培养,并抑制其他非靶标菌的生长,而且增菌-PCR方法无法定量致病菌的初始数量;另外,增菌培养时残留的食品基质成分,也有可能影响菌体生长速率和后续PCR扩增,因此该检测方法还有待进一步完善[12]。在食源性霉菌检测方面,顾双等[13]利用ITS和pksCT基因引物进行PCR扩增,以监测发酵食品中的霉菌,敖特根巴雅尔等[14]所建立的PCR体系对检测干肉制品中霉菌的灵敏度为2 ng/μL。目前,细菌和霉菌的多重PCR检测在医学中已有报道[15],但尚鲜见利用多重PCR法同时检测食品中致病细菌和霉菌的报道。
因此,本研究针对食品中的金黄色葡萄球菌、沙门氏菌、大肠杆菌O157:H7、单核细胞增生李斯特氏菌及常见霉菌,建立一种快速、稳定且特异性良好的多重PCR体系,对快速、准确同时检测肉制品、豆制品和面制品中5 种致病微生物污染情况进行探讨。
1 材料与方法
1.1 材料与方法
香肠、豆腐、面包 北京市购;所用菌株购自中国工业微生物菌种保藏管理中心(CICC)和丹麦科汉森公司,详见表1。
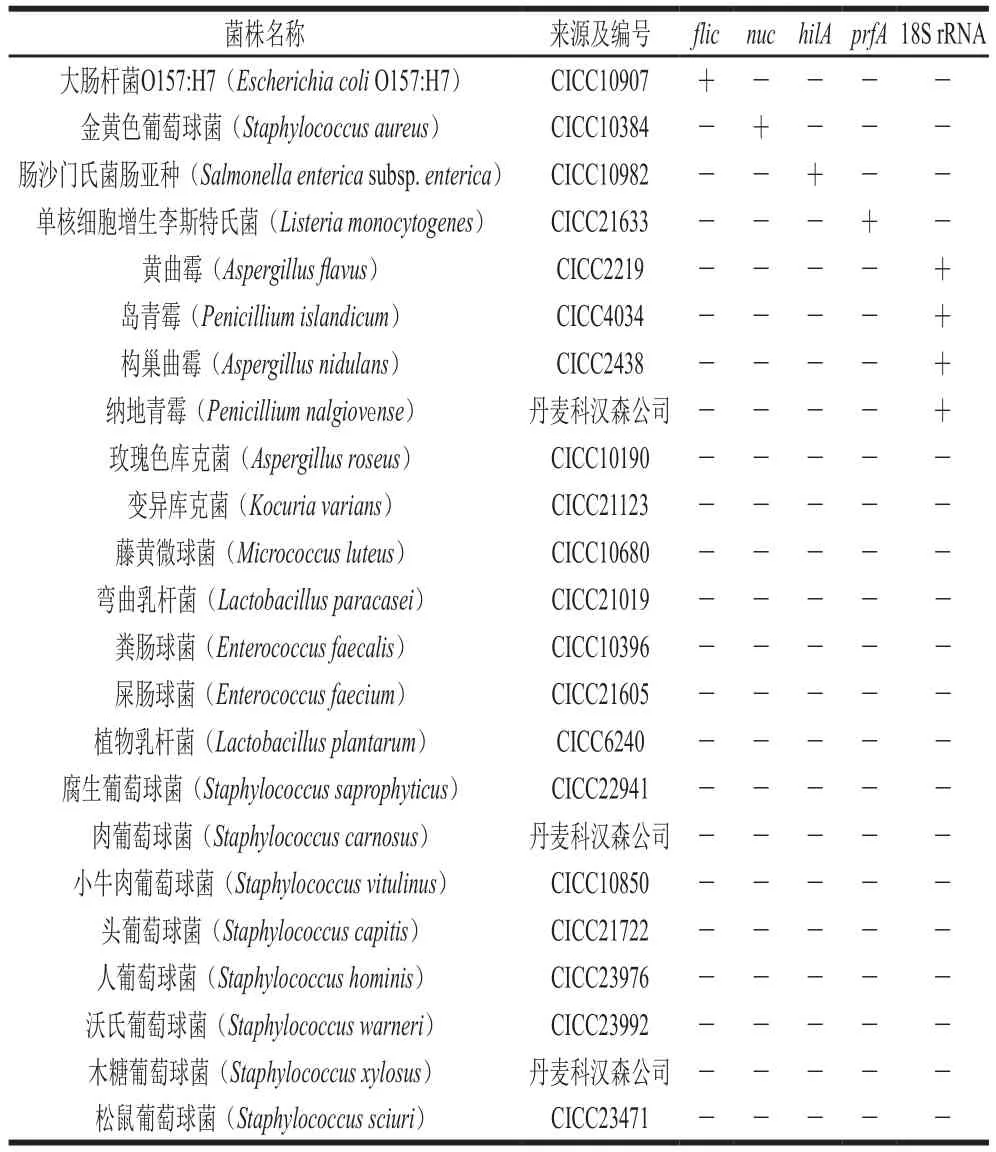
表1 菌种来源及用于引物设计的靶标基因Table 1 Strains tested in this study and their target genes used for primer design
引物由Invitrogen公司合成;2×TaqPCR MasterMix(含染料)、RNase-free水、细菌DNA提取试剂盒天根生化科技(北京)有限公司;DNeasy Plant Mini Kit试剂盒(69104) 德国QIAGEN公司;DL 2000(plus 100)、DL 500 DNA Marker 宝生物工程(大连)有限公司;琼脂糖 西班牙Biowest公司;DuRed染料北京全品速生物科技有限公司;脑心浸液(BHI)培养基、营养肉汤(NB)、李斯特氏菌增菌肉汤(LEB)、营养琼脂(NA)培养基、马铃薯-葡萄糖琼脂(PDA)培养基 北京陆桥技术股份有限公司。
1.2 仪器与设备
Eppendorf 5417R冷冻离心机 艾本德中国有限公司;Synergy H4多功能酶标仪 美国伯腾仪器有限公司;T100梯度PCR仪 伯乐生命医学产品(上海)有限公司;电泳仪 六一(中国)有限公司。
1.3 方法
1.3.1 菌体培养
取活化的沙门氏菌、金黄色葡萄球菌和大肠杆菌O157:H7分别于NB培养基中于37 ℃培养3、5 h和2 h,单核细胞增生李斯特氏菌于BHI培养基中于37 ℃培养6 h,取处于对数生长期的新鲜菌液用于细菌基因组DNA提取。黄曲霉、岛青霉和构巢曲霉于利用PDA培养基培养3 d,黄曲霉培养条件为29 ℃,其他霉菌为25 ℃。黄曲霉、岛青霉和构巢曲霉取培养基上的新鲜菌落,纳地青霉则直接利用冻干菌粉进行霉菌基因组DNA提取。
1.3.2 DNA提取
细菌取新鲜菌液后,利用细菌基因组DNA提取试剂盒进行DNA提取。霉菌经玻璃珠振荡破壁后,利用DNeasy Plant Mini Kit试剂盒提取霉菌DNA。
1.3.3 引物设计
选取文献[16-18]中报道的4 种细菌的菌种特异性基因,包括金黄色葡萄球菌的耐热核酸酶基因(nuc)、沙门氏菌的侵袭基因正调节蛋白基因(hilA)、大肠杆菌O157:H7鞭毛基因(flic)、单核细胞增生李斯特氏菌的毒力调控蛋白基因(prfA),作为靶标基因设计引物进行PCR扩增。由于需要同时检测到不同种属的霉菌,选择霉菌18S rRNA基因V5区设计特异性引物[19]用以扩增食品中常见霉菌。利用Premier 5.0对目的基因进行引物设计以及评价[20],参考引物的特异性检测扩增结果,选取5 对扩增片段大小有一定差异、退火温度相近且特异性较高的引物,引物序列见表2。

表2 多重PCR引物序列Table 2 Multiplex PCR primer sequences
1.3.4 多重PCR体系的建立
对每组引物的添加量、退火温度、P C R循环数、延伸时间等因素进行优化。最终确定的最适反应体系为25 μL:2×TaqPCR MasterMix(含染料)12.5 μL,上下游引物(10 μmol/L)各1.25 μL,由单核细胞增生李斯特氏菌prfA0.23 μL、沙门氏菌hilA0.42 μL、金黄色葡萄球菌nuc0.20 μL、大肠杆菌O157:H7flic0.20 μL、霉菌18S V5 0.20 μL组成,DNA模板1 μL,双蒸水ddH2O补足至25 μL。采用降落PCR提高扩增的特异性、灵敏度和产量[21],降落PCR扩增程序:94 ℃预变性3 min,94 ℃变性30 s,初始退火温度59 ℃,经过6 个循环且每个循环减0.4~57 ℃,保持退火温度为57 ℃扩增30 个循环,退火时间均为30 s,72 ℃延伸25 s,共扩增36 个循环,最后72 ℃延伸5 min。取5 μL PCR产物在3%琼脂糖凝胶上进行电泳,凝胶成像系统观察结果并成像。
1.3.5 多重PCR体系特异性检测
为确定所建立多重PCR方法的特异性,随机选择三类及四类目的菌株DNA进行组合作为DNA模板进行多重PCR扩增,观察扩增产物有无交叉错配现象。同时对非目标菌DNA模板进行扩增,选择玫瑰色库克菌、变异库克菌和藤黄微球菌等其他共15 种菌株验证菌种特异性。
1.3.6 多重PCR体系灵敏度检测
将得到的5 种致病菌DNA质量浓度调整到40 ng/μL后进行10 倍梯度稀释,作为扩增DNA模板。即进行灵敏度实验的DNA质量浓度分别为4×101~4×10-5ng/μL,每个质量浓度的DNA各取1 μL按最佳反应体系与反应条件进行实验。
1.3.7 多重PCR检测人工污染食品
将培养至对数期的5 种致病菌分别用生理盐水10 倍梯度稀释,使浓度为100CFU/mL。参照Kumar等[22]的方法,经检测无菌的香肠样品均质后,分别接种5 种菌,接种量均为100CFU/25 g,污染香肠样品于营养肉汤中在37 ℃培养9、14 h和20 h后,取每种菌的培养液1 mL混合后分别提取细菌和霉菌DNA,在人工污染肉制品中验证建立的多重PCR方法。在面包和豆腐中同法进行验证。
2 结果与分析
2.1 多重PCR特异性检测结果
采用单一目的菌株DNA扩增以检测多重PCR引物的特异性,扩增结果显示大肠杆菌O157:H7、金黄色葡萄球菌、沙门氏菌、单核细胞增生李斯特氏菌与纳地青霉、岛青霉、黄曲霉、构巢曲霉4 种霉菌在相应位置处均出现清晰的单一条带(图1),且片段大小与理论值相符,分别为73、143、192、220 bp与280 bp,未发现非特异性扩增条带。泳道5~8中以纳地青霉、岛青霉、黄曲霉、构巢曲霉4 种不同种属的霉菌DNA为模板,均成功扩增出单一条带,泳道9中同时扩增出5 种DNA清晰且有明显区分度的条带,证明该引物对食品中常见的5 种细菌和霉菌有良好的特异性与较高的扩增效率。
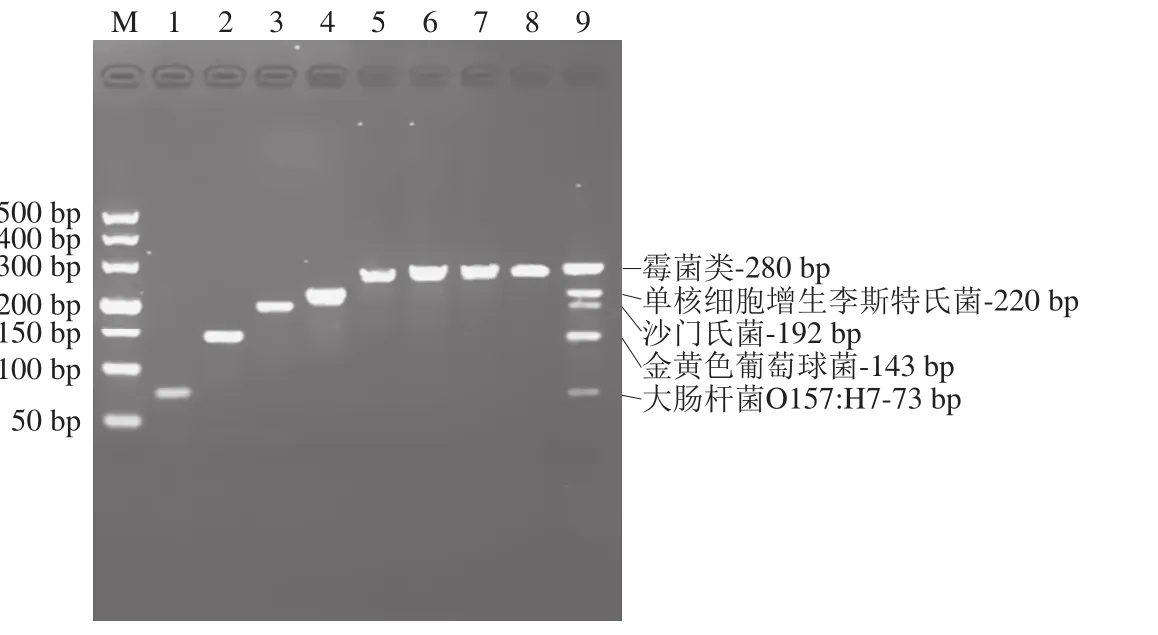
1.大肠杆菌O157:H7(Ec);2.金黄色葡萄球菌(Sa);3.沙门氏菌(Se);4.单核细胞增生李斯特氏菌(Lm);5.纳地青霉(Pn);6. 黄曲霉(Fa);7.岛青霉;8.构巢曲霉;9. Fa+Ec+Sa+Se+Lm;M. Marker DL500。
如图2所示,以库克菌、乳杆菌和葡萄球菌等食品中可能出现的其他菌种作为阴性对照,验证扩增体系的菌种特异性。1~15泳道中除低于50 bp的引物二聚体无其他条带出现,说明该PCR扩增体系菌种特异性良好,可避免扩增出发酵食品生产中常用的植物乳杆菌等乳酸菌,或者非目标致病菌如库克菌、粪肠球菌等从而产生假阳性结果。

图2 多重PCR体系菌间特异性Fig. 2 Specificity of strains in multiplex PCR
利用已建立的多重PCR体系对目标菌株进行引物间特异性的检测,检测结果如图3所示。泳道1~10的扩增结果表明该体系可扩增出任意组合的3 种目标菌,泳道11~15的扩增结果表明该体系可扩增出任意组合的4 种目标菌,泳道16显示该体系可同时扩增出5 种目标菌,引物间未发生交叉错配现象的情况,同时无非特异性扩增条带出现,阴性对照无扩增条带。结果表明建立的多重PCR体系具有非常好的菌种特异性。
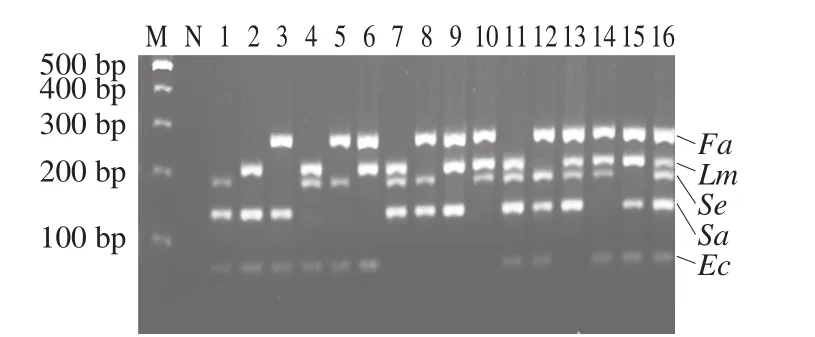
图3 多重PCR引物间特异性Fig. 3 Specificity of primers in multiplex PCR
2.2 多重PCR灵敏度检测结果
将5 种菌的基因组DNA进行10 倍梯度稀释后,分别取101、100、10-1、10-2、10-3、10-4、10-5ng作为模板进行多重PCR扩增。如图4所示,5 种致病菌中霉菌(黄曲霉)的检出限可达10-5ng,而当模板量低于10-3ng时金黄色葡萄球菌、单核细胞增生李斯特氏菌、沙门氏菌的目标条带消失,大肠杆菌O157:H7存在微弱的扩增条带,因此同时检测5 种菌的最低模板量为10-2ng。
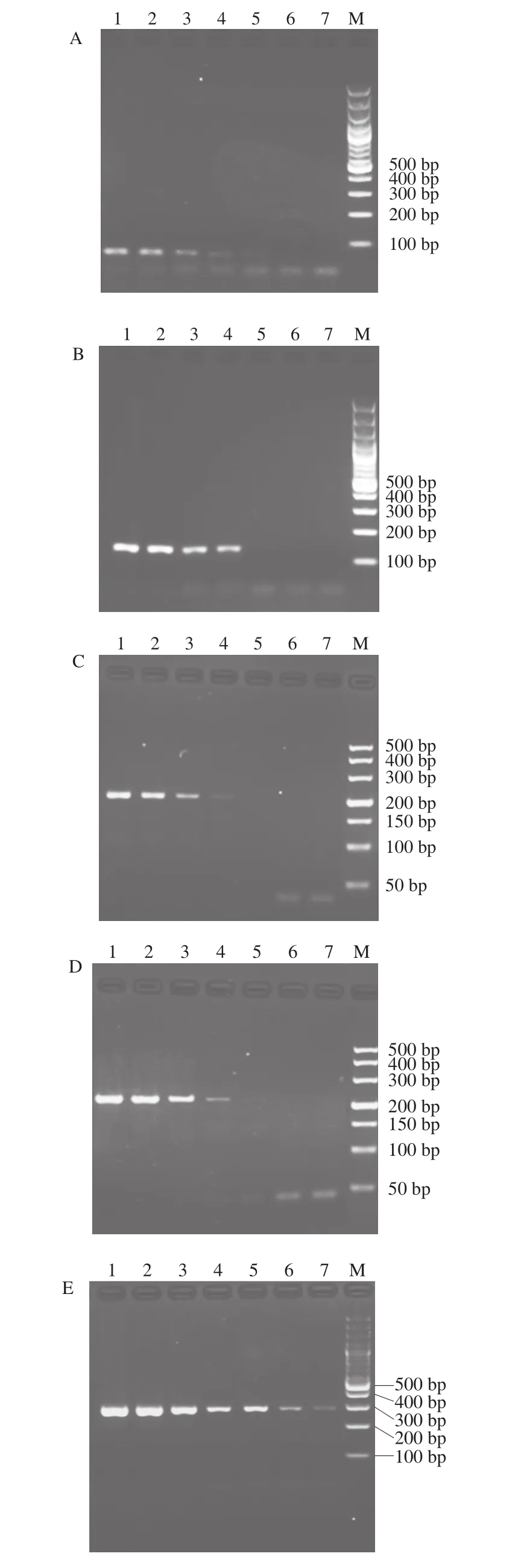
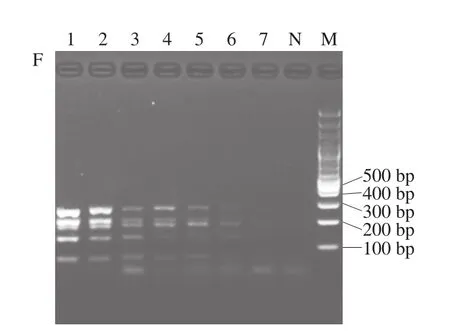
图4 多重PCR分别检测大肠杆菌O157:H7(A)、金黄色葡萄球菌 (B)、沙门氏菌(C)、单核细胞增生李斯特氏菌(D)、 黄曲霉(E)以及多重PCR同时检测5 种微生物(F)的灵敏度 Fig. 4 Sensitivity of multiplex PCR for E. coli O157:H7 (A), S. aureus (B), Salmonella enterica subsp. enterica (C), Listeria monocytogenes (D), Aspergillus flavus (E), and multiplex DNA (F)
2.3 人工污染食品的多重PCR灵敏度检测结果
为验证建立的多重PCR方法在食品中应用的效果,选取香肠、豆腐和面包分别作为常见肉制品、豆制品和面制品的代表。经检测确认无4 种致病细菌和霉菌的香肠、豆腐和面包中,分别接种5 种目标菌,其中接种霉菌为纳地青霉,初始接种量均为100CFU/25 g食物。
如图5所示,增菌9 h后,3 种人工污染食物样品中均可检出大肠杆菌O157:H7、金黄色葡萄球菌与霉菌。其中香肠人工污染样品在增菌9 h时,金黄色葡萄球菌与沙门氏菌的扩增条带较豆腐和面包弱;增菌14 h后,3 种食物中均可检出沙门氏菌,豆腐中已经可以检测出单核细胞增生李斯特氏菌;增菌20 h后,3 种食物中均可检出单核细胞增生李斯特氏菌。因此,经过20 h增菌培养,5 种致病微生物检出限均可达到100CFU/25 g。同时提取未接菌的食物样品DNA进行PCR扩增,结果显示未出现任何条带,说明所建立的多重PCR体系可适用于常见食品中这5 种致病微生物的快速检测。
通过观察食物基质加入培养基混匀后的状态,发现3 种食品中豆腐的加入对培养基的影响最小,无溶出物且形态保持不变,而面包浸于培养基后经过振荡破碎分散使培养基变得浑浊,香肠的加入则会在培养基表面形成明显的油脂层,对菌体的培养及菌液的收集造成影响,进一步影响提取DNA的质量,这可能是导致3 种食物基质中检测致病菌灵敏度差异的主要原因。在Lee等[23]进行的6 重PCR检测技术研究中也得到相似的实验结果,该研究以单核细胞增生李斯特氏菌、副溶血弧菌、沙门氏菌等致病菌污染辣子鸡、牡蛎和生菜,分别在SEB富集培养基中37 ℃培养4、8、12 h后,发现生菜中8 h即可检出6 种初始含量为100CFU/mL的致病菌,而在牡蛎中检出同样初始含量的单核细胞增生李斯特氏菌至少需培养12 h,在辣子鸡中同样初始含量的副溶血弧菌与沙门氏菌也需培养12 h才可以检出,可见食物基质的复杂性对检测方法的灵敏度会产生一定影响。
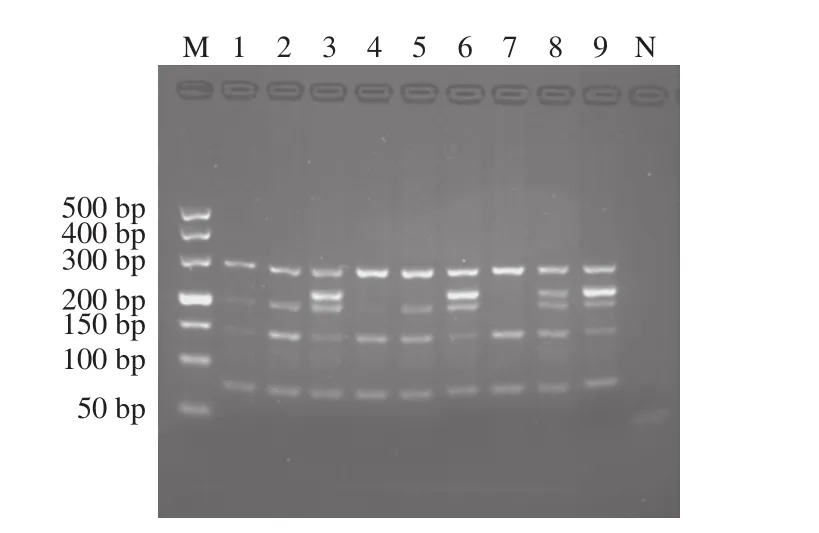
图5 人工污染香肠、面包、豆腐中5 种致病菌多重PCRFig. 5 Multiplex PCR detection of five artificially contaminated pathogens in sausage, bread and tofu
3 讨 论
传统致病菌检测工作量大、耗时长且操作繁琐,相比之下,多重PCR作为一种能够快速、同时检测多种致病菌的可靠手段,已在实际检测中得到广泛应用[24],随着PCR技术的日益发展与成熟,能够同时检测的微生物种类与检测灵敏度都在不断提高[25],在监测食品危害、保障食品安全方面具有良好的应用前景。本研究建立的多重PCR技术实现了同时检测食品中单核细胞增生李斯特氏菌、沙门氏菌、金黄色葡萄球菌、大肠杆菌O157:H7和霉菌,并成功应用于豆腐、香肠、面包3 种食品的检测,经增菌培养20 h后,5 种致病微生物的的检出限均可达到100CFU/25 g。
在多重PCR检测食源性致病菌的相关研究中,Zhang等[26]将建立的多重PCR方法应用于油菜叶等多种食物检测,增菌24 h后对大肠杆菌O157:H7、金黄色葡萄球菌、沙门氏菌、单核细胞增生李斯特氏菌4 种致病细菌的检出限可达到100CFU/mL。胡冰雪等[27]对人工污染的冷却肉进行过夜培养增菌,其荧光假单胞菌、沙门氏菌检出限可达101CFU/mL,而单核细胞增生李斯特氏菌的检出限为70 CFU/mL,这与本实验中检测单核细胞增生李斯特氏菌所需增菌时间最长的结果一致。冯可等[28]对初始染菌量为100CFU/g的鲜切果蔬进行增菌培养,而后采用多重PCR检测,包括单核细胞增生李斯特氏菌在内的4 种致病菌能检出的增菌培养时间为9 h,时间较短,这可能是由于其PCR体系中的Taq酶含量为1 U/μL,而本实验PCR体系中Taq酶含量仅为0.1 U/μL,虽然增加了检出时间,但降低了试剂成本。由于不同菌株间生长特性具有差异,往往还需对增菌培养基进行优化[29]。Kawasaki等[30]利用一种自制的培养基NO.17肉汤对接种量为101CFU/mL单核细胞增生李斯特氏菌进行培养,在24 h时活菌数相比于TSB培养基的2.9(lg(CFU/mL))提高为6.7(lg(CFU/mL))。本研究中采用营养肉汤对5 种微生物进行增菌,未来还将进一步对培养基进行选择优化以缩短增菌时间。
目前鲜见利用多重PCR法同时检测食品中致病细菌和霉菌的报道,本实验实现了多重PCR同时扩增检测4 种致病细菌和常见霉菌,该体系可检测曲霉、青霉等食品中常见的霉菌。之后可进一步研究建立食品中细菌与霉菌DNA的同时提取方法[31-32],最终实现食品中细菌与霉菌从培养到DNA提取、PCR扩增的同时检测。
4 结 论
本研究根据不同菌株的特异性基因设计引物,建立了一种能够同时检测大肠杆菌O157:H7、金黄色葡萄球菌、沙门氏菌、单核细胞增生李斯特氏菌4 种致病细菌及常见霉菌的多重PCR检测方法在香肠、豆腐和面包中,分别利用营养肉汤增菌9 h后,大肠杆菌O157:H7、金黄色葡萄球菌与霉菌的检出限可达到100CFU/25 g;增菌14 h后,沙门氏菌的检出限可达到100CFU/25 g;增菌20 h后,单核细胞增生李斯特氏菌的检出限可达到100CFU/25 g。该方法相较于传统的培养检测方法缩短了检测时间,并可同时检测食物中4 种致病细菌和常见霉菌,在食品卫生监督等领域具有较广阔的应用前景。
