牛源性非O157大肠杆菌的分离与鉴定
2019-03-11禹金龙王娴静姬赛赛付文静
禹金龙,董 晨,王娴静,姬赛赛,付文静,胡 洁,江 芸,*
(1.南京师范大学金陵女子学院,江苏 南京 210097;2.江苏省疾病预防控制中心,江苏 南京 210009)
大肠埃希氏菌(Escherichia coli)是埃希氏菌属的成员,属于革兰氏阴性菌兼性厌氧杆菌,从婴幼儿出生几个小时,便通过吞咽寄居在体内,与人类生活息息相关,一般情况下不会引起致病,是正常的肠道菌群[1]。但在机体抵抗力下降等情况下,大肠杆菌则通过肠道外途径进入其他部位,造成相应部位的感染,所以又称之为条件致病菌[2]。自从1885年发现以来,大肠杆菌在很长一段时间内一直被认为是人与动物胃肠道中的正常菌群,并无致病性,直到20世纪中期,有学者发现有些特殊的血清型对人、动物产生疾病[3-5],根据它们所引起的疾病类型,致病性大肠杆菌可以分为两大类:腹泻性大肠杆菌和肠道外致病性大肠杆菌。腹泻性大肠杆菌又可分为肠产毒性大肠杆菌、肠致病性大肠杆菌、肠侵袭性大肠杆菌、肠黏附性大肠杆菌、扩散附着大肠杆菌和肠出血性大肠杆菌/产志贺毒素大肠杆菌(Shiga toxin-producing E. coli,STEC)[6]。
在致病性大肠杆菌中,大肠埃希氏菌O157:H7感染剂量低、致病力强、危险性大、临床症状严重,其污染和危害已成为全球性广泛关注的公共卫生问题[7-8]。然而,由于长期以来缺乏相应有效的检测方法,人们更多关注O157,而非O157(non-O157)的危害性被低估甚至忽视。近年来国际上已越来越重视非O157的安全性,一些非O157对公众健康的威胁甚至高于O157,美国于2001年开始对non-O157 STEC施行主动监测[9]。据报道,美国1983—2002年发生的非O157的STEC感染者中,70%是由O26、O45、O103、O121、O111和O145血清型所致[10],美国疾病预防控制中心已经将这6 种血清型命名为“big six”non-O157 STEC[11]。2012年3月,美国农业部USDA宣布强制执行在初加工的牛肉制品中不得检出这6 大类“big six”非O157 STEC[12]。目前我国对非O157尚未引起广泛重视[13-16],对非O157的研究亦少见报道。
本实验参考美国农业部[17]及Svoboda等[18]的方法,调查牛粪和牛肉样本中非O157大肠杆菌的污染情况,并对大肠杆菌O157及非O157(O26、O103、O111、O121)进行分离鉴定,对阳性菌株进一步进行毒力基因(stx1、stx2、eae、hly)检测。目前国内鲜有关于非O157大肠杆菌污染情况的报道,本实验将为非O157大肠杆菌的食品安全和风险评估提供科学依据。
1 材料与方法
1.1 材料与试剂
153 份牛粪样品采自安徽省旌德县两家生态养牛场,49 份牛肉采自南京小型农贸市场,一共202 份样品。
本实验所用阳性对照菌大肠杆菌O157:H7一株(编号CICC 21530),非O157(O26、O103、O111、O121)DNA全基因组由江苏省疾病预防控制中心提供。
缓冲蛋白胨水、改良胰蛋白胨大豆肉汤(modified tryptic soy broth,mTSB)、胰蛋白胨大豆琼脂(tryptone soya agar,TSA)、酵母浸粉(yeast extract,YE)、半固体动力培养基、亚碲酸钾、头孢克肟、P-10A新生霉素、P-10B新生霉素 北京陆桥技术有限公司;TaqTM(with Mg2+free buffer)、100 bp DNA Marker、H抗原所用酶 大连宝生物(TaKaRa)工程有限公司;琼脂糖 北京天根生化科技有限公司;multiplex PCR kit 德国Qiagen公司;细菌基因组DNA提取试剂盒、4S Red染料 上海生工生物科技有限公司;rainbow agar培养基 美国Biolog公司;O26抗原、H11抗原等血清 日本生研公司。所有引物均由上海生工生物科技有限公司合成。
1.2 仪器与设备
Mastercycler personal聚合酶链式反应(polymerase chain reaction,PCR)仪 德国Eppendorf公司;GelDoc 2000 system凝胶成像仪 美国Bio-Rad公司;TCL-16G高速离心机 上海安亭仪器厂;DYY-2C琼脂糖凝胶电泳仪 上海天能科技有限公司;SG403A Sterile GDRD生物安全柜 美国Baker公司;生化培养箱 上海新苗医疗器械制造有限公司;拍打式均质器 青岛众瑞智能仪器有限公司。
1.3 方法
1.3.1 增菌培养
参考美国农业部[17]及Svoboda等[18]的方法,稍作调整,进行增菌培养:牛粪样品10 g、牛肉样25 g以料液比1∶9(g/mL)添加缓冲蛋白胨水于均质袋中,均质2~3 min,取10 mL均质液加入到含有40 mL mTSB的均质袋中,于42 ℃、220 r/min摇床中培养22 h。
1.3.2 增菌液DNA提取及多重PCR检测O血清型
取1 mL样品增菌液,按照说明书提取细菌DNA。采用多重PCR进行O抗原的鉴定[19]。PCR体系为25 μL,包括1 μL模板,PCR Master Mix 12.5 μL,O抗原引物(10 μmol/L)mix 2.62 μL,不足部分用水补齐。PCR条件:95 ℃预变性15 min;94 ℃变性30 s,61 ℃退火1.5 min,72 ℃延伸1.5 min,30 个循环;72 ℃延伸10 min。扩增后的PCR产物用1.2%琼脂糖凝胶电泳检测,凝胶成像观察结果。O血清型阳性样品进行进一步菌株分离纯化。
1.3.3 菌株分离纯化
上述O血清型阳性样品的增菌液,取一环划线于mRBA(添加0.05 mg/L头孢克肟,0.15 mg/L亚碲酸钾,5.0 mg/L新生霉素)培养基,在37 ℃培养箱培养24~36 h,按照mRBA说明书及美国农业部指导说明,挑取特征颜色菌落,在mRBA培养基上继续划线,经3 次分离纯化,挑取单菌落划线于非选择性培养基TSA-YE上保存。
1.3.4 细菌基因组DNA提取及血清型鉴定
将可疑菌株挑1 环于150 μL灭菌双蒸水中,涡旋,充分混匀。99 ℃水浴处理10 min,冰浴2 min,12 000×g离心2 min,吸取上清液即为细菌基因组DNA,-20 ℃冻存备用。
菌株O血清型的鉴定采用多重P C R进行,方法同上,对PCR阳性的菌株进一步采用血清凝集实验进行验证。鞭毛抗原分型采用PCR-限制性片段长度多态性方法[20]。扩增fliC基因所用的引物为:5’-CAAGTCATTAATACAAACAGCC-3’和5’-GACATATTAGAGACTTCGGT-3’。扩增fliC基因并用HhaI酶切,根据酶切图谱得出相应的鞭毛抗原类型。PCR体系为20 μL,包括0.3 μL模板,0.8 μL各引物(10 μmol/L),2 μL 10×Buffer(Mg2+free),2 μL Mg2+,2 μL dNTP,0.2 μLTaq酶,不足部分用水补齐。PCR条件:94 ℃预变性5 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸2 min,25 个循环;72 ℃延伸7 min。扩增后取PCR产物5 μL,加入HhaI酶及缓冲液,37 ℃酶切10 min后,取酶切液,在2%琼脂糖凝胶中,85 V电泳50 min。比对酶切产物图谱对照表确定H抗原类型。同时在半固体培养基中多次诱导,用血清凝集实验进行验证。
1.3.5 多重PCR进行毒力基因检测
O血清型阳性的菌株采用多重PCR进行stx1、stx2、eae、hly4 种毒力基因携带情况检测[21-22]。PCR体系为50 μL:10×PCR buffer 5 μL,dNTP 4 μL,MgCl25 μL,4 对引物(10 μmol/L)mix 9.4 μL,Taq酶0.25 μL,DNA模板1 μL,不足部分用水补齐。PCR程序:94 ℃预变性7 min;94 ℃变性40 s,56 ℃退火40 s,72 ℃退火40 s,25 个循环;72 ℃延伸5 min。PCR产物经1.4%琼脂糖凝胶电泳检测。PCR引物序列及扩增长度见表1。

表1 PCR引物序列及扩增长度Table 1 PCR primer sequences and amplification length
2 结果与分析
2.1 样品O血清型检测结果
如表2和图1所示,202 份样品多重PCR检出一条或多条阳性条带的样品共40 份(19.8%),牛粪阳性检出率为24.8%(38/153),牛肉阳性检出率为4.1%(2/49),牛粪检出率高于牛肉。其中非O157检出率为19.3%(牛粪37+牛肉2,39/202),O157的检出率为0.5%(牛粪1+牛肉0,1/202)。153 份牛粪样本中,总阳性样本38 份,O26有32 份,占20.9%,O121有7 份,占4.6%,O103有5 份,占3.2%,O157仅有1 份,占0.6%,49 份牛肉样品中仅发现2 份O26样本阳性,占4.1%,结果表明牛粪和牛肉中非O157大肠杆菌的阳性率均高于O157。
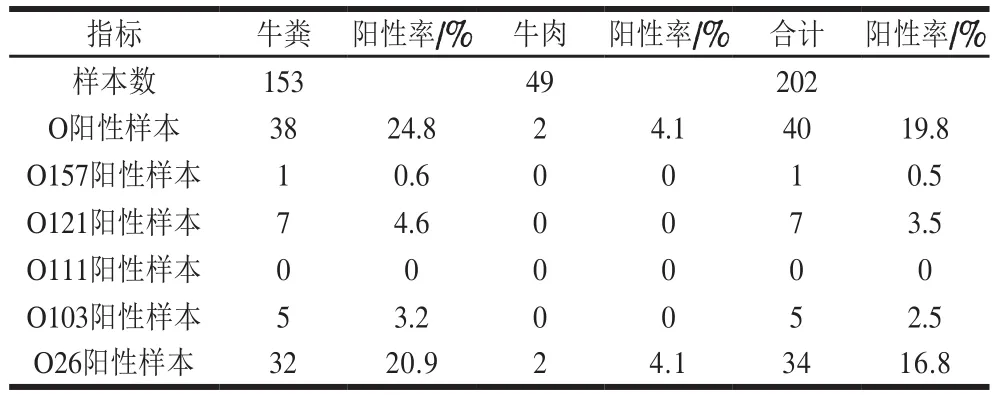
表2 牛肉及牛粪样本中大肠杆菌O血清型检出情况Table 2 Prevalence of E. coli O-groups in beef and fecal samples
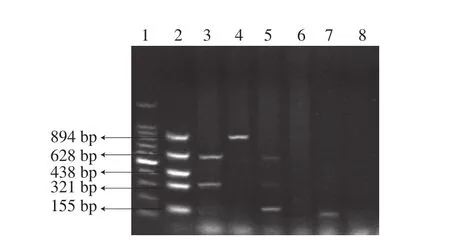
图1 部分牛粪样本增菌液O血清型多重PCR电泳图Fig. 1 Electrophoresis profile of multiplex PCR-amplified products for O-groups of some fecal enrichment broths
2.2 菌株O血清型检测结果

图2 部分菌株O血清型多重PCR电泳图Fig. 2 Electrophoresis profile of multiplex PCR-amplified products for O-groups of some isolates
阳性样本增菌液用mRBA选择性培养基3 次划线纯化后,煮沸法提取DNA后采用多重PCR和血清凝集实验共鉴定出阳性菌株30 株,包括5 种O血清型,其中O26占73.3%(22/30),O121占16.7%(5/30),O103占6.7%(2/30),O157占3.3%(1/30),O111未检出,部分菌株O血清型多重PCR见图2。结果显示O26是优势血清型。
2.3 菌株鞭毛抗原分型
经图谱对照及血清凝集实验验证,在O26中,O26:H11是主要污染菌株,占59.1%(13/22),其次是O26:H-,占22.7%(5/22),O26:H14与O26:H19均占9.1%(2/22)。2 株O103鞭毛抗原均为H2。5 株O121中,3 株为O121:H19,另2 株则为O121:H-。1 株O157为O157:NM。
2.4 毒力基因检测结果
如图3所示,分离自牛肉的2株O26:H11,1 株stx1、hly阳性(泳道3),另1 株hly阳性(泳道4),而牛粪分离菌中,仅发现1 株O26:H11菌株呈现hly阳性(泳道6)。因此,30 株菌株中带毒菌株阳性率为10.0%(3/30),非O157 STEC阳性率为3.4%(1/29)。
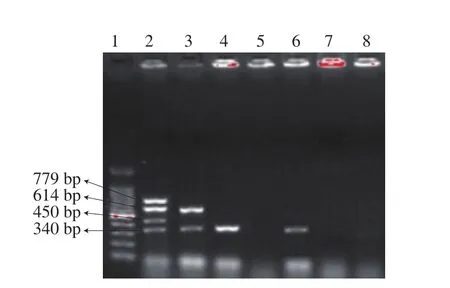
1. 1 000 bp ladder Marker;2.大肠杆菌O157:H7(CICC 21530);3.牛肉分离菌1;4.牛肉分离菌2;5.牛粪分离菌1;6.牛粪分离菌2;7.阴性对照菌DH5α;8. PCR阴性对照。
3 讨 论
近年来,关于非O157 STEC,尤其是“big six”STEC爆发流行的报道逐渐增多,国外尤其是发达国家对大肠杆菌“big six”的关注度越来越高,据美国疾病预防控制中心2010年报告,在非O157 STEC中,患病率依次为O26(22%)、O111(16%)、O103(12%)、O121(8%)、O45(7%)和O145(5%)[23],与O157患病率大体一致,表明非O157 STEC对人类的健康威胁不容忽视。然而我国对非O157 STEC尚未引起足够重视。
反刍类动物,如牛、羊,是非O157 STEC的主要宿主,在屠宰过程中,通过去皮或去内脏等污染肉类,牛粪中STEC是污染动物性食物的主要来源[24-25]。牛源性非O157 STEC的流行数据尚未完善,原因在于分离鉴定非O157 STEC方法尚未标准化,如何有效地从含有大量背景菌中的粪便中分离出目的菌株,对选择性增菌液以及分离纯化培养基有着较高的要求[26],Zelyas等[27]对4 种显色培养基分离非O157 STEC的效果进行了评价,表明mRBA培养基与CHROMagar™STEC培养基能有效分离非O157 STEC。本实验参考美国农业部[17]及Svoboda等[18]方法,采用多重PCR方法,预先筛选非O157阳性样本,再利用mRBA培养基分离筛选,挑取特征颜色菌落,并进一步鉴定。有研究报道从食品安全角度考虑,先采用多重PCR检测毒力基因进行初筛,再对毒力基因阳性的样本进行分离鉴定,而本实验目的是了解我国非O157大肠杆菌的污染情况,故对毒力基因阴性的样本也进行调查。
Elder等[28]研究发现牛粪中肠出血性大肠杆菌O157的污染与牛胴体污染情况存在显著正相关,其他较多研究也表明粪便中非O157 STEC会导致牛肉受到一定污染[24-25]。因此本实验牛粪中较高的检出率,提示其相应牛肉及其制品存在着一定安全风险。然而粪便中致病菌污染牛肉由于屠宰加工过程中屠宰环境、屠宰工艺、卫生管理等不同,其污染概率亦不相同,所以有必要加强其屠宰加工的卫生管理,以有效控制其牛肉产品的安全。
非O157大肠杆菌的污染调查,国外已有较多报道,本实验发现非O157的污染率明显高于O157,这与Svoboda等[18]的报道相似。较多关于非O157 STEC污染情况有不同的报道,牛粪中非O157 STEC的检出率为0.0%~16.9%[29-31]。牛肉中非O157 STEC污染调查也有不同报道,有的报道检出率较高,达到15.5%~33.3%,如Koohmaraie[32]、Barlow[33]、Auvray[34]等的研究报道。然而还有一些非O157 STEC低检出率的报道,如Jiang Yun等[35]调查美国小型牛肉加工厂非O157 STEC检出率为3.5%,欧洲食品安全局[36]关于欧盟食品中检出率为0%~5.9%。Hussein等[37]发现屠宰的牛非O157 STEC检出率在2.1%~70.1%之间,环境因素、管理措施等可能会影响STEC污染率的变化。本实验非O157 STEC检出率为3.4%,但采样地点和样本量均有限,尚需加大调查规模和监测力度才能更全面反映我国非O157大肠杆菌尤其是非O157 STEC的污染情况。
大肠杆菌O157和非O157感染剂量低、致病力强,虽然不耐热,但肉在加工烹调过程中(如生熟未分开)、肉熟制后的包装过程、熟肉制品的再次切配等均可能存在交叉污染,因此在实际生产、销售及家庭加工过程中仍应该重视其安全防范。
4 结 论
牛粪和牛肉中非O157大肠杆菌的污染率明显高于O157,尤其是O26:H11血清型最高,且检出含志贺毒素基因的菌株,这提示零售牛肉市场存在非O157大肠杆菌污染的安全风险,应加大对小型农贸市场肉类食品监管,改善生产销售条件,预防大肠杆菌的污染。
