Cocktail探针药物法评价胃炎灵颗粒对大鼠体内CYP450活性的影响
2019-03-11冯星月蒋志涛张咏梅
冯星月,余 辉,蒋志涛,张咏梅*
0 引言
胃炎灵颗粒是张家港市中医医院的院内制剂,由白芍、枳实、栀子、香附、郁金等组成。具有疏肝理气、清肝泻热、解痉止痛之功效,主治胆汁反流性胃炎。CYP450酶是药物体内代谢的重要酶系[1],其中6种重要的CYPs亚型-CYP2D6、CYP3A4、CYP2C19、CYP1A2、CYP2E1、CYP2C9参与了约90%的临床使用药物的代谢,CYP450酶被诱导或抑制是产生药物相互作用的重要原因之一[2]。因此,推断胃炎灵颗粒与其他药物联用时,可能会出现此现象。“Cocktail”探针药物法是目前研究CYP450亚型酶活性的常用方法,能快速有效地评价药物之间是否产生相互作用[3]。胃炎灵颗粒由中医经验方制成,且成分较为复杂,未见其对P450酶活性影响的报道。因此,本实验采用混合探针法,参考相关文献[4-11],分别选用右美沙芬(CYP2D6)、咪达唑仑(CYP3A4)、奥美拉唑(CYP2C19)、茶碱(CYP1A2)、氯唑沙宗(CYP2E1)、甲苯磺丁脲(CYP2C9)6种探针药物,考察胃炎灵颗粒在大鼠体内对6种CYP450亚型酶活性的影响,预测其存在药物相互作用的可能性,以提高临床合并用药的安全性,为胃炎灵颗粒的合理利用提供理论依据。
1 材料
1.1 药品与试剂 胃炎灵颗粒(张家港市中医医院制剂室,规格:10 g/袋,批号:20170206);咪达唑仑注射液(江苏恩华药业股份有限公司,批号:20140602,规格:2 ml/10 mg);注射用奥美拉唑钠(江苏奥赛康药业有限公司,批号:15051811,规格:40 mg/支);右美沙芬对照品(批号:097K11348)、咪达唑仑对照品(批号:171270-201402)、奥美拉唑对照品(批号:BCBF-2161V)、替硝唑对照品(批号:10036-200703)、茶碱批号对照品(T1633)、氯唑沙宗对照品(批号:017K1385)、甲苯磺丁脲对照品(批号:017K1025)、吡罗昔康对照品(批号:100177-200603),其中咪达唑仑、替硝唑、吡罗昔康对照品为中国药品生物制品检定所提供,奥美拉唑、右美沙芬、茶碱、氯唑沙宗、甲苯磺丁脲购自美国Sigma公司;甲醇、乙腈为色谱纯,其余均为分析纯。
1.2 仪器 Waters Quattro Micro液质联用仪(美国Waters公司),Masslynx 4.1色谱工作站;MS105电子天平(上海梅特勒-托利多有限公司);TGL-16G离心机(上海安亭科学仪器厂);IKA Vortex Genius涡旋混合仪(德国IKA公司);Labconco离心浓缩仪(美国Labconco公司);SCQ-250超声波清洗器(上海盛普机械制造有限公司);Drict-Q5超纯水机(美国Millipore公司)。
1.3 动物 健康雄性SPF级SD大鼠6只,由南京市江宁区青龙山动物繁殖场提供,体重(240±20) g,合格证编号:SCXK(苏)2017-0001。动物饲养环境温度20~25 ℃,相对湿度50%~60%,自然光照。
2 方法
2.1 色谱条件 色谱柱:ACQUITYTM UPLC BEH C8色谱柱(2.1 mm×50 mm,1.7 μm);流动相:4 mmol/L甲酸铵+0.1%甲酸水溶液-乙腈(25/75,V/V);流速:200 μl/min;进样量:5 μl;柱温:30 ℃。
2.2 质谱条件 采用电喷雾离子化方式(ESI),毛细管电压为3 500 V,离子源温度120 ℃,干燥气温度350 ℃,干燥气体流速500 L/h。多反应离子监测模式(MRM)。正离子模式监测:替硝唑(内标)、右美沙芬、咪达唑仑、奥美拉唑;负离子模式监测:吡洛昔康(内标)、茶碱、氯唑沙宗、甲苯磺丁脲。①替硝唑:m/z 248.1/121.1,锥孔电压30 V,碰撞能力15 eV;②右美沙芬:m/z 272.1/171.1,锥孔电压45 V,碰撞能力35 eV;③咪达唑仑:m/z 326.0/291.0,锥孔电压35 V,碰撞能力28 eV;④奥美拉唑:m/z 346.0/198.0,锥孔电压40 V,碰撞能力15 eV;⑤吡罗昔康:m/z 330.2/146.2,锥孔电压25 V,碰撞能力为20 eV;⑥茶碱:m/z 179.0/164.1,锥孔电压30 V,碰撞能力20 eV;⑦甲苯磺丁脲:m/z 168.0/132,锥孔电压35 V,碰撞能力20 eV;⑧氯唑沙宗:m/z 168.0/132.0,锥孔电压30 V,碰撞能力18 eV。
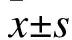
2.4 溶液的配制
2.4.1 Cocktail探针药物溶液配制 分别称取6种探针药物适量,加入适量0.5%羧甲基纤维素钠研磨混匀,用生理盐水定容至50 ml棕色量瓶中,得含茶碱、苯磺丁脲、右美沙芬、氯唑沙宗、咪达唑仑、奥美拉唑钠浓度分别为0.5、0.4、0.6、1.2、0.4、0.8 mg/ml的混合探针药物溶液。此步骤所得溶液临用前配制。
2.4.2 混合对照品、内标及质控溶液配制 精密称取各探针药物对照品适量,于同一10 ml量瓶中,加甲醇定容,配制成含茶碱、氯唑沙宗、甲苯磺丁脲、右美沙芬、奥美拉唑、咪达唑仑分别为564、720、408、10.24、10、10.76 μg/ml的混合储备液。临用时按倍比稀释法配制成一系列浓度的甲醇混合对照品工作液。精密移取上述储备液,临用时依次配制成高、中、低3种不同质量浓度的甲醇质控溶液供分析用。
精密称取内标替硝唑和吡罗昔康对照品适量,于同一10 ml量瓶中,加甲醇溶解,摇匀定容,得混合内标溶液。精密吸取上述溶液,加甲醇稀释,得到替硝唑终浓度为1.6 μg/ml、吡罗昔康终浓度为24.2 μg/ml的混合内标工作液,于4 ℃冷藏备用。
2.4.3 大鼠灌胃药物的制备 精密称取胃炎灵颗粒12.5 g于50 ml量瓶,加入0.5%羧甲基纤维素钠溶液适量,搅拌使其溶解,再定容至刻度,超声处理10 min,即得。
2.5 动物给药方法 6只大鼠适应性饲养1周,为了避免个体差异的干扰,采用自身对照法,进行前后两轮对比实验。第1轮,每天上午灌胃混合探针药物10 ml/kg,给药前12 h禁食不禁水,分别于给药前和给药后0.083、0.167、0.333、0.667、1、1.5、2、2.5、3、5、8、12、24 h从眼底静脉丛采血,4 000 r/min离心10 min后,吸取上清液于-20 ℃保存待用。第1轮结束后,进行第2轮实验,每天上午灌胃胃炎灵颗粒(4 g/kg),连续灌胃10 d,于第11天上午再次灌胃探针药物,大鼠给药剂量、取血时间点及全血处理方法均与第1轮相同。
2.6 血浆样品处理方法 参考文献[4]处理血浆样品,取100 μl大鼠血浆样品,加入10 μl混合内标工作液(替硝唑终浓度为1.6 μg/ml、吡罗昔康终浓度为24.2 μg/ml),涡旋混匀30 s,加入800 μl
的乙酸乙酯,涡旋混匀3 min,以12 000 r/min的转速离心10 min,吸取上清液于2 ml离心管中,40 ℃水浴条件下氮气吹干,残渣用100 μl 50%的甲醇水复溶,涡旋混匀3 min,12 000 r/min离心10 min,取上清进样5 μl检测。
3 结果
3.1 色谱行为 此色谱条件下,6种探针药物与内标分离良好,且血浆测定中无杂峰干扰,基线平稳(见图1~图3)。表明该测定方法特异性良好,能准确测定血浆中右美沙芬、咪达唑仑、奥美拉唑、茶碱、氯唑沙宗、甲苯磺丁脲的浓度,且重现性好。
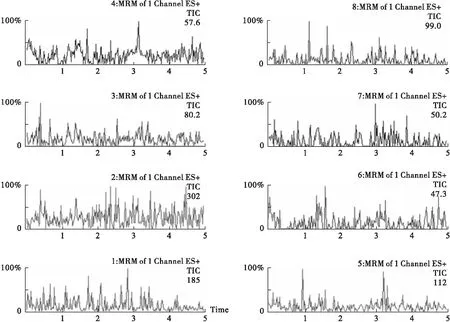
图1 空白血浆色谱图
3.2 标准曲线 取空白血浆100 μl数份,加入“2.4.2”项下方法配制的一系列工作液10 μl,再加入混合内标10 μl,按“2.6”项下方法加入混合内标之后的方法处理。根据血浆标准曲线所测结果,以各探针药物的质量浓度为X、各成分的峰面积与相应内标的峰面积比值为Y、1/x2为加权因子,进行线性回归分析,得回归方程。见表1。
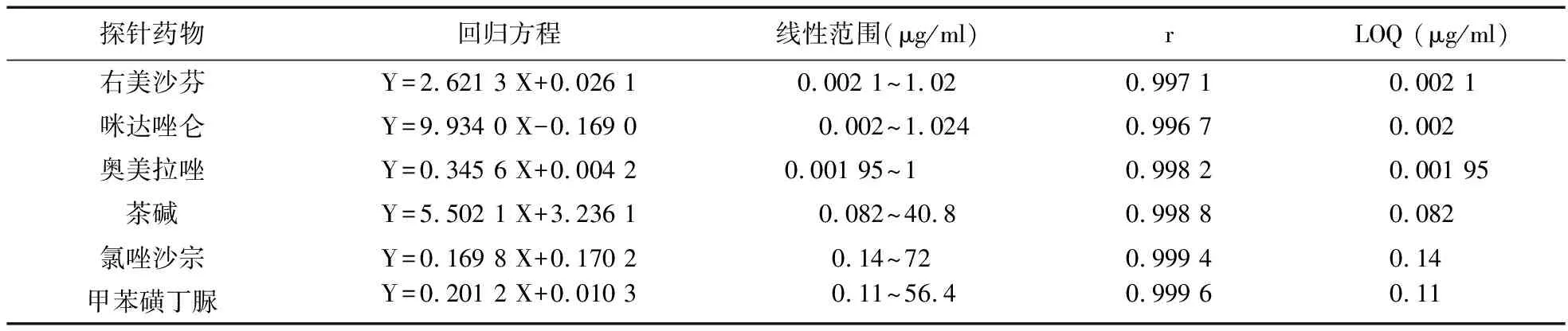
表1 6种探针药物的线性关系及定量限LOQ考察(μg/ml,n=6)
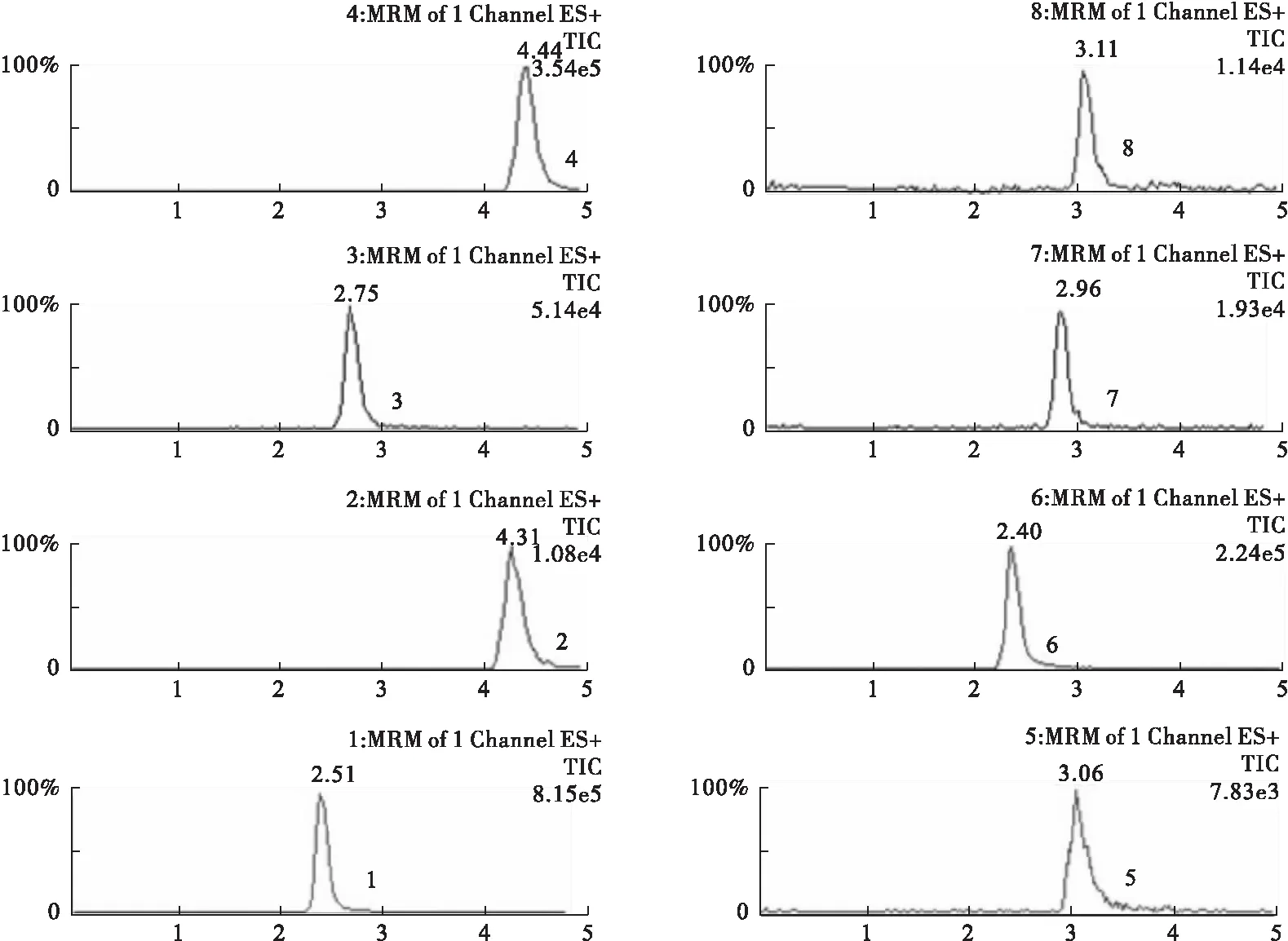
图2 空白血浆+混合探针+混合内标色谱图
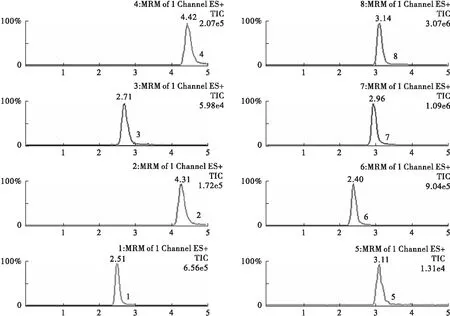
图3 1 h后的血浆样本各探针药物及内标的代表性色谱图
3.3 精密度 按“3.2”项下方法制备含6种探针药物的高、中、低浓度的含药血浆,每个浓度平行5份,按“2.6”项下方法处理样品,测定对照品峰面积As,及内标峰面积Ai,与标准曲线同日测定,日内重复测定5次,连续测定3 d,通过峰面积比值As/Ai,计算日内、日间精密度,结果见表2。
3.4 提取回收率与基质效应 按“3.3”项下方法制备高、中、低3个质控浓度的含药血浆,每个浓度平行3份,按“2.6”项下方法处理样品,测得各对照品及内标的峰面积为A。另取空白大鼠血浆100 μl数份,按照“2.6”项下方法操作,在乙酸乙酯萃取后吸取的上清液中加入对应浓度的混合对照品溶液和内标,同法操作,得峰面积B。另取上述与浓度相同的质控混合溶液和混合内标,按“2.6”项下“氮气吹干”后方法操作,得峰面积C。A/B为提取回收率,B/C为基质效应。结果见表2,提取回收率及基质效应均符合要求。
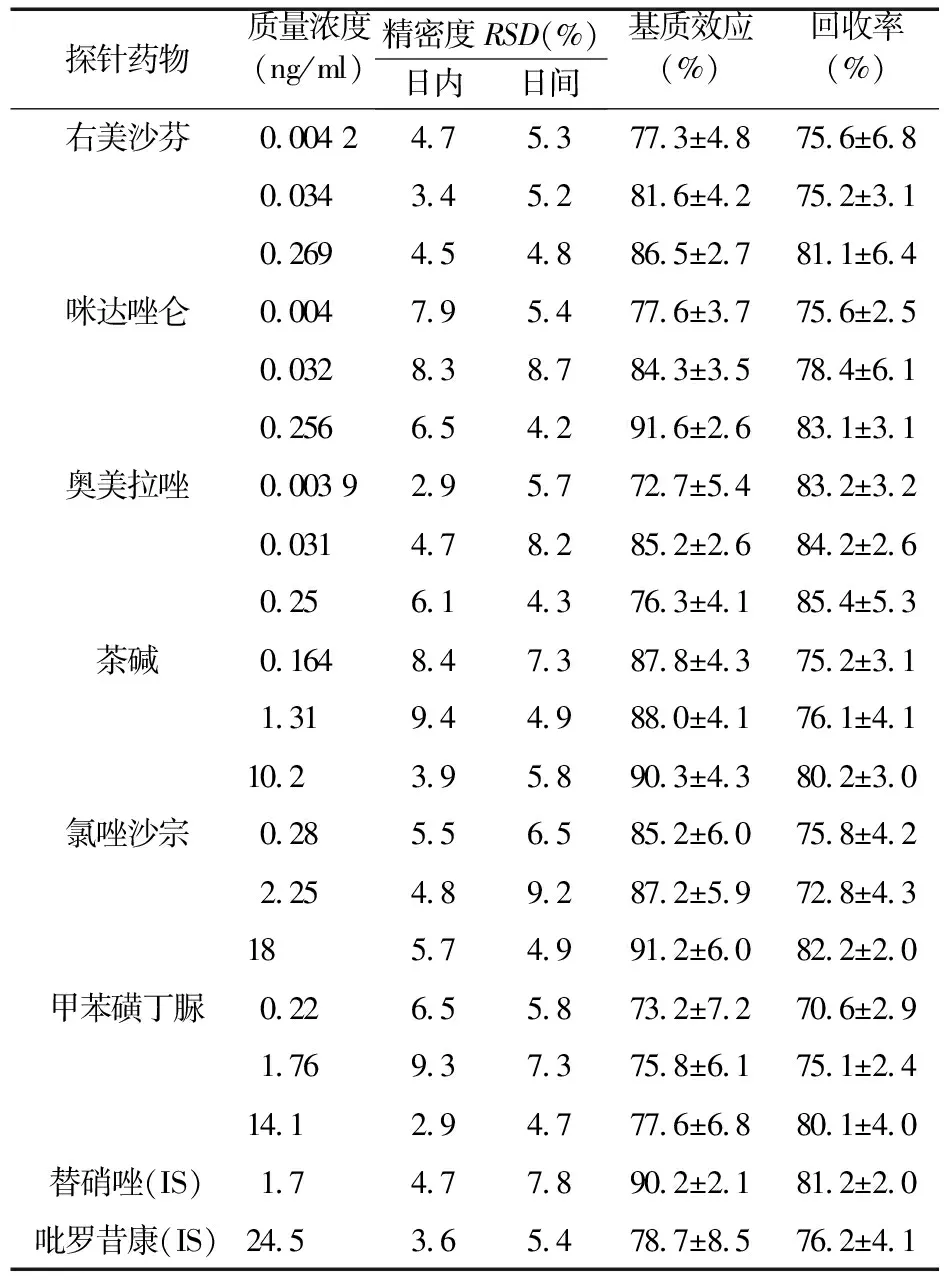
表2 6种探针药物在血浆中的准确度、日内日间精密度、回收率和基质效应(n=5)
3.5 稳定性 取“2.4.2”项下方法制备的中浓度质控溶液,按“2.1”项下的分析条件,对在室温下0、1、2、4、8、24 h及在4 ℃保存2个月的样品进行测定,记录峰面积,计算各个探针药物浓度的RSD;另取“3.3”项下制备的含中浓度混合探针药物的血浆,按“2.5”项下的血浆样品处理方法及“ 2.1”项下的分析条件,对在室温下 0、1、2、4、8、24 h及在-20 ℃内冷冻保存7 d 内的样品进行测定,记录峰面积,计算各个混合探针药物浓度的RSD。结果表明,6种探针药物的稳定性良好。
3.6 药动学参数
3.6.1 6种探针药物的药-时曲线图 大鼠连续灌胃胃炎灵颗粒10 d前后灌胃混合探针药物,按“2.5”项下血浆样品处理方法及“2.1”项下的分析条件,得6种探针药物的药-时曲线图,见图4。
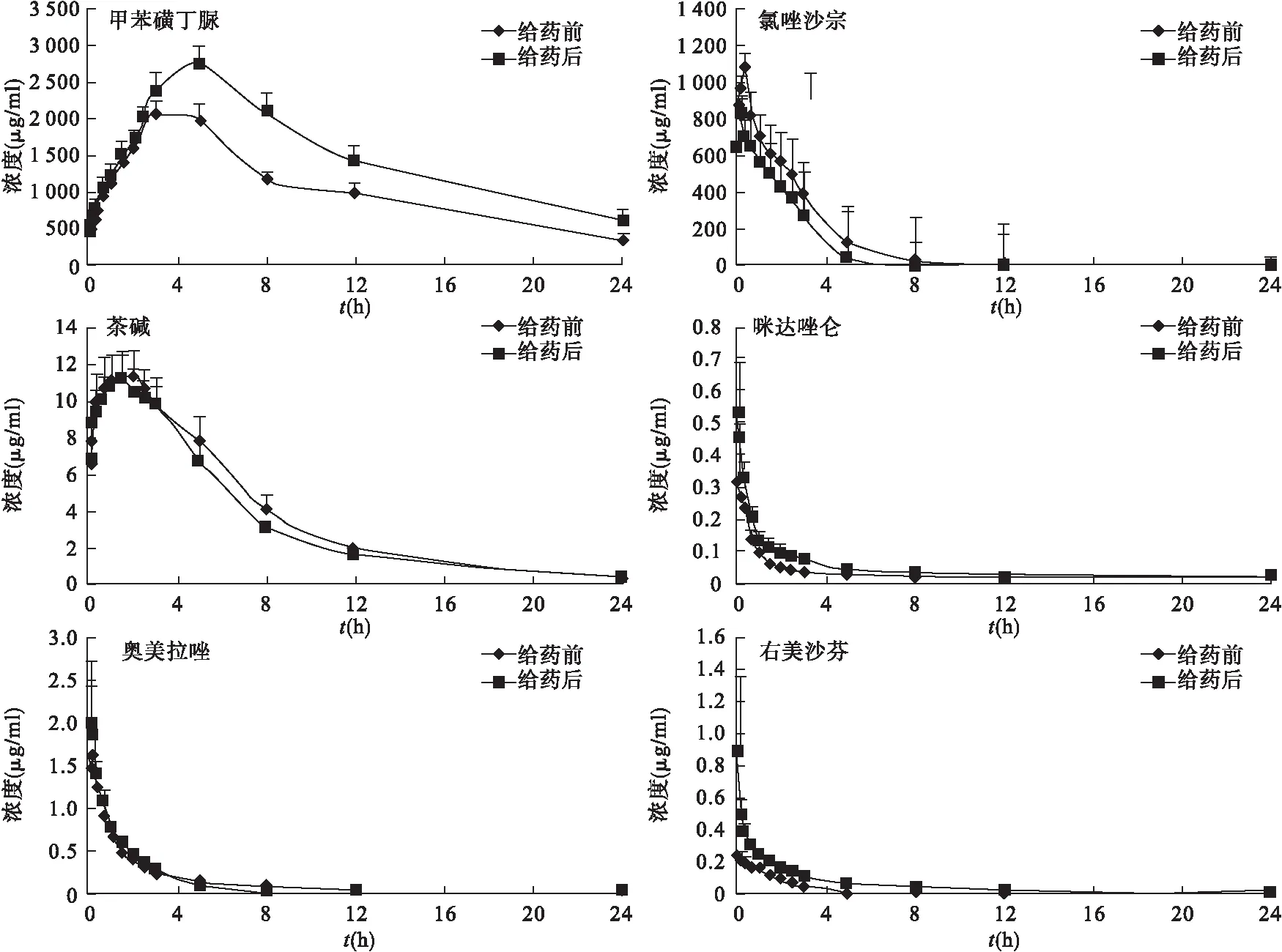
图4 6种探针药物给药前后的药-时曲线
3.6.2 6种探针药物的药动学参数 6只大鼠前后两轮药代动力学数据经DAS 1.0软件处理,右美沙芬符合一室模型(W=1/C),咪达唑仑符合二室模型(W=1),奥美拉唑符合一室模型(W=1),茶碱和甲苯磺丁脲符合一室模型(W=1/CC),氯唑沙宗符合二室模型(W=1/CC)。6种探针药物的主要药动学参数见表3。
4 讨论
通过参考文献中6种CYP450亚型探针底物右美沙芬、咪达唑仑、奥美拉唑、茶碱、氯唑沙宗和甲苯磺丁脲的检测方法[4-11],本实验建立了生物样品中6种探针药物含量的LC-MS-MS检测方法;采用“Cocktail”法评价胃炎灵颗粒对大鼠体内CYP450酶6种亚型的影响。有报道,大鼠常被用来研究CYPs酶活性,预测有可能产生的抑制或诱导药物相互作用[12],这主要是因为大鼠体内参与代谢的主要酶亚型与人类相似[13]。本实验采用整体动物自身对照的方法,均选用雄性SD大鼠,由于雄性大鼠体内CYP3A的活性与人体相似且较雌性大鼠高5~10倍[13],此方法更有说服力,并且将动物个体间的遗传代谢差异降低到最小[14]。笔者参考文献[6],确定6种探针药物在体内不存在潜在代谢性相互作用,且实验设计基本符合Cocktail法的条件。
由表4可知,甲苯磺丁脲CL/F降低31%,Cmax、AUC0-t、AUC0-∞依次升高约1.33、1.43、1.38倍(弱抑制剂的1.25~2倍[15]),差异有统计学意义(P<0.01)。氯唑沙宗Tmax、Cmax、AUC0-t、AUC0-∞依次降低约48%、23%、31%、31%(P<0.01)。奥美拉唑Cmax、AUC0-t、AUC0-∞依次升高约1.22、1.01、1.02倍(P<0.05)。右美沙芬CL/F、Cmax、AUC0-t、AUC0-∞依次升高约2.7、3.78、2.22、2.18倍(中强抑制剂的2~5倍[15])(P<0.01)。茶碱Tmax、Cmax、AUC0-t、AUC0-∞均略有降低,但差异无统计学意义(P>0.05)。咪达唑仑Cmax、AUC0-t、AUC0-∞略有升高,但差异无统计学意义(P>0.05)。
综上所述,胃炎灵颗粒连续给予10 d后,右美沙芬、甲苯磺丁脲在大鼠体内的浓度升高,代谢减慢。结果表明,胃炎灵颗粒对CYP2D6有中强抑制作用,对CYP2C9有弱抑制作用。氯唑沙宗在大鼠体内的浓度降低,代谢加快,表明胃炎灵颗粒对CYP2E1有弱诱导作用。咪达唑仑、奥美拉唑和茶碱的代谢变化不明显,表明胃炎灵颗粒对CYP3A4、CYP2C19、CYP1A2基本没有影响。由本试验结果推测,胃炎灵颗粒可能对CYP2E1有诱导作用,对CYP2D6、CYP2C9有抑制作用,因此在临床上胃炎灵颗粒与其他经CYP2D6、CYP2C9、CYP2E1代谢的药物合用时,应考虑对其代谢的影响。为了避免由代谢性相互作用导致的药物疗效降低或毒副作用,提高临床用药的安全性和有效性,应充分考虑两者合用的剂量。
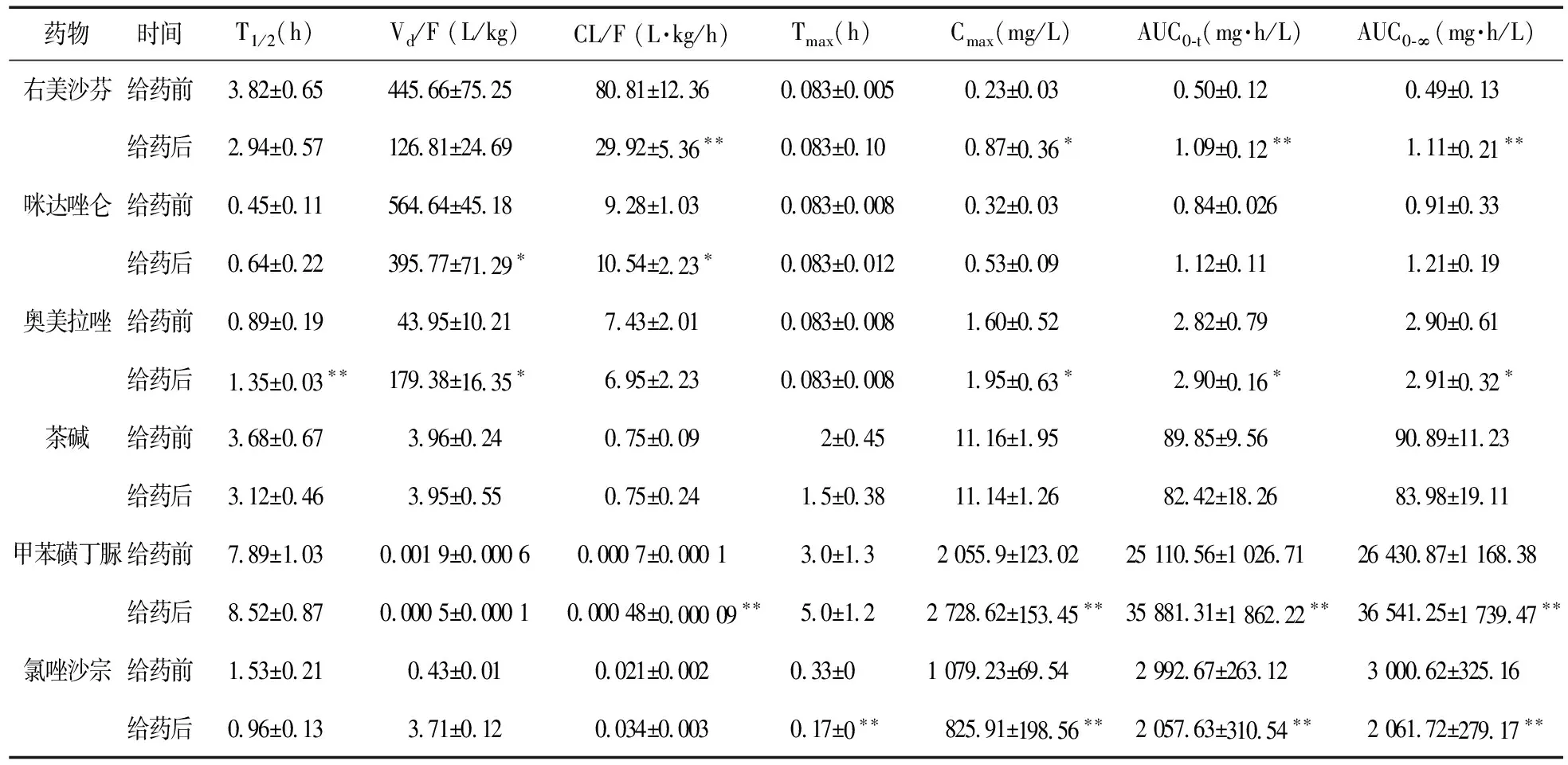
表3 6种探针药物的主要药动学参数(n=6)
注:与给药前比较,*P<0.05,**P<0.01
