核转录因子-κB-基质金属蛋白酶-9 信号通路在急性一氧化碳中毒迟发性脑病中的作用
2019-03-08彭红艳辜刚凤雷蕊绮蒋力吕霞吴沙李经伦
彭红艳 辜刚凤 雷蕊绮 蒋力 吕霞 吴沙 李经伦
西南医科大学附属医院神经内科(四川泸州646000)
急性一氧化碳中毒已成为全球中毒死亡的主要原因之一。幸存的患者中,约有10%~30%的人在数天或数周的“假愈期”后出现迟发性脑病,表现为学习记忆力减退、精神行为异常、震颤麻痹综合征等神经系统后遗症[1-2]。近期研究表明急性一氧化碳中毒迟发性脑病(delayed encephalopathy after acute carbon monoxide poisoning,DEACMP)的发病机制与缺氧缺血、氧化应激、炎症与免疫、细胞凋亡等有关[3-4]。CO 通过与血红蛋白结合导致组织缺氧,从而诱发氧化应激和炎症反应。氧化应激信号转导通路主要有核转录因子-κB(nuclear transcription factor-κB,NF-κB)、P38MAPK、JNK∕SAPK等[5-6],其中NF-κB的激活是最原始的信号激活事件[7-8],而基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)是其下游的重要炎症因子,可通过改变突触可塑性影响学习记忆力。赵喆等[9]研究表明糖尿病可通过激活NF-κB-MMP-9信号通路,参与糖尿病认知功能障碍,且MMP-9 与糖尿病认知功能障碍呈正相关。DEACMP 亦存在认知功能障碍,MMP-9与该病的关系在突触重塑方面暂不明确,故本研究通过建立DEACMP大鼠模型动态观察海马神经元形态学、突触超微结构、大鼠行为学变化来探讨NF-κB-MMP-9信号通路在其发病机制中的作用。
1 材料与方法
1.1 主要实验试剂及仪器 体积分数为99.9%的CO 气体(西南化工研究所);吡咯烷二硫代氨基甲酯(PDTC,美国sigma 公司);兔抗NF-κB 抗体(#8242,CST);鼠抗MMP-9 抗体(AB58803,abcam);Morris 水迷宫跟踪分析系统(西南医科大学公共卫生学院)等。
1.2 实验方法
1.2.1 动物分组 成年健康雄性SD 大鼠[体质量(250±20)g,清洁级]150 只(西南医科大学实验动物中心)随机分成3 组:空气组(AC 组)、CO 中毒组(CO 组)、PDTC + CO 中毒组(PC 组),每组50 只,各组大鼠按染毒后第1、3、7、14、21 天均分为5 个亚组。
1.2.2 建立动物模型 参照何林等[4]的方法采用改良式腹腔注射法复制DEACMP 模型。CO 组大鼠首次按100 mL∕kg 注射CO 气体,此后每间隔4 h注射1 次,追加剂量为每次50 mL∕kg,共注射4次。AC 组大鼠采用同样方法注射等量空气。PC组于复制DEACMP 模型前1 h 腹腔注射PDTC 100 mg∕kg,造模后每天注射1 次,直至处死。
1.2.3 Morris 水迷宫实验 参照MORRIS 等的方法行水迷宫实验,包括定位航行和空间探索两部分。定位航行试验检测大鼠学习记忆能力,主要观察大鼠平均逃避潜伏期。空间探索实验检测大鼠空间位置记忆能力,主要检测大鼠穿越平台次数。
1.2.4 取材 将3组大鼠于各时间点随机选取一半(5只)断头处死后于冰面上分离海马组织,其中3对放入-80 ℃冰箱中备用,另2对放入2.5%戊二醛磷酸缓冲液固定。另一半大鼠于腹腔注射10%水合氯醛(3 mL∕kg)进行麻醉,经生理盐水(9 g∕L,200 mL)灌注、多聚甲醛(4%,300 mL)固定后剥离取脑。
1.2.5 组织学检测 常规石蜡包埋、切片,予以脱蜡,然后用乙醇脱水,行HE 染色,于光镜下观察海马CA3 区细胞形态学变化。
1.2.6 RT-PCR 检测MMP-9 基因表达 按Trizol抽提试剂说明书进行提取样本中MMP-9 总RNA,cDNA 第一链合成试剂盒进行反转录。以磷酸甘油醛脱氢酶(GAPDH)为内参,应用SYBR Green 法进行实时荧光定量PCR 检测MMP-9 mRNA 表达水平。引物序列及扩增产物长度见表1。

表1 引物序列及扩增产物长度Tab.1 Primer sequence and length of amplified product
1.2.7 免疫荧光检测NF-κB、MMP-9 的表达 石蜡切片经脱蜡、梯度乙醇脱水后,于PBS 缓冲液中漂洗,然后置于EDTA 缓冲液中微波修复,经BSA封闭。先后加入一抗、二抗,DAPI 染液,漂洗后用抗荧光淬灭剂封片,及时在荧光显微镜下观察并采集图片。
1.2.8 Western Blot 检测NF-κB、MMP-9 的表达 将备用的海马组织剪成小块置于匀浆器中制备匀浆,超声裂解组织,离心后测定蛋白浓度,SDS-PAGE 凝胶电泳,经过转膜、封闭、抗体孵育后,用Western blot 发光检测试剂盒显影、定影,凝胶成像系统收集图像,最后进行分析。
1.2.9 透射电镜观察海马神经元突触变化 将已被2.5%戊二醛磷酸缓冲液固定的海马组织于1%四氧化饿中固定至标本变黑。丙酮梯度脱水、包埋,切片后染色(柠檬酸铅和醋酸铀双重染色),于透射电子显微镜下观察标本的超微结构。
1.3 统计学方法 计量资料用x ± s表示,应用SPSS 23.0 软件进行数据分析。水迷宫实验数据用重复测量资料的方差分析,免疫荧光、RT-PCR 多组间比较采用单因素方差分析,组间两两比较用SNK-q检验。P<0.05 为差异有统计学意义。
2 结果
2.1 模型建立 CO 组大鼠首次注射CO 时,大多数呼吸急促,易激惹,到处乱窜,冲撞鼠笼(部分大鼠有唇鼻部撞伤),少数精神萎靡,肢体瘫软,活动减少,喜蜷缩于角落。随CO 的追加,部分大鼠出现肢体抽搐,伴大小便失禁,部分大鼠反应迟钝,嗜睡,甚至昏迷,将大鼠置于空气中后,意识障碍轻者可逐渐恢复,重者仍死亡。病死率为8∕150,其中CO 组6 只,PC 组2 只,AC 组无死亡,死亡大鼠予以备用大鼠补充。造模过程中可见大鼠口唇黏膜、鼻部呈现樱桃红色。PC 组大鼠表现与CO组类似,AC 组未出现上述变化。
2.2 Morris 水迷宫实验 AC 组与PC 组大鼠运动轨迹趋势与之相反。CO 组大鼠于1、3、7 d 时平均逃避潜伏期、穿越平台次数与AC 组、PC 组比较差异均无统计学意义(P>0.05),14 及21 d 时大鼠平均潜伏期较AC 组、PC 组显著延长(P<0.05),穿越平台次数明显减少(P<0.05)。PC 组与AC 组比较差异亦有统计学意义(P<0.05)。
2.3 HE 染色 AC 组大鼠海马CA3 区神经细胞排列紧密,细胞层厚度正常,神经元呈圆形或椭圆形,核膜完整,核仁清晰,细胞核呈淡蓝色,各时间点无明显变化。CO 组大鼠神经细胞随时间变化逐渐发生凋亡、坏死,于第7~14 天明显,主要表现为神经元胞体皱缩,胞浆呈嗜伊红,核仁深染偏位,甚至发生核固缩、核碎裂,胞质与胞核界限不清,细胞周围出现空隙(图1)。PC组病变程度介于两者之间。

图1 第14 天海马CA3 区凋亡神经元(×400)Fig.1 The apoptosis of neurons in hippocampal CA3 area at 14th day(×400)
2.4 RT-PCR CO 组大鼠于第3 天时MMP-9 mRNA 扩增达高峰,7 d 时开始减少。PC 组各时间点MMP-9 mRNA 均低于CO 组(P<0.05),但仍高于AC 组(P<0.05,图2)。
2.5 免疫荧光 CO 组NF-κB 的表达呈增高(1 d)-快速增高(3 d)-缓慢增高的趋势(图3)。MMP-9的表达呈染毒后先增高(3 d 峰值),再降低(7 d)的趋势(图4)。PC 组NF-κB、MMP-9 的表达均受到限制,与CO 组、AC 组比较差异均有统计学意义(P<0.05)。
2.6 Western Blot 检测 AC 组大鼠各时间点海马区NF-κB、MMP-9 表达极少,且无明显变化(P>0.05)。CO 组及PC 组随时间变化发生显著变化(P<0.05),见图5。
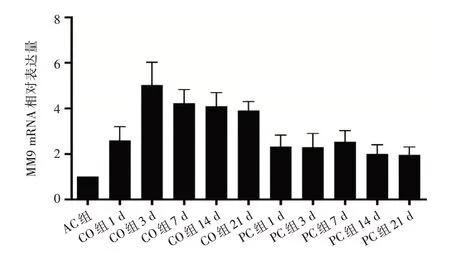
图2 各组大鼠不同时间点MMP-9 mRNA 的表达Fig.2 The expression of MMP-9 mRNA at different time point in each group rats
2.7 电镜下突触超微结构 AC 组各时间点神经元突触无显著异常。CO 组:1 ~3 d 大鼠海马神经元突触无明显变化,7 ~21 d 时逐渐出现突触前后膜肿胀,突触小泡稀疏、减少,各种程度的细胞质、线粒体水肿,线粒体棘减少且排列紊乱,突触间隙变窄、模糊不清(图6),上述表现于第14 天最明显。PC 组病变程度介于另两组之间。
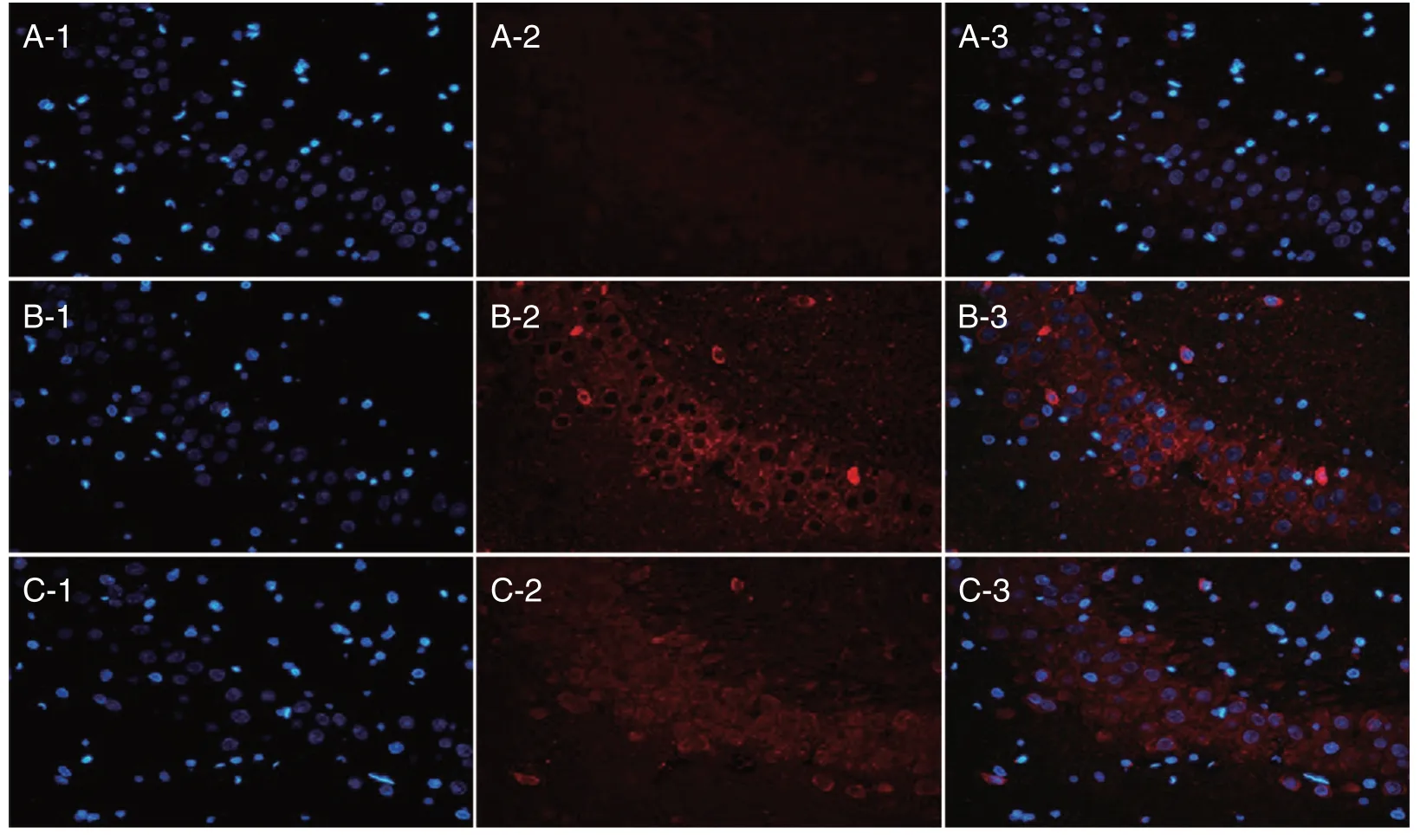
图3 第14 天海马NF-κB 的表达Fig.3 The expression of NF-κB in hippocampus area at 14th day
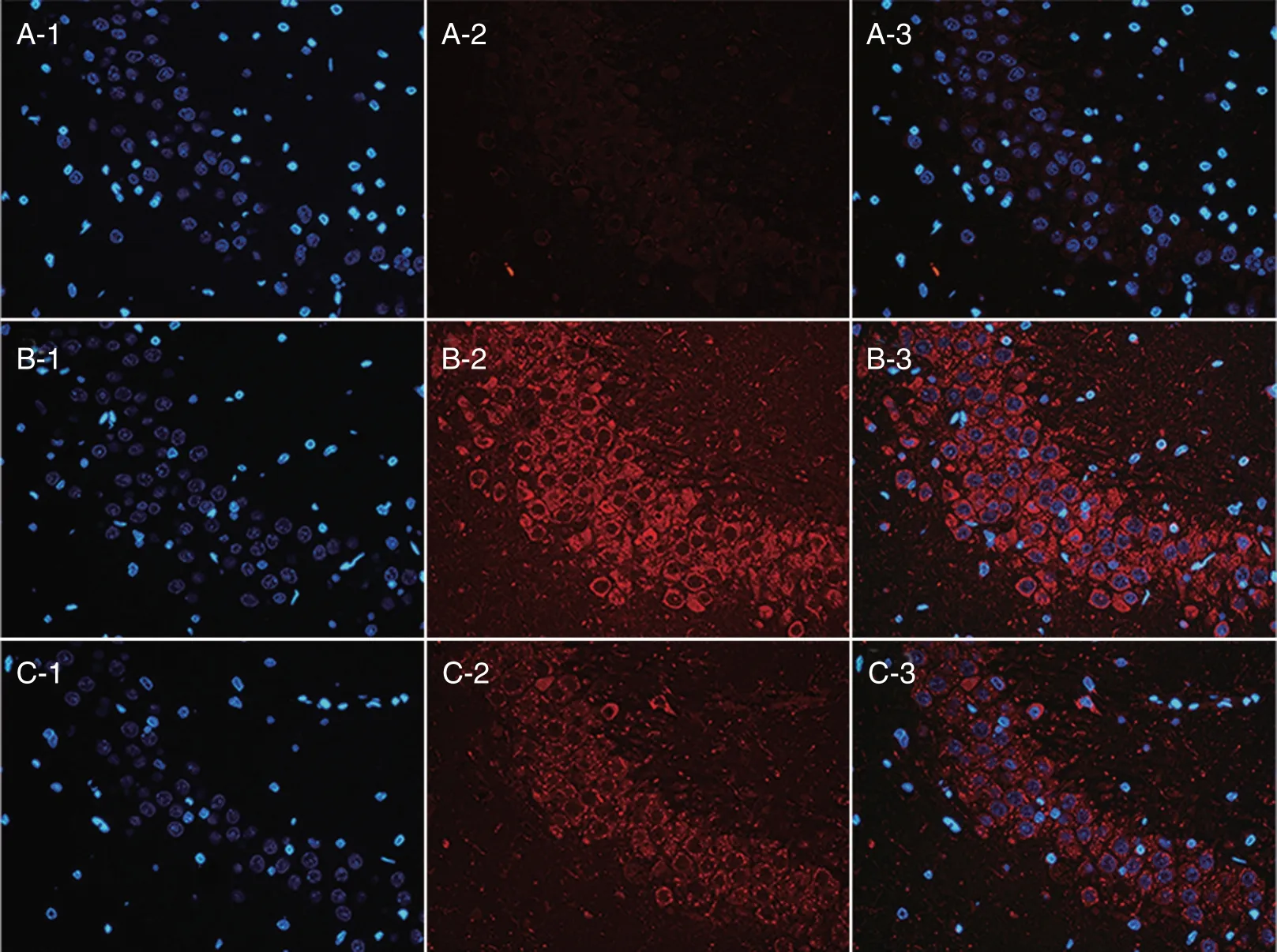
图4 第14 天海马MMP-9 的表达Fig.4 The expression of MMP-9 in hippocampus area at 14th day
3 讨论
NF-κB 是一种快反应转录因子,可参与机体正常的免疫和炎症反应,亦可参与过度炎症反应、细胞凋亡、突触重塑等过程。通常所说的NF-κB指的是P50∕P65 异源二聚体,该二聚体与κB 家族的抑制剂IκB 结合为三聚体,并以无活性复合物的形式存在于静息细胞的胞浆中[10-12]。当细胞受到缺氧等刺激激活时,NF-κB 三聚体中IκB 可解离出来,暴露P50 亚基的异位信号和P65 亚基的DNA 结合位点,表现出NF-κB 活性,活化后的NF-κB 从细胞浆易位到细胞核内,与下游靶基因结合,发挥其转录调控的重要作用。PDTC 是具有抗氧化作用的稳定化合物,是NF-κB的特异性抑制剂。MMP-9是NF-κB 下游的重要炎症因子,已有研究表明其基因启动子中包含有一个能够结合NF-κB P65 亚单位的基因序列[13]。该酶是一种依赖于锌离子和钙离子的内源性蛋白水解酶[14],通常在突触中产生,并以无活性的MMP-9 酶原形式释放到细胞外,在细胞外激活后可通过降解细胞外基质引起突触重塑[15],降解髓鞘碱性蛋白引起细胞凋亡等。已有研究表明,MMP-9可通过调节正常的神经突触的可塑性影响学习记忆,亦可因MMP-9 基因及蛋白过度表达而发生神经系统疾病,如癫痫、中风等[16]。
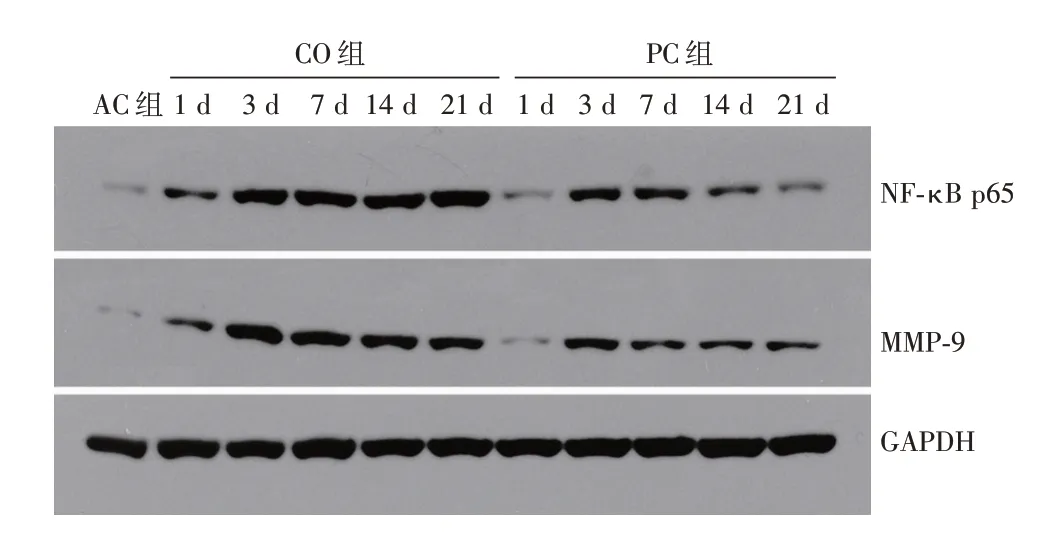
图5 海马NF-κB、MMP-9 蛋白免疫印迹法结果Fig.5 Immunoblotting results of NF-κB and MMP-9 proteins in hippocampus

图6 第14 天海马神经元突触超微结构(×104)Fig.6 The synaptic ultrastructure of neurons in hippocampus area at 14th day(×104)
本研究采用改良式腹腔注射法复制DEACMP模型,行Morris 水迷宫实验发现大鼠在染毒后14~21 d 表现出平均潜伏期显著延长、穿越平台次数减少,与同时间点AC 组、PC 组比较差异均有统计学意义(P<0.05),提示大鼠染毒后学习记忆力减退。病理结果示染毒后7~14 d 细胞凋亡明显,大鼠行为学表现晚于其病理学改变,与该病临床过程基本一致,两者均可验证造模成功。
XUE 等[17]研究发现海马CA3 区对缺氧敏感,且MMP-9 在该区表达较多。本研究中大鼠染毒后第3 天发现海马CA3 区NF-κB 蛋白表达明显增加,MMP-9 mRNA 及蛋白均增多,海马区椎体细胞开始出现凋亡,细胞超微结构正常,Morris 水迷宫实验各项指标较AC 组、PC 组差异均无统计学意义(P>0.05),此时大鼠学习记忆能力暂未受到损害,与临床患者“假愈期”表现一致。提示在中毒后早期NF-κB、MMP-9 升高,可能起保护性作用,以至大鼠中毒后早期表现无明显异常。其可能与CO 中毒后激活NF-κB 信号通路,在早期产生抗炎作用,促进神经保护性因子的表达,同时突触亦发生适应性改变,从而对大鼠脑组织起到保护作用。本研究中脑组织缺氧与脑缺血缺氧类似,既往在脑缺血损伤的相关研究中已发现NF-κB 的活化可发挥抗炎作用,从而抑制脑缺血损伤,以显示出对神经细胞的保护作用[18]。本研究结果与之类似。
随实验时间推移,于染毒后7 ~21 d NF-κB 蛋白仍有缓慢增高趋势,可能与以下因素有关:NFκB 高度活化发生炎症级联反应,炎症正反馈使NF-κB 持续升高并长时间维持;一氧化碳中毒后发生脱髓鞘、细胞凋亡等其他病理因素刺激NF-κB 处于激活状态。而此时MMP-9 基因及蛋白表达开始减少,但仍高于AC 组,细胞凋亡明显,突触超微结构发生改变,出现异常重塑,最终发生迟发性脑病,与水迷宫实验结果一致。提示NF-κB 持续处于较高水平,可能导致炎症反应过度激活,对神经系统起到损害作用。本实验中暂未观察到NF-κB降低,这可能与实验时间短有关,其表达变化趋势有待进一步观察研究。该时间段NF-κB 仍处于高水平,但MMP-9 mRNA 和蛋白表达开始下降,考虑与细胞凋亡有关,与XUE 等[17]研究结果一致。
本研究显示应用NF-κB 特异性抑制剂PDTC成功阻断NF-κB -MMP-9 信号转导通路后,海马区NF-κB 及其下游因子MMP-9 减少,神经元凋亡减少,突触异常重塑减轻,于第14 天明显,同时Morris 水迷宫实验显示14 ~21 d 大鼠平均潜伏期缩短、穿越平台次数增加,与AC 组比较差异有统计学意义(P<0.05),提示PDTC 可减轻急性CO 中毒后迟发的学习记忆力损害,持续应用14 d 保护作用明显,但阻断该信号通路并不能完全阻止迟发性脑病的发生。表明NF-κB-MMP-9 信号通路仅是参与DEACMP 发病机制中的一条通路。其发病机制复杂,病理生理过程有待进一步研究。同时PDTC 的给药方式及药物不同剂量的作用效果亦有待进一步研究。
本研究还发现应用PDTC 阻断NF-κB 信号通路后,细胞凋亡减少,但根据XUE 等[17]研究可推测,当细胞凋亡减少时,MMP-9 应有所增多,而本研究于7~21 d 细胞凋亡减少后MMP-9 基因和蛋白的表达与CO组比较并未增多,反而少于CO组的表达。这一表现与XUE 等[17]研究存在矛盾,推测MMP-9的表达不仅与细胞活性有关,还与其是否被上游因子激活有关,且是否被激活占据主要地位。
综上所述,笔者发现NF-κB 及其下游因子MMP-9 参与DEACMP 发生,在染毒早期起保护作用,过量表达时产生损害作用。本研究中使用PDTC 抑制NF-κB 通路,尽管只是部分抑制MMP-9基因及蛋白的表达,但可显著改善DEACMP 大鼠的认知功能,为今后研究DEACMP 的临床靶向治疗提供了新的实验依据和方向。
