葫芦素E 通过诱导自噬抑制人膀胱癌细胞T24 的增殖
2019-03-08周毅彬王永昌高鹏朱进臧亚晨许立军金露马麒
周毅彬 王永昌 高鹏 朱进 臧亚晨 许立军 金露 马麒
1苏州大学附属第二医院泌尿外科(江苏苏州215000);2苏州大学附属第二医院超声科(江苏苏州215000)
膀胱癌是全世界最常见的恶性肿瘤之一,2012年的统计结果显示,当年膀胱癌预计新发病例429 800 例,其中165 100 例患者因为膀胱癌而死亡[1]。膀胱癌主要发生在男性,且与吸烟密切相关。近些年来,由于吸烟人群的减少,欧美大多数国家膀胱癌的发病率有所降低[2]。另外,多进食水果和蔬菜有助于减少膀胱癌的发生[3]。随着医学的进步,出现了很多膀胱癌的治疗方案,包括手术及术后化疗和(或)放疗,但是膀胱癌的致死率仍然很高。同时,术后放∕化疗副作用大,患者往往难以耐受[4]。因此,研发有效且副作用低的新型化疗药成为当前重要的研究课题之一。近十年来,植物提取剂因其潜在的抗肿瘤特性越来越受到研究者的关注,且目前批准用于治疗肿瘤的药物中,有约70%为天然植物的提取成分[5]。葫芦素E(cucurbitacin E,CuE)为葫芦科植物的主要成分之一,研究发现其除了能抗氧化、抗炎外,还有很强的抗肿瘤能力[6]。CuE 能够通过诱导凋亡、细胞周期阻滞和自噬性细胞死亡抑制包括卵巢癌和胰腺癌在内多种肿瘤细胞的增殖,同时还能够通过抑制多种信号通路抑制肿瘤血管新生[7-9]。研究报道CuE 能够诱导G2∕M 周期阻滞和凋亡抑制膀胱癌细胞的增殖[10],CuE 是否能够诱导膀胱癌细胞发生自噬以及所诱导的自噬对细胞增殖是何影响,目前并不清楚。本研究旨在研究CuE 是否诱导膀胱癌细胞T24 发生自噬,并进一步阐述所诱导的自噬对细胞增殖的影响。
1 材料与方法
1.1 材料及试剂 DMEM 培养基(购于美国Corning 公司),青霉素∕链霉素双抗、BCA 蛋白定量试剂、PBS 和TBS(购自上海碧云天公司),无内毒素胎牛血清(购自杭州四季青公司),CuE、MTT、BAFA1 和3-MA(购于美国Sigma 公司),脂质体2000(购于美国赛默飞公司),LC3A∕B、p62 及GAPDH一抗和山羊抗兔及驴抗鼠二抗(购于美国CST 公司),GFP-RFP-LC3 质粒和T24 细胞(西安交通大学第一附属医院泌尿外科研究所馈赠)[11]。细胞工作台、细胞培养箱、电泳和转膜仪(购于美国Biorad 公司)、荧光显微镜(购于日本Nikon 公司)等常用设备均由苏州大学第二附属医院中心实验室提供。
1.2 实验方法
1.2.1 细胞的培养与处理 细胞培养于含10%胎牛血清、1%青霉素∕链霉素双抗的DMEM 细胞培养基中。置于37 ℃、CO2浓度5%和湿度95%的细胞培养箱中培养。每隔一天或按照需要实验需要换液。待细胞状态良好呈对数生长时,细胞经PBS 洗2 次后0.25%胰酶消化、培养基中和后1 000 r∕min离心5 min。离心后的细胞经培养基重悬后按照实验试讲进行种板等操作。
1.2.2 MTT 试验细胞 按3 000 个∕孔悬于200 μL培养基种于96 孔板中。次日换液,按照实验设计对细胞进行相应的处理,每种处理设4 个副孔,放回细胞培养箱继续培养。24 h 后每孔加入20 μL MTT,放回细胞培养箱孵育。2~4 h 后弃去旧培养基并向每孔加入150 μL DMSO。微型振荡器振荡5 min,待蓝紫色结晶完全溶解后于置于多功能酶标仪中,于490 nm 波长下检测吸光值。
1.2.3 Western-blot 将细胞从细胞培养箱取出后置于冰上,4 ℃预冷的PBS 洗3 次后加入RIPA裂解液。将悬有细胞的裂解液移至1.5 mL EP 管中,于冰上静置5 min 使细胞充分裂解。4 ℃离心机12 000 r∕min 离心15 min 后弃去管底沉淀。取部分上清通过BCA 法定量,剩余上清加入4×上样缓冲液,混合均匀后沸水煮5 min。取30 μg 蛋白加到10% SDS-PHAGE 胶孔中,经电泳和转膜后,使用5%脱脂牛奶对膜进行封闭,4 ℃过夜或室温孵育1 h。室温孵育一抗2 h 或4 ℃过夜。TBST 洗3 次后室温孵育二抗1 h,TBST 洗3 次后通过ECL法显影。通过Image-J 软件计算各条带的灰度值。
1.2.4 CuE对T24自噬的影响与LC3翻转实验 细胞按500 000 个∕皿种于6 cm 皿中,共4 个皿,分别为对照组、CuE 组、BAFA1 组和CuE+BAFA1 组。次日换液,对照组和BAFA1 组更换为新鲜正常培养基,CuE 组和CuE+BAFA1 组更换为含有1 μmol∕L CUE 的培养基,放回细胞培养箱继续培养。12 h后BAFA1组和CuE+BAFA1组加入浓度为10 nmol∕L的BAFA1。12 h 后提取总蛋白并通过western-blot检测LC3A∕B、p62 和GAPHD 内参的表达。
1.2.5 GFP-RFP-LC3 双荧光试验 细胞按300 000 个∕孔种于6 孔板中,待细胞贴壁后按照脂质体2000 的说明书进行质粒的转染操作。24 h 后消化细胞离心后按1 000 个∕孔种于腔室载玻片的小室中,共种2 个孔,分别为对照组和CuE 组,放回细胞培养箱孵育过夜。次日换液。对照组加入含DMSO 的培养基,CuE 组加入终浓度为1 μmol∕L的培养基,细胞培养箱中继续培养24 h。室温PBS洗3 次后4%多聚甲醛固定10 min。PBS 洗3 次后将载玻片取出,滴加含DAPI 的封片液后封片,于荧光显微镜下观察并拍照。
1.2.6 细胞计数试验 细胞按300 000 个∕孔种于6 孔板中,设4 组,分别为对照组、CuE 组、3-MA 组和CuE+3MA 组,每组5 个孔。次日换液,对照组和CuE 组更换为新鲜正常培养基,3-MA 组和CuE+3MA组更换为含有5 mmol∕L3-MA的新鲜培养基。4 h 后,CuE 组和CuE+3MA 组加入CuE,使终浓度为1 μmol∕L,放回细胞培养箱继续培养。24 h后消化并重悬于PBS,总体积为5 mL。使用血球计数板进行计数。
1.3 统计学方法 所有实验均重复3 次且趋势一致。使用GraphPad Prism 7.0 软件对实验数据作图并通过单因素方差分析进行统计分析。以P<0.05 视为差异具有统计学意义。
2 结果
2.1 CuE抑制T24的增殖如图1所示,0.25 μmol∕L 的CuE 对细胞的增殖无明显影响,随着浓度的增加,细胞的增殖逐渐被抑制,24 h 的IC50 约为0.75 μmol∕L。

图1 CuE 对细胞增殖的影响Fig.1 Determined proliferation inhibition capacity of CuE on T24 By MTT
2.2 CuE 诱导细胞发生自噬 如图2所示,CuE处理后自噬标记物LC3A∕B II表达升高(P<0.05),LC3A∕B II∕I 的比值升高(P<0.05),同时自噬的底物蛋白p62 表达减少(P<0.05),提示自噬的发生。BAFA1 为经典的自噬下游抑制剂,其处理后细胞LC3A∕B II 表达升高(P<0.05),LC3A∕B II∕I 的比值升高(P<0.05),当CuE 与BAFA1 联用时,LC3A∕B II 的表达和LC3A∕B II∕I 的比值进一步升高(P<0.05),说明LC3A∕B II 和LC3A∕B II∕I 比值的升高是因为自噬诱导引起,而非阻断自噬抑制LC3A∕B II 的降解引起,即CuE 诱导了自噬流的发生。
2.3 CuE 诱导细胞发生自噬流 为了进一步证明CuE 诱导自噬流的发生,笔者进行了GFP-RFP-LC3双荧光试验。当自噬体形成时,表现为绿色荧光颗粒,当自噬体与溶酶体融合形成自噬溶酶体时,表现为黄色荧光颗粒。如图3所示,CuE 处理后,黄色荧光颗粒和红色荧光颗粒的数目均明显增多(P<0.05),进一步说明了自噬流的发生。
2.4 3-MA抑制CuE诱导的自噬 3-MA为经典的自噬抑制剂,能将自噬抑制在起始阶段。如图4所示,CuE能够诱导自噬的发生,但是与3-MA(5 mmol∕L)联用时,所诱导的自噬完全被抑制(P<0.05)。
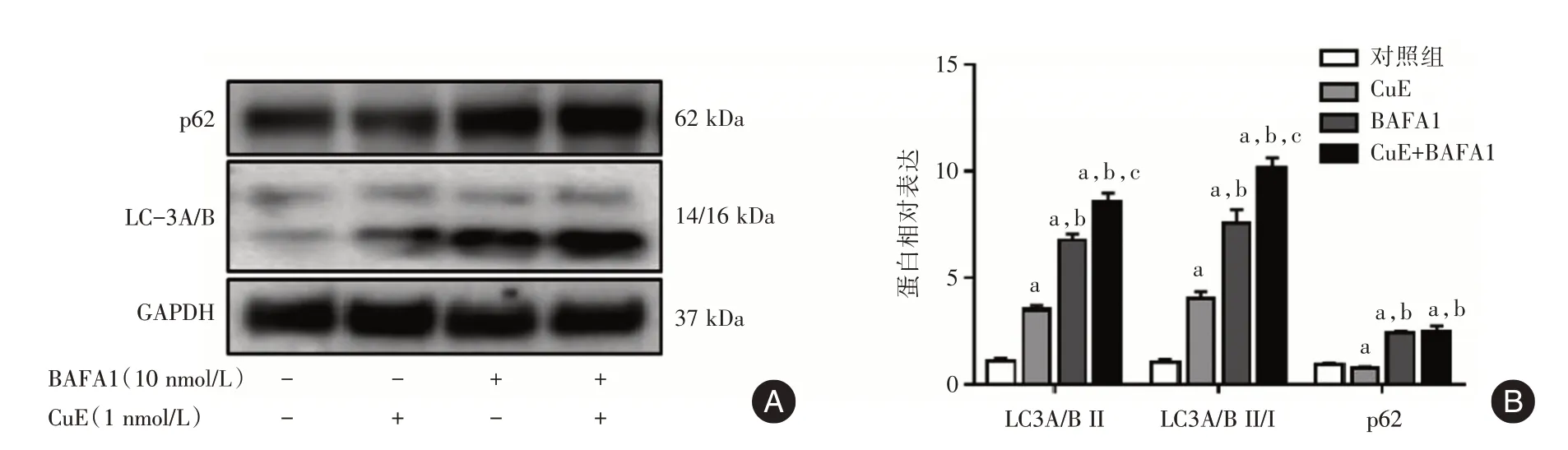
图2 Western-blot 检测CuE 对细胞自噬的影响Fig.2 Check the impacts of CuE treatment on autophagy by Western blot
2.5 3-MA 抑制自噬后CuE 对细胞增殖抑制效应减弱 如图5所示,在MTT 试验和细胞计数试验中,CuE 均能抑制细胞的增殖(P<0.05),但是与3-MA 联合用,CuE 对细胞增殖抑制的效应明显减弱(P<0.05)。提示CuE 所诱导的自噬对细胞增殖起抑制作用。
3 讨论
自噬为细胞新陈代谢调节的重要组成部分,对细胞内稳态的平衡至关重要。当细胞受到应激时,细胞将激活一系列的信号通路诱导自噬的发生,将细胞内多余的或受损伤的蛋白、细胞器和病原微生物来源的蛋白降解,为细胞供给营养,以维持细胞的正常功能[12]。研究报道CuE 在HeLa 细胞和MCF7 诱导自噬的发生[9],但CuE 是否能诱导膀胱癌细胞发生自噬,目前并不清楚。本研究发现,CuE 能够显著诱导人膀胱癌细胞T24 发生自噬,表现为LC3A∕B2 的表达和LC3A∕B2∕1 比值的升高,同时自噬经典底物蛋白p62 表达的减少。另外,LC-3 翻转试验阳性以及GFP-RFP-LC3 荧光试验中黄色颗粒和红色颗粒的明显增多进一步佐证了CuE 能够在T24 中诱导自噬的发生。
自噬是把双刃剑,其能通过为细胞提供营养维持或促进细胞的正常增殖,如在膀胱癌的化疗中,化疗药通过诱导自噬的发生削弱了化疗药的抗肿瘤增殖效应,为肿瘤对化疗药耐药的机制之一[13];同时自噬也会通过降解重要细胞生长调节蛋白抑制细胞的增殖,如抑制G9a 的活性后能够诱导膀胱癌细胞发生自噬性细胞死亡[14]。CuE 所诱导的自噬对细胞增殖的影响,目前研究尚少。本研究发生,CuE 能够抑制T24 细胞的增殖,同时诱导自噬的发生。当自噬被抑制后,CuE 对T24 增殖抑制的能力减弱,提示CuE 所诱导的自噬对细胞的增殖起抑制作用。另外,自噬被抑制后CuE仍能部分抑制T24 的增殖,提示其可能诱导了凋亡或周期阻滞的发生。CuE 所诱导的自噬对凋亡或周期阻滞有何影响,尚不清楚,有待后续进一步研究。

图3 GFP-RFP-LC3 荧光试验检测CuE 对细胞自噬的影响Fig.3 Determine autophagy flux by GFP-RFP-LC3 fluorescent assay

图4 Western-blot 检测3-MA 对自噬的抑制Fig.4 Check the autophagy inhibition ability of 3-MA on CuE treatment by Western blot

图5 3-MA 抑制自噬后CuE 对细胞增殖的影响Fig.5 Influence of CuE-induced autophagy on cell proliferation with autophagy inhibition
在自噬发生过程中,细胞内的双膜结构如内质网、线粒体等将细胞内功能异常的细胞器、异常折叠的蛋白或病原等包裹形成自噬体,然后与溶酶体结合形成自噬溶酶体并最终降解。研究发现多种信号通路参与了自噬的调节,其中最为经典的上游信号包括ROS、AMPK、ERK、PI3K 和DNA损伤等[12]。在肺癌中,CuE 通过调节ROS 的活性激活自噬的发生[15];而在宫颈癌和乳腺癌中,CuE通过激活AMPK 并抑制mTOR 的功能诱导自噬的发生[9]。在膀胱癌中,CuE 所诱导的自噬是否与ROS 及AMPK 相关,目前并无研究。另外,其他信号通路如ERK、PI3K 和DNA 损伤等是否参与了CuE 对自噬的诱导,目前并不清楚。后续工作将对CuE 所诱导膀胱癌细胞发生自噬的具体机制进行研究。
综上所述,CuE 在人膀胱癌细胞T24 中诱导了自噬的发生,且诱导的自噬对细胞的增殖起抑制作用。此研究为将来CuE 用于临床治疗膀胱癌提供了新的实验资料和理论基础。
