非小细胞肺癌奥希替尼获得性耐药细胞株的建立及耐药后化疗敏感性
2019-03-08杜豆周娟邱英马灏川纪佳朋张为民
杜豆 周娟 邱英 马灏川 纪佳朋 张为民
1广州中医药大学研究生院(广州510006);2广州军区广州总医院肿瘤科(广州510010)
肺癌是我国发病率和病死率最高的恶性肿瘤[1],其中非小细胞肺癌(non small cell lung cancer,NSCLC)约占80%[2]。在我国,表皮生长因子受体(epidermal growth factor receptor,EGFR)突变型占非小细胞肺癌约30%[3-4]。表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKIs)已经成为EGFR 突变阳性的晚期非小细胞肺癌首选治疗方案[5],但是大部分患者在经过第一代EGFR-TKIs 治疗10 ~12 个月后出现获得性耐药,EGFR 二次突变是获得性耐药的主要机制之一[6-8]。针对T790M 突变的第三代EGFR-TKIs 奥希替尼已被用于临床,并取得了良好的疗效。然而使用奥希替尼约在10 个月后仍无法避免地出现了获得性耐药,最终导致肿瘤进展[9-10]。目前,对于第三代EGFR-TKIs 耐药后NSCLC 治疗仍无合适的方案,化疗仍是耐药后NSCLC 的主要选择,如何选择最有效的化疗药物是临床面临的主要问题之一,遗憾的是目前缺乏基础和临床研究。本研究选用NSCLC 吉非替尼获得性耐药细胞株PC-9∕ZD,予以逐步递增奥希替尼剂量法建立奥希替尼获得性耐药细胞株PC-9∕ZDOR,观察其生物学特性和检测其耐药机制,并探讨奥希替尼耐药后对第三代肺癌化疗药物的敏感性,为研究奥西替尼耐药机制提供了可靠的细胞模型,也为研究耐药后NSCLC 选择合适的化疗药物提供依据。
1 材料与方法
1.1 主要材料 非小细胞肺癌PC-9∕ZD 细胞为吉非替尼获得性耐药细胞株由日本国立癌症中心小泉史明博士惠赠,CCK-8 试剂购自日本同仁公司;RPMI-1640 培养基、北美血清购于美国Gibco 公司;二甲基亚砜购于MP 公司;EGFR、p-EGFR、Ecadherin、Vimentin、N-Cadherin 抗体购自美国CST公司,GAPDH 购自美国Affinity 公司,免疫印迹化学发光试剂ECL 购自美国Millipore 公司;奥希替尼购自美国SELLECK 公司;多西他赛、吉西他滨、培美曲塞、紫杉醇、顺铂、司美替尼购自MCE公司。
1.2 细胞培养 PC-9∕ZD 细胞培养于37 ℃、5%CO2条件下用含10%北美胎牛血清、1%青霉素、1%链霉素的RPMI-1640 培养液培养,倒置显微镜下观察细胞形态,实验时收集生长状态良好的对数生长期细胞进行实验。
1.3 耐药细胞株的建立 通过逐步增加药物浓度的方法诱导非小细胞肺癌细胞株PC-9∕ZD,取5 ×105个对数期的细胞于培养瓶中,贴壁24 h 后,予以0.1 μmol∕L 奥希替尼为初始浓度作用细胞,每日更换含药培养基,初始可见细胞大量死亡,待3 ~4 周后细胞逐渐出现耐受稳定生长后,予以普通培养基固定3 ~5 d 后传代,再次倍增浓度直至循环6 个浓度周期,终止药物浓度为3.2 μmol∕L,并在终浓度下维持1 个月后更换为无药培养基继续培养1 个月,共历时7 个月,完成整个培养过程,建立的耐药细胞株被命名为PC-9∕ZDOR。于导置显微镜下对比观察亲本细胞株与耐药细胞株的形态。
1.4 细胞EGFR 基因突变检测 细胞消化离心后,弃上清液,加入1 mL PBS 吹打均匀,置于4 ℃冰盒中送广州燃石医学检验中心行NGS 技术检测肺癌168 基因情况。
1.5 CCK-8 法检测细胞的耐药性 取对数生长期PC-9∕ZD 或PC-9∕ZDOR 单细胞悬液接种于96 孔板,3× 103个∕孔;培养24 h 后,加入含相应浓度药物的培养液200 μL∕孔,每个药物浓度设5 个复孔,同时设空白组和无药对照组;继续培养72 h,仔细吸弃各孔培养液,每孔加入RPMI1640 培养基100 μL 和CCK-8 试剂10 μL,继续培养1 h;在酶联免疫检测仪上于450 nm 波长下检测各孔的吸光度值,采用Graphpad Prism 6.0 软件计算各组细胞的半数抑制浓度,再按此公式计算耐药指数(RI)。RI=IC50(PC-9∕ZDOR)∕IC50(PC-9∕ZD)。
1.6 细胞生长曲线的绘制和倍增时间计算 取对数生长期的细胞PC-9∕ZD、PC-9∕ZDOR 细胞分别接种96 孔板,1 × 103∕孔,每种细胞设5 个复孔,孵育1、2、3、4、5、6 和7 d 后进行细胞增殖检测,Graphpad Prism 6.0 绘制细胞生长曲线,计算细胞倍增时间。
1.7 Western blot 分析细胞中EGFR 及相关蛋白表达 细胞中加入蛋白裂解液、置于冰上裂解后提取蛋白,并用BCA 法测定蛋白浓度,等量上样后行8%SDS-PAGE 电泳分离蛋白,转膜,封闭,加入相应的一抗4 ℃孵育过夜,用TBST 摇床洗膜3 次,选择相应的二抗室温摇床反应1 h,再用TBST 洗膜3 次,最后用ECL 显色并采用化学发光成像系统成像。
1.8 统计学方法 采用Graphpad Prism 6.0 统计软件进行分析数据和作图,数据结果用表示。采用t检验比较两组间数据,单因素方差分析比较多组间数据,P<0.05 为差异有统计学意义。以上实验数据均重复3 次。
2 结果
2.1 PC-9/ZDOR 耐药细胞株的建立 历时7 个月成功将PC-9∕ZD 细胞体外诱导成奥希替尼获得性耐药细胞株,命名为PC-9∕ZDOR。洗脱奥希替尼后6 个月,CCK-8 法检测亲本细胞及耐药细胞株对奥希替尼的IC50值,结果显示较亲本细胞PC-9∕ZD,耐药细胞株PC-9∕ZDOR 对奥希替尼的敏感性显著下降,IC50值分别为(0.08 ± 0.15)和(3.52 ± 0.03)μmol∕L(P<0.05),RI 为44(图1)。
2.2 耐药细胞株的EGFR 基因变化 采用NGS 技术检测PC-9∕ZD 细胞结果显示为EGFR p.E746_A750del伴随T790M及EGFR amp,耐药细胞株PC-9∕ZDOR 结果显示EGFR p.E746_A750del 及T790M 均消失,无其他EGFR 基因表达也无EGFR 扩增。
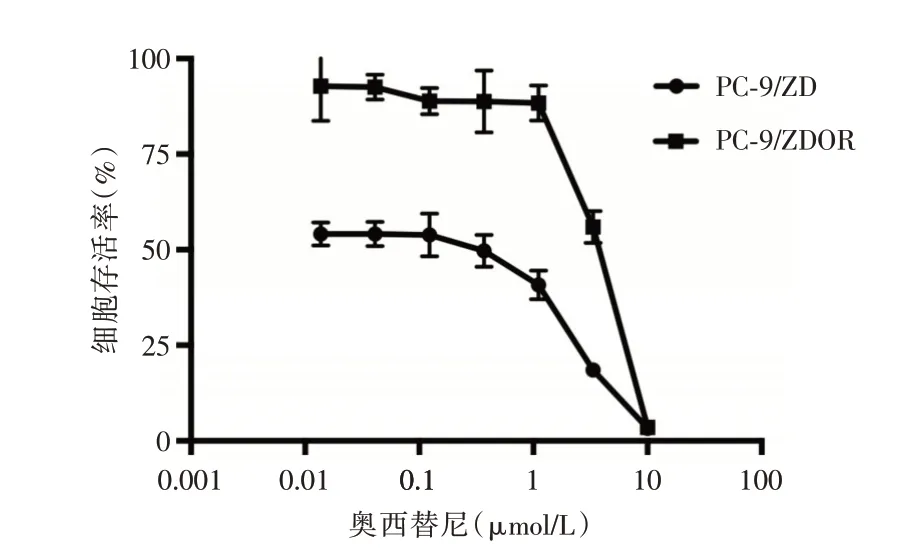
图1 PC-9∕ZD 和PC-9∕ZDOR 的奥希替尼药物浓度-细胞存活率曲线Fig.1 The cell viability of osimertinib in PC-9∕ZD and PC-9∕ZDOR cells
2.3 细胞生长曲线及肿瘤倍增时间 细胞生长曲线显示,两种细胞增殖无明显差异。PC-9∕ZD 细胞倍增时间为(35.44 ± 0.77)h,PC-9∕ZDOR 细胞倍增时间为(37.99±2.14)h(P>0.05,图2)。

图2 PC-9∕ZD 和PC-9∕ZDOR 细胞的生长曲线Fig.2 The proliferation ability of PC-9∕ZD and PC-9∕ZDOR cells
2.4 细胞形态学变化 在倒置显微镜下PC-9∕ZD、PC-9∕ZDOR 细胞均为贴壁生长。PC-9∕ZD 细胞呈长梭形和圆形为主,长伪足,排列无规则。而PC-9∕ZDOR 细胞相互镶嵌,呈团簇样生长,细胞较为扁平,体积稍变小变圆(图3)。
2.5 耐药细胞株EMT 标志蛋白、EGFR、p-ERK及p-AKT 蛋白表达变化 与亲本细胞比较,耐药细胞株PC-9∕ZDOR 细胞的EGFR 及其磷酸化蛋白表达显著减少(P<0.05),E-Cadherin 和N-Cadherin的蛋白表达量明显减少(P<0.05),间质标志Vimentin 的蛋白表达量未见增加(P>0.05)。p-ERK和p-AKT 蛋白表达水平明显下降(P<0.05),AKT和ERK 蛋白表达无明显改变(P>0.05,图4)。

图3 PC-9∕ZD 和PC-9∕ZDOR 细胞的形态差异Fig.3 The morphological differences between PC-9∕ZD and PC-9∕ZDOR cells

图4 western blot 检测PC-9∕ZD 和PC-9∕ZDOR 细胞的相关蛋白表达Fig.4 The expressions of relative proteins in PC-9∕ZD 和PC-9∕ZDOR cells
2.6 细胞获得性耐药后对不同化疗药物敏感性与亲本细胞相比,耐药细胞株PC-9∕ZDOR 对化疗药物多西他赛、吉西他滨、紫杉醇敏感性增加(P<0.05),而对培美曲塞、顺铂的敏感性无明显变化(P>0.05,表1)。
表1 PC-9∕ZD 细胞和PC-9∕ZDOR 细胞的药物敏感性Tab.1 The sensitivity of themotherapeuticdrugs in PC-9∕ZD and PC-9∕ZDOR cell line(n=3) ±s

表1 PC-9∕ZD 细胞和PC-9∕ZDOR 细胞的药物敏感性Tab.1 The sensitivity of themotherapeuticdrugs in PC-9∕ZD and PC-9∕ZDOR cell line(n=3) ±s
药物多西他赛吉西他滨培美曲赛紫杉醇顺铂IC50(nmol∕L)PC-9∕ZD 0.476±0.067 21.257±1.059 51.890±6.698 2.205±0.225>100 000 PC-9∕ZDOR 0.074±0.021 7.878±0.478 55.233±1.341 1.203±0.341>100 000耐药指数0.154 0.371 1.064 0.545-
3 讨论
本研究选取的NSCLC PC-9∕ZD 细胞株为吉非替尼获得性耐药细胞株[11],二代测序证实为19 外显子突变合并T790M 突变耐药细胞株,通过体外递增药物浓度的方法建立奥希替尼获得性耐药细胞株PC-9∕ZDOR,其RI 为44,在停止给药6 个月后耐药细胞株仍保持相似耐药性,提示体外国内首次成功建立伴T790M 突变一代EGRF-TKI 耐药后三代EGRF-TKI 耐药细胞模型。
进一步对本研究中耐药细胞株PC-9∕ZDOR 进行NGS 检测分析EGFR 基因突变及Western blot 检测EGFR 蛋白表达,结果显示,与亲本细胞相比,原EGFR 基因突变(p.E746_A750del 和T790M)消失,无EGFR 扩增及其他新的EGFR 相关基因突变。PC-9∕ZDOR 细胞株EGFR 及其磷酸化蛋白表达呈显著减少,其下游信号p-ERK 和p-AKT 蛋白表达水平明显下降。结果表明EGFR 靶点的丢失可能是第三代EGFR-TKIs 获得性耐药的主要机制之一,与国外报道一致。KIM 等[12]研究发现,吉非替尼耐药后出现T790M 突变后服用奥希替尼后变为EGFR 野生型。MIZUUCHI 等[13]的研究中也报道HCC827∕ER 厄洛替尼耐药细胞株(19del+T790M+EGFR amp)经EGFR T790M 抑制剂CNX2006 处理后,出现EGFR 扩增消失的情况。THRESS 等[14]的研究中报道患者在奥希替尼获得性耐药后T790M突变消失。这些结果表明EGFR 靶点的丢失导致临床获得性耐药性产生后继续应用EGFR-TKIs 治疗效果不佳。
已报道的第三代EGFR-TKIs 的耐药机制除T790M 减少或消失[14]、EGFR 新发突变(C797S、L718Q、G796R 等)[14-16]、旁路信号途径激活[12,17-18]外,还与细胞出现EMT 表型有关[19]。本研究中与亲本细胞PC-9∕ZD 相比,耐药细胞PC-9∕ZDOR 中的上皮标志物E-Cadherin 和N-Cadherin 的蛋白表达量明显减少,但间质标志Vimentin 的蛋白表达量未见增加。说明耐药细胞株PC-9∕ZDOR并未出现EMT。
化疗是目前第三代EGFR-TKIs 耐药进展患者的主要治疗方法之一,本研究发现与亲代PC-9∕ZD细胞相比,PC-9∕ZDOR 细胞株对化疗药物多西他赛、吉西他滨、紫杉醇敏感性增高,而对培美曲塞、顺铂敏感性无明显变化。TANG 等[20]的体外研究结果也提示对奥希替尼耐药细胞株H1975∕OSIR表现出对紫杉醇的敏感性增高,而对培美曲赛的敏感性无变化,与本研究结果一致。KIM 等[12]的临床研究亦显示奥希替尼进展的患者对紫杉醇的高敏感性。本研究和既往研究结果提示对奥希替尼耐药的肺癌对紫杉类化疗较敏感,对临床晚期NSCLC 经奥希替尼治疗后进展的患者选择合适的化疗药物有一定参考意义,但仍需进一步多中心临床研究来证实。本研究结果还提示奥希替尼耐药的PC-9∕ZDOR 细胞株对吉西他滨敏感,目前国内外未见无类似报道,仍需扩大研究来证实。
综上所述,本研究通过奥希替尼逐步递增剂量,国内首次成功诱导伴T790M 突变的一代EGRF-TKI 耐药后三代EGRF-TKI 耐药细胞模型,发现其耐药机制可能与EGFR 基因突变消失和(或)EGFR 及其磷酸化蛋白表达显著减少、EGFR 信号蛋白p-ERK 和p-AKT 减少有关,耐药后细胞株对紫杉类、吉西他滨化疗药物敏感性增加。本研究为研究奥西替尼耐药机制提供了可靠的细胞模型,也为临床治疗三代EGRF-TKI 耐药方案的选择提供参考依据。鉴于本研究只采用一个细胞株,未能全面概括不同亚型细胞对奥西替尼的耐药机制,结果有待进一步扩大研究并在临床加以证实。
