中高温强化大曲生产工艺及特性研究
2019-03-08周业皓李建武马向东
柯 涛,周业皓,姜 鹏,李建武,马向东*
(1.南阳师范学院 生命科学与技术学院,河南 南阳473200;2.湖北大学 生命科学院,湖北 武汉430062)
大曲是白酒生产的糖化发酵剂,白酒生产过程中大部分参与代谢的微生物都来源于大曲[1]。大曲在中国浓香型白酒生产过程中起着重要作用,改善大曲中微生物群落的结构组成可以增进大曲产生出许多有益风味物质[2]。传统大曲生产是靠自然富集接种环境中各种微生物经发酵培养而制成的,能利用原料生成大量不同种类的香味物质或其前体物[3]。自然界中的微生物群体,除了酵母、根霉、曲霉、毛霉等有益菌外,也夹带着许多对酿酒有害的菌类,这种传统方法生产的大曲受自然环境因素的制约大,造成质量不稳定、出酒率低、生产成本高等不利因素[4-5]。
强化大曲工艺的研究主要集中在如何强化方面,使用不同的有益菌株和不同的接种比例等。常见的菌种包括酵母,丝状真菌及细菌等,行业通常也会将分离自酿造环境的功能微生物用于强化制曲,也取得了较好的效果。大曲在完成糖化、发酵功能之后,就是酯化生香过程,是生产优质大曲酒的关键阶段,因此大曲的质量评定指标中,酯化力的高低是一个非常重要的指标。傅金泉等[6-7]在大曲培养中加入酯化红曲霉,制备酯化率较高的强化大曲,生产应用效果显著。产酯酵母又称为生香酵母,是指产酯能力强的酵母菌总称,主要产乙酸乙酯,是形成白酒香味成分的主要菌群[8]。冯雅芳等[9]将酵母菌、黑曲霉和红曲霉混合培养加入大曲中。颜林春[10]将筛选到的10株功能芽孢杆菌经纯种培养后加入在制曲原料中制成强化高温大曲,检测符合一级高温大曲质量控制指标。
本研究为改进大曲制作工艺,获得性能稳定具有独特风味的大曲,首先分离酱香型白酒酿造环境的产香型功能细菌,确定其产香组分,与酯化红曲和产酯酵母共同制作复合菌剂用于强化制曲,并对大曲理化指标和感官指标的动态变化及香味组分变化进行了检测和比较分析,初步探讨强化接种对大曲品质的影响,通过人工接种纯菌方式生产强化大曲,可以抑制有害杂菌的生长,提高产品质量,减少用曲量等,对酿酒工艺的改进有着极其重要的意义。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
郎比可假丝酵母菌(Candida lambica)AS2.1182:中国科学院菌种保藏中心;酯化红曲:自市售商品中分离;产香细菌:本实验室筛选;普通大曲:赊店老酒股份有限公司。
1.1.2 化学试剂
蛋白胨、牛肉膏、酵母膏(均为生化试剂)、无水乙醚、甲醇、乙醇、乙醚、正己烷(均为色谱纯):国药集团化学试剂有限公司;其他试剂均为国产分析纯。
1.1.3 培养基
LB固体培养基:蛋白胨1%,酵母膏0.5%,NaCl 1%,琼脂粉1.5%。121 ℃灭菌30 min。倒平板之前,每200 mL培养基加入两性霉素B(5 mg/mL)100 μL以抑制真菌生长。
LB液体培养基:蛋白胨1%,酵母膏0.5%,NaCl 1%。121 ℃灭菌30 min。
麸皮固体培养基:麸皮4 g,面粉1g,水10 mL。麸皮液体培养基:麸皮2 g,面粉0.5 g,水30 mL。115 ℃灭菌20 min。
酵母霉菌(yeast and mould,YM)琼脂培养基:酵母粉0.3%、蛋白胨0.5%、麦芽糖0.5%、葡萄糖1%、琼脂2%、乳酸(50 μL/10 mL;倒平板前加入)、氯霉素(80 μL/100 mL),105 ℃灭菌20 min。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:土豆200 g,葡萄糖20 g,琼脂15 g,水1 000 mL,pH自然。121 ℃灭菌20 min。
孟加拉红琼脂培养基:国药集团化学试剂有限公司。
1.2 仪器与设备
7890A/5975C安捷伦气质联用(gas chromatography-mass spectrometry,GC-MS)仪:美国安捷伦公司;DB-Wax毛细管柱(20 m×0.18 mm×0.8 μm):赛默飞世尔(中国)科技公司;PAL System三合一进样器:瑞士CTC公司;100 μm PDMS萃取纤维头:美国Supelco公司;AL104电子天平:梅特勒-托利多仪器公司;BPC-150F生化培养箱:上海一恒科学仪器有限公司;YXQ-LS-50S11压力蒸汽灭菌器:上海博迅医疗设备厂。
1.3 方法
1.3.1 产香细菌的筛选
在白酒生产发酵堆积过程中,每隔12 h从发酵堆中不同位点取样直至堆积发酵结束。取样点为离地1 m的发酵堆表层下20~30 cm堆积层面处,分别在发酵堆的4处取样并混匀,新鲜样品直接转入无菌袋中密封,立即置于4 ℃冰箱保存。使用LB 固体培养基和LB 液体培养基从样品中分离出优势可培养细菌。对固体发酵样品产生的香味进行描述,并对呈香为甜香、果香、特殊香的菌株做标记。感官鉴定人员为本实验室具有一年以上闻香经验的专业人员。
1.3.2 气相色谱-质谱联用法对产香细菌固态发酵产物分析
3株产香细菌菌株在37 ℃条件下固态发酵8 d,6 000×g、10 ℃低温离心15 min,收集发酵液,用氯化钠饱和发酵液,加二氯甲烷(沸点40 ℃)进行多次萃取,分离两相,萃取液加无水硫酸钠粉末干燥,35 ℃加热浓缩萃取液至1 mL,0.45 μm滤器过滤样品,采用GC-MS法分析挥发性成分。
气相色谱条件:使用DB-Wax毛细管柱(20 m×0.18 mm×0.8 μm),程序升温条件:初温50 ℃,恒温2 min,然后以20 ℃/min的速率升至230 ℃,保持30 min。进样量:1 μL;进样方式:不分流;载气:氦气(He);流速:2 mL/min;进样口温度250 ℃;溶剂延迟4 min。
质谱条件:电子电离(electronic ionization,EI)源;电子能量:70 eV;离子源温度230 ℃;扫描范围:30~550 amu[11-13]。
定性定量方法:样品中未知挥发性成分通过工作站美国国家标准技术研究所(national institute of standards and technology,NIST)11.L标准谱库自动检索,导出样品检索报告后筛选匹配,保留匹配度>80的物质。定量分析采用峰面积归一化法,计算出各种保留挥发性成分的相对百分含量。
1.3.3 细菌的16S rDNA分子鉴定
分别提取保存的纯培养细菌总脱氧核糖核酸(deoxyribonucleic acid,DNA),采用细菌通用引物27F和1492R对细菌总DNA进行16S rDNA的聚合酶链式反应(polymerase chain reaction,PCR)扩增,所得PCR产物经胶回收试剂盒回收纯化后,送由上海生工生物工程有限公司进行测序。
1.3.4 产香细菌种子液的制备
取上述筛选的产香细菌菌种,于LB试管斜面培养基培养,在温度37 ℃条件下培养48~72 h;转接入三角瓶麸皮培养基中扩大培养,在温度37 ℃条件下培养48~72 h,制成细菌二级种子;将细菌二级种子转接入浅盘麸皮培养中,在温度25 ℃条件下培养48~72 h,即制成细菌三级种子。
1.3.5 产酯酵母种子的制备
取市售产酯酵母菌种郎比可假丝酵母菌AS2.1182于麦芽汁试管斜面培养,培养温度为30 ℃,培养48 h;转接入三角瓶麸皮固体培养基中扩大培养,在温度30 ℃条件下培养48 h,即制成产酯酵母功能种子曲二级种子,将产酯酵母功能种子曲二级种子转接入浅盘麸皮培养基中,在温度37 ℃条件下培养48 h,即制成产酯酵母三级种子。
1.3.6 酯化红曲种子液的制备
取市售的酯化红曲菌种[14]于PDA试管斜面培养,在温度32 ℃条件下培养5 d;转接入三角瓶麸皮固体培养基中扩大培养,在温度32 ℃条件下培养5 d,即制成酯化红曲功能种子曲二级种子,将酯化红曲功能种子曲二级种子转接入浅盘麸皮培养中,在温度32 ℃条件下培养5 d,即制成酯化红曲三级种子。
1.3.7 曲母粉的制备
将传统中高温大曲成品优质曲粉碎,过40目筛,去除杂质后作为曲母,备用。
1.3.8 增香高酯强化中高温大曲的生产方法
种曲培养基制备:使用无杂质、无霉变的优质小麦为原料,用室温水润粮,控制润麦后小麦的含水量为15%~20%。将润好后的粮食进行粉碎,小麦粉碎至烂心不烂皮,即麦皮磨成片状,麦心磨成粉末,粉碎粒度要求未通过40目筛的粗皮及颗粒占45%~55%。然后水分调节至37%~40%,即制成种曲培养基[15]。
接种:将增香细菌种子(接种质量比分别为0.05%、0.10%、0.15%)、产酯酵母种子(接种质量比分别为0.5%,1.0%,1.5%)、酯化红曲种子(接种质量比分别为0.5%,1.0%,1.5%)、曲母粉(接种质量比分别为0.5%,1.0%,1.5%)接种于种曲培养基中,并搅拌均匀;其余为种曲培养基[10-11]。
压曲块:制曲在河南赊店老酒公司制曲车间完成。将接种完成的培养基混合物送入压曲机中,用模具控制将培养基混合物压制成大曲块(28 cm×15 cm×7 cm)[15]。
自然发酵:将压制成型的大曲块堆码在发酵室内,块间留有2 cm,行间留有3 cm通风间隙;初始培养温度设为冬季10~19 ℃,夏季15~25 ℃,初始湿度设为85%,曲块经过6~20 d自然升温后,曲心最高温度达62~65 ℃,此阶段持续6~8 d;之后待曲块温度回落至室温,将曲块传送至库房,贮存3 个月后出库,即制成增香高酯强化中高温大曲[16]。普通大曲除不接种菌种外用相同工艺生产。
1.3.9 大曲感官及主要理化指标检测
参照文献[17],制曲企业组织3名技术人员对入库曲坯进行感官评价并评分;参照文献[18]测定各曲心样品的酸度、糖化力、液化力、发酵力等理化指标。
1.3.10 大曲样品气相色谱-质谱分析条件
取5 g大曲样品置于20 mL顶空瓶中,压紧瓶盖。于55 ℃条件下顶空40 min后,用固相微萃取针萃取20 min。(萃取针使用前在250 ℃老化10 min,冷却到室温后依次用甲醇、乙醇、乙醚、正己烷、去离子水、甲醇清洗)手动进样,萃取针在进样口停留5 min。
气相色谱条件:TG-5MS毛细管柱(30 m×0.25 mm×0.25 μm);载气氦气(He),流速1 mL/min,不分流进样;进样口温度:240 ℃,柱箱温度为50 ℃;升温程序:起始温度为50 ℃,保持2 min,以4 ℃/min,升至240 ℃,保持5 min。
质谱条件:电子电离(electronic ionization,EI)源,能量70 eV,倍增电压1 400 V;离子源温度:250 ℃,接口温度:250 ℃;扫描范围:40~450 m/z,间隔0.3 s[19-20]。
定性定量方法同1.3.2节。
2 结果与分析
2.1 产香细菌的筛选与挥发性组分分析
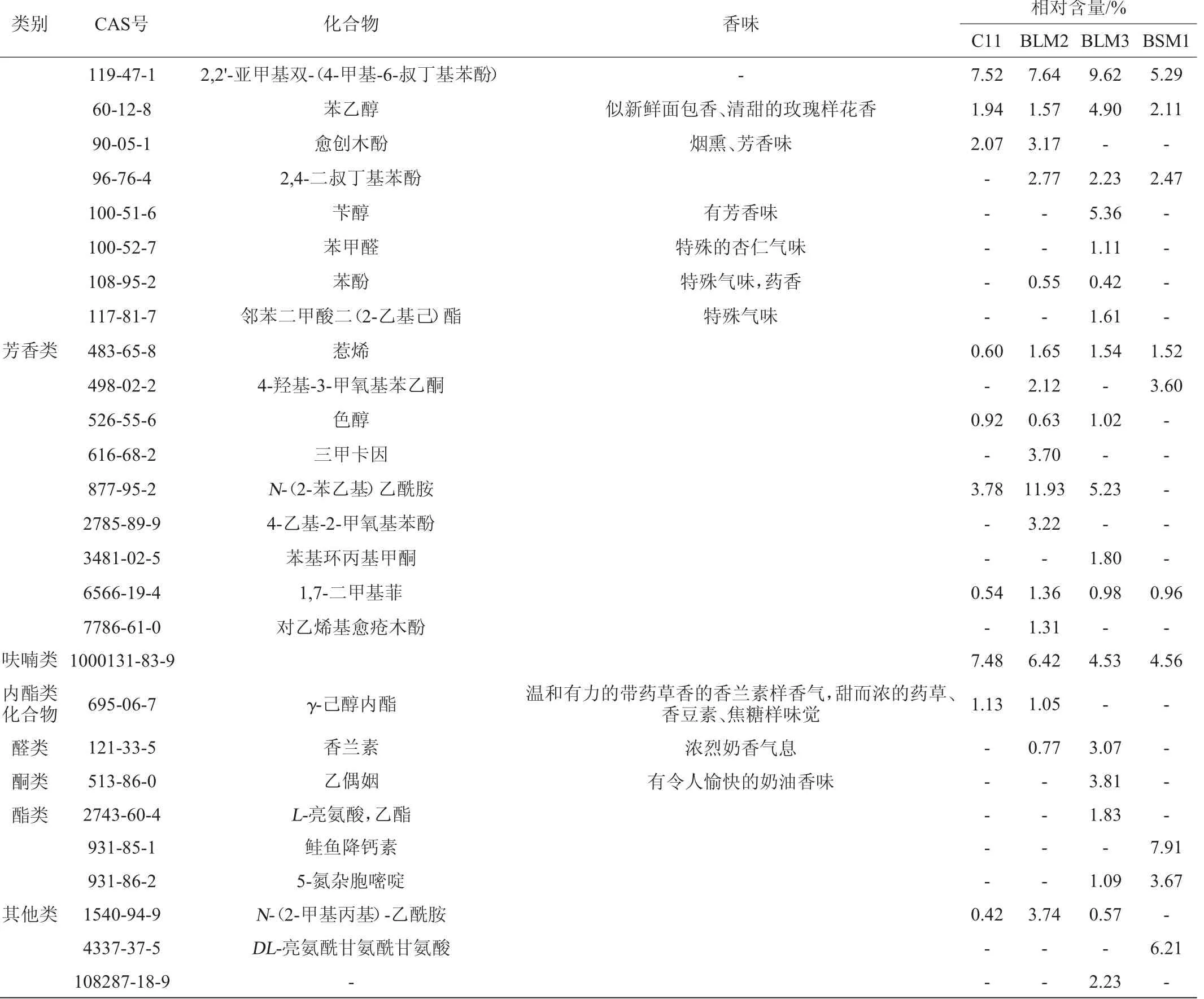
在白酒生产发酵堆积过程中取样获得共98株细菌进行为期2周的固体发酵,每隔一周进行一次感官鉴定。感官鉴定初筛表明,多数菌株发酵后呈霉豆渣味,少数呈甜香、果香和特殊香型,发酵第二周出现了少数酱香香型。经过感官鉴定复筛,综合鉴定人员意见,确定香味较为浓郁、舒适、稳定的呈甜香、果香、特殊香味的产香细菌有3株(BLM2、BLM3、BLM1)。以不接菌的麸皮培养基为对照,将此3株细菌和1株对照细菌C11进行固体发酵,样品经液液萃取处理后采用气相色谱质谱联用分析挥发性香味成分,挥发性成分检测结果见表1。

表1 3株产香细菌固态发酵产物中部分可挥发性化合物的GC-MS分析结果Table 1 Results of GC-MS analysis of volatile compounds in solid-state fermentation products of 3 aroma producing bacteria
续表
由表1可知,菌株BLM2和BLM3产生的风味化合物的种类多于菌株BSM1,包括醇类、芳香类化合物、内酯类、呋喃类、醛类、酮类、酯类等。菌株BSM1有较高的产三甲基吡嗪和四甲基吡嗪的能力,同时也有产生较高甘油、多肽类等物质的能力。菌株BLM2和BLM3检测到了二甲基吡嗪(具有烘烤、坚果、可可等香气)和三甲基吡嗪等多种吡嗪类化合物的产生能力,菌株BLM3还产生了另一种酱香型酒主体香味物质——乙偶姻(奶油香味),含量高达3.8%。经过16S rDNA测序结果表明3株菌分别为枯草芽孢杆菌(Bacillus subtilis)BSM1,地衣芽孢杆菌(Bacillus licheniformis)BLM2,地衣芽孢杆菌(Bacillus licheniformis)BLM3。
2.2 增香高酯强化大曲的生产工艺
大曲是一个含有多菌系、多酶系与复杂香气物质的整体,因此强化大曲制曲工艺要与传统大曲发酵工艺相结合,既要保持原有制曲工艺不做大的改动,又能赋予大曲更多复杂的香气物质。分批试验结果表明,产酯酵母种子、酯化红曲种子和曲母粉添加量>1.0%时,会造成培菌初期发酵温度上升过快,需要调整曲块间距,并且部分曲块容易变形,增加了操作困难。而添加量<0.5%时效果不明显,所以最终确定产酯酵母种子、酯化红曲种子和曲母粉的添加量为1.0%。由于中高温大曲中原细菌总量就占优势,为了不影响产酯酵母菌的良好生长,因此产香细菌的添加量要更小,将3株产香细菌扩大培养制得种子后混合,添加量分别为0.05%、0.10%、0.20%、0.30%,得到不同批次曲块,记录曲块发酵升温情况,得出产香细菌的添加量为0.10%,对成熟曲块的制曲工艺参数影响不大。因此经过多次反复的试验与论证,产香细菌种子、产酯酵母种子、酯化红曲种子和曲母粉最佳接种质量比分别为0.1%、1.0%、1.0%和1.0%,其余为种曲培养基。在此条件下制曲,获得强化曲与对照曲曲心温度变化曲线见图1。
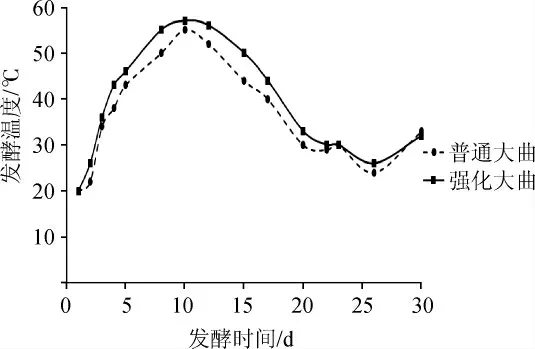
图1 强化曲与普通曲的曲心温度变化曲线Fig. 1 Change curves of central temperature of fortified Daqu and common Daqu
由图1可知,由于添加了一定比例的功能微生物和曲母,因此强化曲前期升温比较快,为避免影响曲块成型,强化曲在操作时会适当加大曲块之间的间距。工艺微调后,强化曲总体的发酵情况与对照相似,符合“前缓、中挺、后缓落”的变化规律。前期升温速度比普通曲略高,都在第10天左右升至顶火温度,强化曲顶火时间可维持时间较长,落火阶段也是缓慢落火。制备的强化大曲相对传统曲菌丝更为饱满,曲香更加突出、浓郁。对普通大曲与增香高酯强化大曲的颜色、香味等感官指标及理化指标进行对比,结果分别见表2和表3。

表2 强化大曲与普通大曲感官指标比较Table 2 Comparison of sensory indexes between fortified Daqu and common Daqu

表3 强化大曲与普通大曲理化指标比较Table 3 Comparison of physicochemical indexes between fortified Daqu and common Daqu
由表2可知,普通大曲与强化大曲在颜色上区别很小,都有着较浓的大曲特有的香味,皮张差别也不大,大曲的断面都较整齐,菌丝丰满,生长健壮,不同的是增香高酯强化大曲的断面菌丝更亮。从感官指标来看,增香高酯强化大曲符合浓香大曲的优级标准。
由表3可知,增香高酯强化大曲理化指标中,糖化力、液化力、酯化力、发酵力等重要指标比普通大曲都有明显提高,尤其是酯化力提升明显。
2.3 增香高酯强化大曲的产香成分检测结果
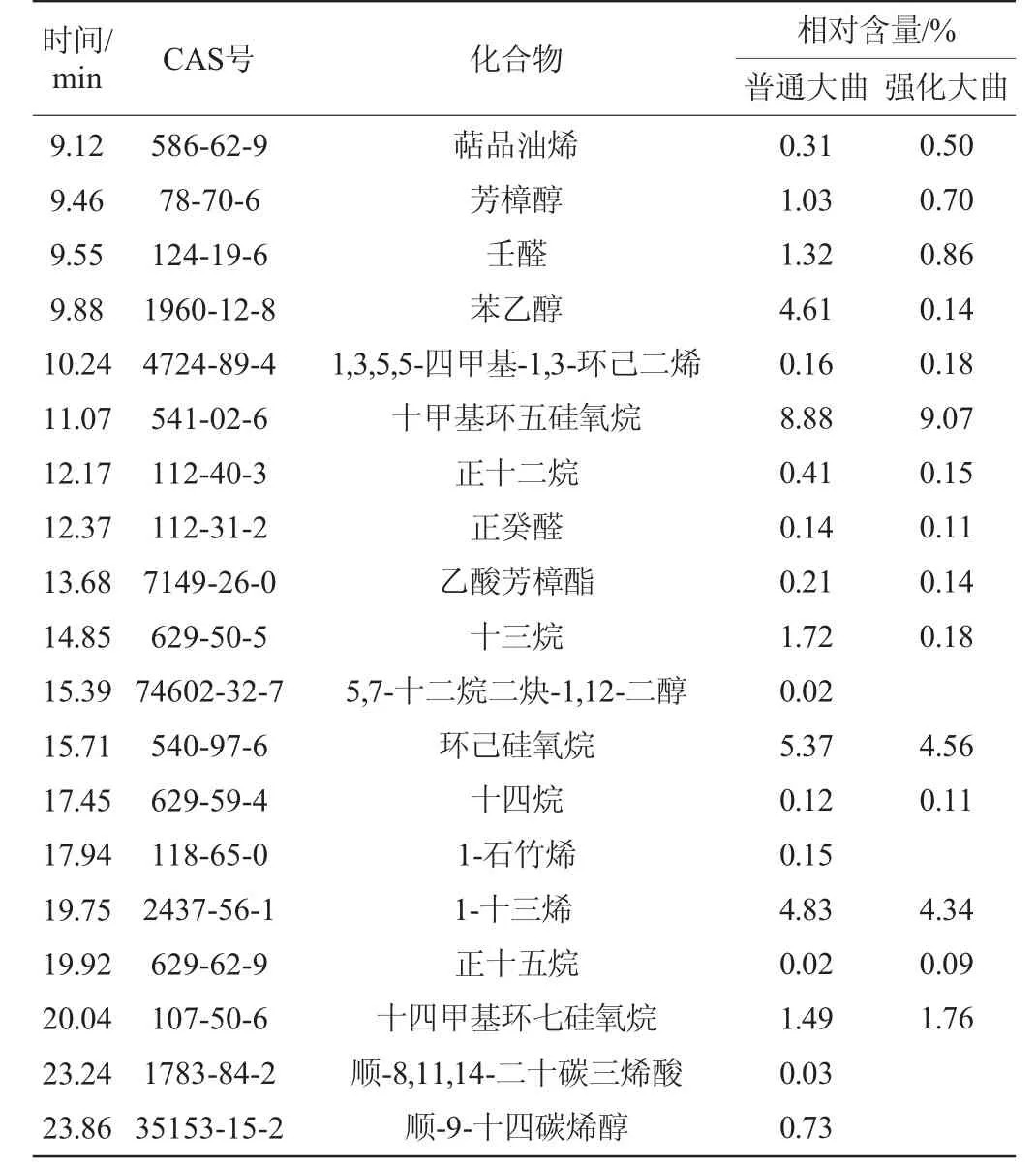
通过顶空-固相微萃取后按照气质联用法分析检测,采用面积归一化法计算组分相对含量[19],普通大曲和增香高酯强化大曲香味成分检测结果见表4。
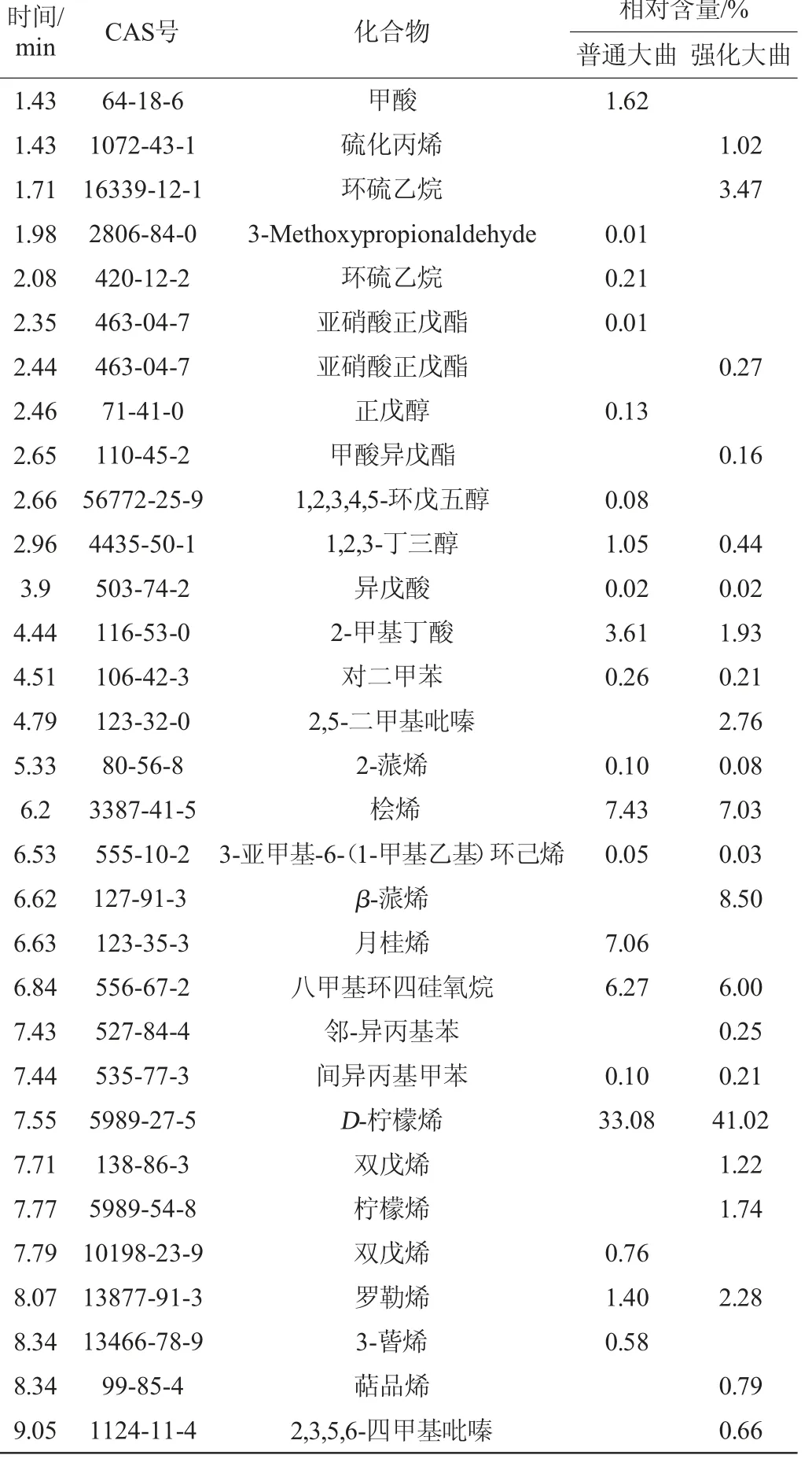
表4 强化大曲与普通大曲香气成分GC-MS分析结果Table 4 Results of GC-MS analysis of aroma compounds in fortified Daqu and common Daqu
续表
由表4可知,两种大曲共鉴定出香味物质50种,主要分为6大类化合物,其中包括酸类、醛类、醇类、酯类、吡嗪类、芳香族类、烷烃类、萜烯类化合物等。其中普通大曲醛类、醇类和酸类物质相对含量比增香高酯强化大曲高,尤其是醇类物质含量高,种类多;而酯类、吡嗪类、芳香族类、烷烃类,萜烯类化合物强化大曲明显比普通大曲种类多,含量高。其中D-柠檬烯含量最高,增香高酯强化大曲为41%,而普通大曲为33.1%。强化大曲还检测到吡嗪类物质,而普通大曲无此类成分。
3 结论
本研究在传统浓香型白酒生产工艺的基础上,通过接种产香细菌、酯化红曲,产酯酵母等特殊产香产酯菌类和曲母粉,加入强化中高温大曲生产,希望通过改变中高温大曲中的微生物种类和比例,增加大曲中特殊香味成分和酯化力,同时能提高大曲的品质和优质品率。通过初筛和复筛,从白酒发酵堆积产物中筛选到3株特殊产香细菌,通过GC-MS检测表明3株细菌都有产吡嗪类物质的能力。通过优化大曲中的菌种加入比例,得到的大曲通过感官和理化性质评测均优于原大曲,且能维持较长的顶点温度。通过GC-MS分析表明大曲中的香味成分组成比例和种类都和普通大曲有所区别,也检测到了吡嗪类物质。强化大曲的酯类,吡嗪类,芳香族类,烷烃类,萜烯类化合物等明显比普通大曲种类多,含量高,其中D-柠檬烯含量最高,强化大曲为41%,而普通大曲为33.1%。使用本强化中高温大曲到浓香型酿酒生产中,预期可以适当增加中高温大曲酱香味,改善浓香型白酒的香味物质组成,增加了河南地域浓香型白酒香味的丰富性。
