基因工程大肠杆菌BL21产β-甘露聚糖酶的代谢流研究
2019-03-08许超群张小龙伍业旭
黄 聪,李 啸,*,许超群,张小龙,叶 晗,程 奔,伍业旭
(1.三峡大学 生物与制药学院,湖北 宜昌443003;2.安琪酵母股份有限公司,湖北 宜昌443003)
β-甘露聚糖酶是一类能够水解含β-1,4-D-甘露糖苷键的内切水解酶[1],可以水解葡萄甘露聚糖、甘露聚糖、半乳甘露聚糖及半乳葡萄甘露聚糖等,广泛存在于自然界中。目前,β-甘露聚糖酶被用于多个领域,包括食品、饲料、医药、造纸、石油开采等领域[2-4],具有良好的应用前景。
代谢通量分析包括基于物料平衡的代谢通量、基于同位素示踪的代谢通量和基于基因组尺度的代谢通量,是研究代谢工程的一种重要的方法[5]。物料平衡代谢通量分析是基于化学计量系数的研究方法,它根据细胞内所有的生化反应方程式建立数学平衡模型,计算胞内外物质的代谢通量,基于物料平衡的代谢通量已被广泛应用于多项研究[6-9],然而关于β-甘露聚糖酶的代谢流的研究却鲜有报道[10]。本研究建立并验证了基因工程大肠杆菌(Escherichia coli)BL21产β-甘露聚糖酶的代谢流模型,分析菌体比生长速率和β-甘露聚糖酶合成通量最大时的极端代谢流分布,并对代谢网络节点(葡糖糖-6-磷酸、丙酮酸)进行分析,为基因工程大肠杆菌BL21产β-甘露聚糖酶的研究提供了理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
基因工程大肠杆菌BL21(含枯草芽孢杆菌(Bacillus subtilis)168来源的β-甘露聚糖酶基因):由安琪酵母菌种保藏中心提供,具有氨苄抗性。
1.1.2 培养基
斜面培养基:酵母蛋白胨10 g,NaCl 10 g,酵母抽提物5 g,琼脂粉15 g,121 ℃灭菌15 min。
种子培养基[11]:甘油8.00 g,酵母抽提物17.50 g,酵母蛋白胨7.50 g,NaCl 6.00 g,Na2HPO48.50 g,KH2PO44.25 g,K2HPO44.25 g,MgSO41.00 g,pH 7.0,121 ℃灭菌15 min。
发酵培养基:葡萄糖20.00 g,酵母抽提物13.32 g,Na2HPO·412H2O 17.10 g,KH2PO43.00 g,NaCl 0.50 g,MgSO40.24 g,微量元素10.00 mL/L,pH 7.0,121 ℃灭菌15 min。
微量元素[12]:FeCl31.23 g,Na2MoO40.06 g,ZnCl20.36 g,CuCl20.043 g,CaCl20.16 g,CoCl20.06 g,MnCl20.10 g,121 ℃灭菌15 min。
1.1.3 试剂
氨苄西林钠(分析纯):中诺药业(石家庄)有限公司;异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG):上海源叶生物科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
FUS-50 L(A)型新概念发酵罐:上海国强生化工程装备有限公司;PAS7000型生物尾气分析仪:重庆哈特曼科技有限公司;ZHWY-211D脚踏开门型大容量全温度恒温摇床:上海智城生物科技有限公司;SP-754型紫外可见光分光光度计:上海天普分析仪器有限公司;Chromaster高效液相色谱(high performance liquid chromatography,HPLC)仪:日立高新技术公司。
1.3 方法
1.3.1 培养方法
一级种子液:将斜面上的菌种接种至装液量为25 mL的250 mL三角瓶中,于37 ℃、200 r/min条件下培养24 h。
二级种子液:将一级种子液接种至装液量为500 mL的5 L三角瓶中,接种量4%(V/V),于37 ℃、200 r/min条件下培养24 h。
分批发酵:将二级种子液按4%(V/V)的接种量接入新概念发酵罐中,装液量为30 L,转速为200 r/min,通气量1.67 vvm,0.035 MPa条件下发酵培养12 h,第2小时末加入终浓度为0.4 mmol/L的IPTG(过滤灭菌)诱导β-甘露聚糖酶表达。
1.3.2 分析方法
葡萄糖含量:采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法进行测定[13];菌体浓度:采用分光光度计法测定[14],细胞干质量由干质量(y)与菌体浓度(x)的回归方程(y=0.441 86x-0.006 34)计算得到;乙酸含量:采用HPLC法测定[15];β-甘露聚糖酶活力:参考文献[16]。CO2释放速率:由Biostar 1.5在线分析控制系统计算。
t时刻的葡萄糖摄取通量[mmol(/g·h)]、乙酸分泌通量[mmol/(g·h)]、菌体合成通量(h-1)及CO2释放通量[mmol/(g·h)]的计算公式分别见(1)、(2)、(3)、(4)。

1.3.3 模型的构建与运算
ÖZKAN P等[17]已报道了重组大肠杆菌BL21表达外源蛋白质的模型,本研究在其基础上简化合并了部分代谢通路,并将β-甘露聚糖酶的代谢途径加入到简化的代谢网络中,构建了重组大肠杆菌BL21产β-甘露聚糖酶的代谢网络见图1。该代谢网络包括糖酵解(embden-meyerhof-parnas,EMP)途径、戊糖磷酸途径(hexose monophosphate pathway,HMP)、柠檬酸循环(citric acid cycle,TCA)、氨基酸和乙酸合成途径、回补反应、磷酸烯醇式丙酮酸-糖磷酸转移酶系统(phosphoenolpyruvate:carbohydrate phosphotransferase system,PTS)、菌体合成以及β-甘露聚糖酶的合成途径8个部分,共41个反应(表1),也即41个未知反应通量。

表1 代谢模型的反应式Table 1 Reaction formulas of metabolic model
采用CellNetAnalyzer 2018.1[18]计算代谢通量,将41个反应式输入CellNetAnalyzer,软件显示代谢网络的自由度为3,即需要3个反应通量即可求出所有41个未知通量。在本研究中,选择葡萄糖摄取通量、乙酸分泌通量和菌体合成通量3个外部可测通量,求解整个代谢通量的分布。
2 结果与分析
2.1 模型的验证
为了验证模型的准确性,将葡萄糖摄取通量(r1)、乙酸分泌通量(r25)和菌体合成通量(r41)输入至CellNetAnalyzer,从而获得整个代谢网络每步反应(r1~r41)的代谢通量。通过比较计算获得的CO2释放通量(r35)和实验测定获得的CO2释放通量,验证模型的可靠性。每小时重组菌E.coli BL21分批发酵产生的葡萄糖、乙酸、菌体干质量和CO2释放速率及其代谢通量的测定结果见表2。
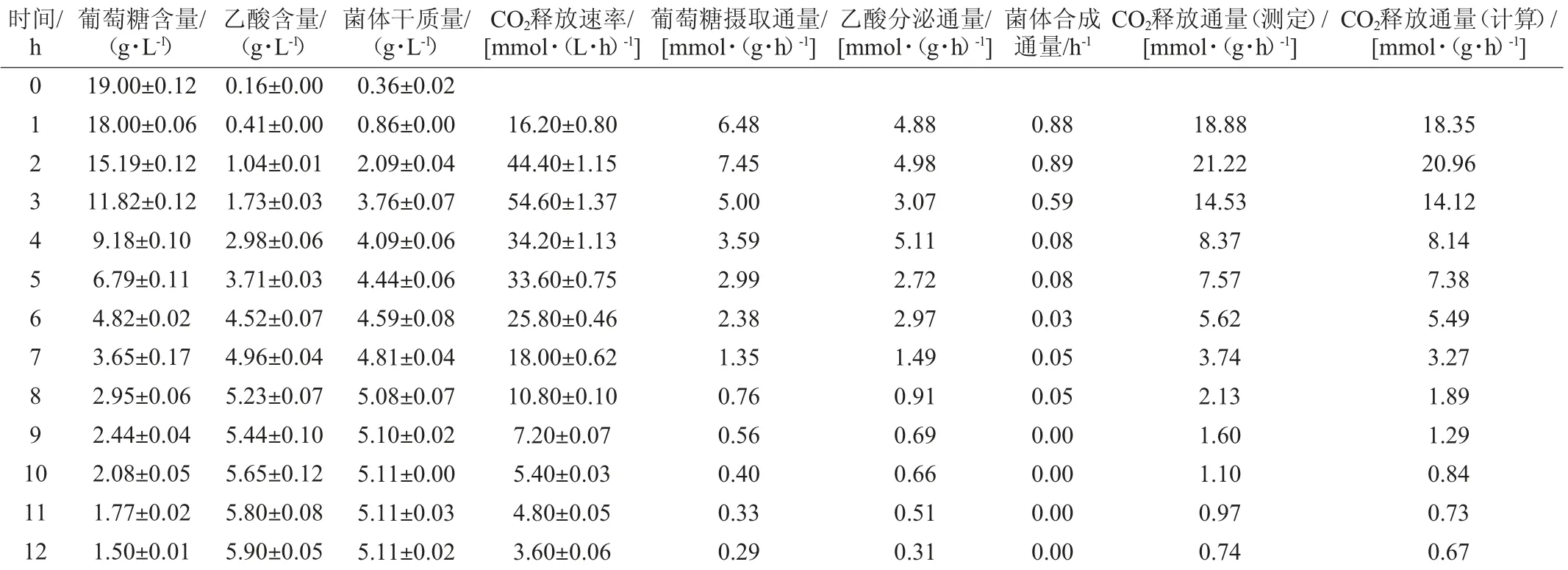
表2 部分物质的含量及代谢通量测定结果Table 2 Determined results of concentrations and metabolic fluxes of some substances
由表2可知,重组大肠杆菌BL21分批发酵0~12 h过程中,每个时刻计算得到的CO2释放通量与实验测定的每个时刻CO2释放通量无显著性差异(P>0.05),即由模型计算得到的CO2释放通量可以准确反映实际CO2释放通量,说明重组大肠杆菌产β-甘露聚糖酶的模型是可靠的,可以被用于大肠杆菌BL21产β-甘露聚糖酶的代谢流分析。
2.2 极端代谢流分布
2.2.1 菌体合成通量最大时的极端代谢流分布
在代谢网络中,由于代谢流的外溢造成底物浪费,降低了底物转化率,所以为了获得最大的菌体合成通量代谢流分布,将r25假设为0,即将乙酰辅酶A转化为乙酸的代谢通量假设为0。同时,令r40=0,也即β-甘露聚糖酶的通量为0,此时,计算得到的通量分布即为菌体合成通量最大时菌体代谢通量的分布。以葡萄糖通量为对照,标准化乙酸分泌和菌体合成通量。计算得到的41个反应的代谢通量,结果如表3所示。
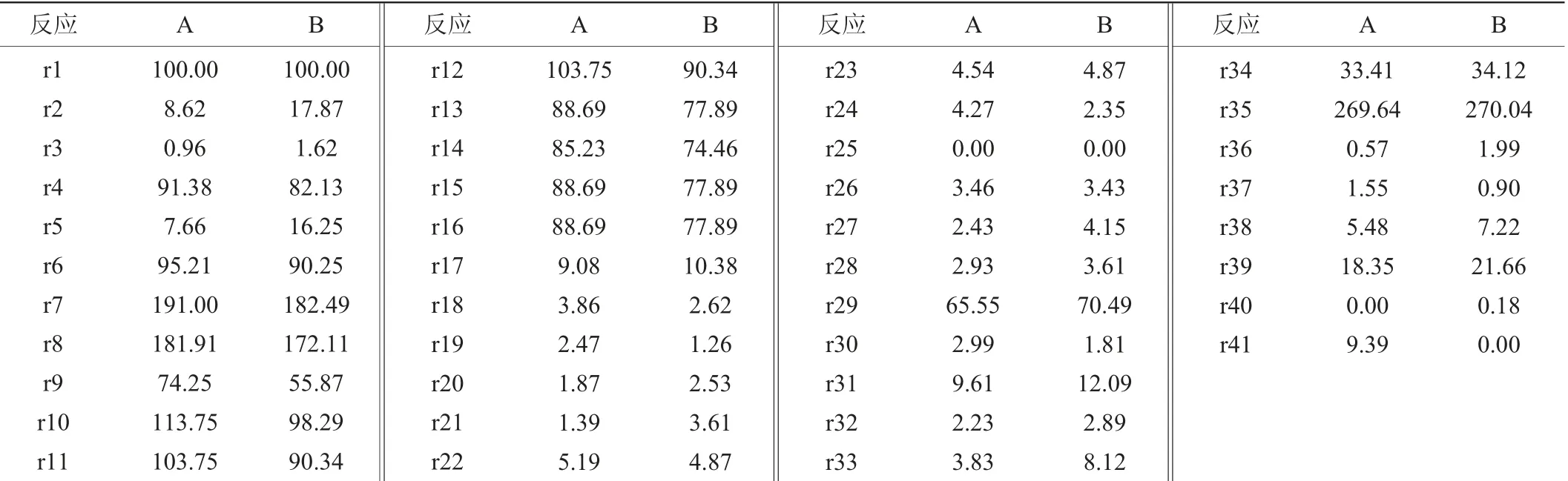
表3 两种极端代谢流分布Table 3 Distributions of two kind of extreme metabolic fluxes
由表3可知,当乙酸分泌通量和β-甘露聚糖酶合成通量均为0时,理论最大菌体合成通量r41为9.39 h-1。此时,流经HMP途径的通量r2为8.62 mmol(/g·h),流经EMP途径的通量r4为91.38 mmol(/g·h),也即8.62%的底物分配到HMP途径,91.38%的底物分配到EMP途径。此外进入TCA循环的流量r11为103.75 mmol(/g·h),但是考虑到葡萄糖经EMP途径进入TCA循环途径时,一分子的葡萄糖会变为为两分子的丙酮酸,所以真实分配到TCA循环途径的底物占初始底物的51.88%。
在生化网络中,EMP途径和TCA循环主要为细胞提供能量和部分前体物质,而HMP途径的生物学意义主要在于提供给细胞还原力和核酸合成前体[19]。根据代谢流分布结果可知,大量的底物被分配到EMP途径和TCA循环进行有氧呼吸,用来产生大量的三磷酸腺苷(adenosine triphosphate,ATP),这说明菌体生长需要大量的ATP供应。只有<9%的底物被分配到HMP途径,用来产生菌体增殖所必须的还原力和核酸。另外,由于丙酮酸是多种氨基酸生物合成的前体,所以丙酮酸流向TCA循环的流量被分流到氨基酸合成,导致TCA循环途径流量变小。
2.2.2 β-甘露聚糖酶合成通量最大时的极端代谢流分布
为了获得最大β-甘露聚糖酶合成通量,令r25=0且r41=0,也即乙酰辅酶A转化为乙酸的代谢通量和菌体合成通量均为0。以葡萄糖通量为对照,标准化乙酸分泌和菌体合成通量。计算得到的41个反应的代谢通量,结果如表3所示。
由表3可知,当乙酸分泌和菌体合成通量均为0时,理论最大β-甘露聚糖酶合成通量r41为0.18 mmol(/g·h)。此时,流经HMP途径的通量r2为17.87 mmol(/g·h),流经EMP途径的通量r4为82.13 mmol(/g·h),也即17.87%的底物分配到HMP途径,82.13%的底物分配到EMP途径。
根据HMP途径和EMP途径流量分配结果来看,在菌体表达外源蛋白β-甘露聚糖酶时,仍然有大量的底物被分解代谢产生能量供菌体合成β-甘露聚糖酶使用,同时,当β-甘露聚糖酶合成通量最大时,有17.87%的底物分配到HMP途径,与表3A中的HMP途径的通量相比,表3中HMP途径的通量增加了107.31%。说明当菌体进行外源蛋白β-甘露聚糖酶表达时,菌体对HMP途径产生还原力的需求更旺盛。
2.3 代谢节点分析
葡萄糖-6-磷酸连接着糖酵解途径和戊糖磷酸途径;丙酮酸连接着糖酵解途径、柠檬酸循环途径和部分氨基酸合成途径;这两个节点在生化网络中是关键性的节点,所以选择这两个节点进行分析。
2.3.1 葡糖糖-6-磷酸节点代谢流分析
两种不同极端代谢流在葡萄糖-6-磷酸节点的流向如图2所示,葡萄糖-6-磷酸一部分流向果糖-6-磷酸进入糖酵解途径,另一部分流向核糖-5-磷酸进入戊糖磷酸途径。
由图2可知,在两种极端代谢流分布情况下,葡萄糖-6-磷酸代谢流进入糖酵解途径(91.38/82.13mmol(/g·h))都占主导地位,剩余部分进入磷酸戊糖途径(8.62/17.87mmol(/g·h)),但两种情况下的代谢流分配仍有差异。进入糖酵解途径的代谢流在以菌体合成为主时较高,相反,进入戊糖磷酸途径的代谢流在以β-甘露聚糖酶合成为主时较高。结果表明,无论是合成菌体还是合成外源蛋白β-甘露聚糖酶,都需要大量的能量供给,并且在合成β-甘露聚糖酶时,菌体对戊糖磷酸途径的依赖性更高,同时也表明,葡萄糖-6-磷酸节点是一个受外界调控的节点。

图2 葡糖糖-6-磷酸节点代谢流分布Fig. 2 Metabolic flux distributions at glucose-6-phosphate node
2.3.2 丙酮酸节点代谢流分析
丙酮酸节点代谢流分布如图3所示,共有5部分构成,包括葡萄糖、磷酸烯醇式丙酮酸、草酰乙酸、乙酰辅酶A、氨基酸。
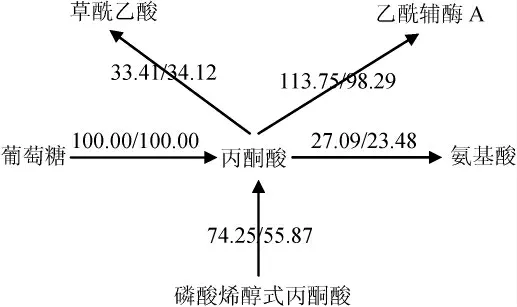
图3 丙酮酸节点代谢流分布Fig. 3 Metabolic flux distributions at pyruvate node
由图3可知,由于两种极端情况下,葡萄糖-6-磷酸节点流向糖酵解的通量不同(91.38/82.13 mmol(/g·h)),导致了两种极端情况下磷酸烯醇式丙酮酸流向丙酮酸通量的差异(74.25/55.87 mmol(/g·h)),也间接导致了丙酮酸流向乙酰辅酶A通量的差异(113.75/98.29 mmol(/g·h))。在两种极端条件下,丙酮酸流向草酰乙酸的通量是极度保守的(33.41/34.12 mmol(/g·h)),同时流向氨基酸的通量差异也很小(27.09/23.48 mmol(/g·h)),这些现象证实了丙酮酸节点是一个刚性节点,不受外界调控,与QUIRÓS M等[20]的研究结果一致。
3 结论
本研究成功构建了基因工程大肠杆菌(Escherichia coli)BL21合成β-甘露聚糖酶的代谢网络,建立了基于物料平衡的代谢流模型,并通过分批发酵验证模型是可靠的,应用该模型计算出最大菌体合成通量为9.39 h-1,最大β-甘露聚糖酶合成通量为0.18 mmol(/g·h)。菌体在合成β-甘露聚糖酶时,流向HMP途径的碳骨架增加了107.31%,HMP途径更为活跃。葡萄糖-6-磷酸节点是一个可调控的节点,而丙酮酸节点受外界环境调控较小,为理性改造产β-甘露聚糖酶大肠杆菌提供了理论基础,同时也为β-甘露聚糖酶的生产指明了调控方向。
