嗜水气单胞菌气溶素的表达纯化和活性实验
2019-03-07董靖刘永涛胥宁杨秋红杨移斌艾晓辉
董靖,刘永涛,胥宁,杨秋红,杨移斌,艾晓辉
(中国水产科学研究院长江水产研究所,武汉430223)
嗜水气单胞菌 (Aeromonashydrophila)是一种人兽鱼共患病原菌,广泛分布于水体、土壤和环境中,能够引起淡水养殖鱼类、陆生动物和人的多种疾病[1]。嗜水气单胞菌及其他运动性气单胞菌是可在世界范围内传播的水产动物致病菌,国内外的水产养殖业常因嗜水气单胞菌感染而导致巨大的经济损失[2]。嗜水气单胞菌感染鱼类后可以引起运动性气单胞菌败血症和出血性败血症,使患病鱼出现烂鳃、烂尾、竖鳞和溃疡等症状[3-4]。此外,Yousr等[5]研究发现嗜水气单胞菌可以通过水和未煮熟的水产品传染给人类。人感染该菌后能够导致肠胃炎、败血症及全身性感染,严重时甚至可危及生命[6]。抗生素是目前用于治疗细菌性疾病的主要手段,在水产养殖业中,嗜水气单胞菌感染的治疗也主要依赖于抗生素,但由于长期不合理的药物使用,导致该病原菌产生耐药性[7]。此外,抗生素的不合理使用会造成水产品中药物残留超标和水体中抗生素含量超标,引起食品质量安全问题和生态安全问题[8]。因此,近年来以毒力因子为靶标的药物研究受到国内外的广泛关注[2]。
近年来,大量研究表明,嗜水气单胞菌的致病力与其自身携带的毒力因子种类密切相关[9]。其中,嗜水气单胞菌分泌的外毒素气溶素是极其重要的毒力因子之一,是该菌引起各种疾病的物质基础,可以作为鉴别致病菌株的标志[10]。气溶素是一种水溶性蛋白,其前体经蛋白酶酶切后成为具有生物学活性的气溶素,具有细胞毒性、溶血性和肠毒性[11]。气溶素通过特定的糖蛋白受体结合到真核细胞表面,形成具有孔道的七聚体插入到脂质双分子层中,从而导致细胞死亡[12]。
基于以上情况,本研究通过研究重组气溶素的纯化方法和生物活性,以期筛选能抑制气溶素活性的小分子化合物,为抗嗜水气单胞菌药物的研发提供新思路。目前国内学者对气溶素的表达、纯化和生物活性测定进行了大量的研究,但大部分研究得到的主要目的产物为包含体,且未对重组蛋白进行精细纯化[13-15],不利于药物筛选和功能性试验的开展。因此,本研究在总结文献的基础上,采用含有谷胱甘肽巯基转移酶(GST)标签的pGEX-6p-1 载体构建了重组载体,以期提高重组蛋白的可溶性。通过优化表达温度和诱导时间,建立了气溶素前体(Pre-AerA)可溶性蛋白的表达方法,同时建立了气溶素的离子交换纯化方法,得到了纯度95%以上的目的产物,并对其溶血活性进行了测定,为进一步研究以气溶素为靶标的抗嗜水气单胞菌的小分子药物开展铺垫性工作。
1 材料与方法
1.1 材料和试剂
嗜水气单胞菌ATCC7966购自中国科学院微生物研究所,原核表达载体pGEX-6p-1、大肠杆菌克隆菌株DH5α、表达菌株BL21(DE3)购自武汉擎科生物科技公司,DNA聚合酶、限制性内切酶、T4连接酶和IPTG购自Thermo Scientific公司,DNA片段凝胶回收试剂盒、质粒提取试剂盒购自美国Omega公司,Glutathione Sepharose 4B购自美国GE Healthcare公司。
1.2 目的基因扩增
根据GenBank中嗜水气单胞菌ATCC7966株的基因组序列(NC008570.1)设计特异性引物,为了便于连接载体分别在上下游引物的5′端添加BamHI和NotI酶切位点。以ATCC7966菌株的全基因组为模板扩增全长的气溶素(aerA)基因,用DNA片段凝胶回收试剂盒纯化DNA片段。
1.3 分子克隆和鉴定
将纯化回收的aerA片段和pGEX-6p-1载体用BamHI和NotI双酶切,回收后将片段与载体以3∶1(V/V)混合后加入T4 DNA连接酶,置于16 ℃水浴中过夜连接。次日将连接产物转化至大肠杆菌DH5α感受态中并涂布到含有100 μg/mL氨苄西林抗生素的LB平板上,平板置于37 ℃培养箱中过夜培养。随机挑取平板上的单菌落,置于含有100 μg/mL氨苄西林抗生素的液体LB培养基中振荡培养16 h,提取质粒进行PCR鉴定,阳性质粒进行双酶切鉴定并测序。
1.4 诱导表达分析
选取测序正确的质粒样品转化至大肠杆菌BL21(DE3)菌株中,从LB平板上挑取单菌落,接种至含有100 μg/mL氨苄西林抗生素的液体LB培养基中,振荡培养过夜。取培养后的菌液按1∶100(V/V)的比例接种至新鲜的LB液体培养基中(含有100 μg/mL氨苄西林)扩大培养,检测培养物的OD600nm吸收值。当OD600nm达到0.6~0.8时,加入终浓度为1 mmol/L 的IPTG,继续诱导6 h后于10 000 r/min下离心收集菌体,用PBS重悬后,通过12% SDS-PAGE电泳分析蛋白表达情况。
1.5 表达形式分析
为了得到具有活性的可溶性蛋白,本实验研究了温度对重组蛋白表达形式的影响。当菌液OD600nm达到0.6~0.8时,将菌液分别放置在37 ℃和16 ℃摇床中,分别加入终浓度为1 mmol/L和0.2 mmol/L的IPTG,继续诱导6 h后收集菌体。菌体用PBS重悬后,分别加入终浓度为1 mg/mL的溶菌酶,于冰上反应30 min,结束后以15 000 r/min离心10 min,分别收集上清和沉淀,通过12% SDS-PAGE电泳分析上清和沉淀中的目的蛋白。
1.6 诱导时间优化
为了使重组蛋白表达量最大化,分析了不同诱导时间下的蛋白表达量。分别在诱导前和诱导后的4、8、12、16和20 h收集菌体,通过12% SDS-PAGE电泳分析诱导时间对蛋白表达量的影响。
1.7 重组蛋白的诱导表达和纯化
将重组菌株接种至20 mL含有氨苄青霉素(100 μg/mL)的LB液体培养基中,在37 ℃条件下振荡培养过夜,然后按照1∶100(V/V)的比例将菌液转接至1 L含有100 μg/mL氨苄青霉素的LB培养基中,在37 ℃中培养至OD600nm为0.6时将菌液降温至16 ℃,然后加入终浓度为0.2 mmol/L的IPTG,置于16 ℃培养箱中继续培养16 h。5 000 r/min收集菌体,并重悬于PBS溶液中。
将收集的菌体超声破碎,4 ℃条件下16 000 r/min离心30 min,收集裂解上清,加入到Glutathione SepharoseTM4B 亲和层析柱中,以重力反复过柱3次,然后用PBS洗脱杂蛋白,加入PreScission蛋白酶(1 mg/mL)在4 ℃中酶切过夜。用PBS洗脱目的蛋白,收集的目的蛋白用超滤管超滤脱盐,将缓冲液替换为离子交换A液(20 mmol/L Bis-Tris,pH 6.8)。脱盐后的目的蛋白过Hitrap Q阴离子交换柱,以离子交换B液(20 mmol/L Bis-Tris,500 mmol/L NaCl,pH 6.8)洗脱目的蛋白,收集含有目的蛋白的组分,进行SDS-PAGE分析。将纯度较高的目的蛋白合并,通过超滤法将缓冲液替换为AerA储存液(25 mmol/L Tris,150 mmol/L NaCl,pH 8.2),测定浓度后置于-80 ℃冰箱保存。
1.8 重组Pre-AerA的溶血活性测定
取纯化的Pre-AerA,加入胰蛋白酶使其终浓度为10 μg/mL,在室温条件下酶切10 min以激活,然后加入10倍浓度的胰蛋白酶抑制剂终止反应。AerA的溶血活性通过其对绵羊红细胞的溶解能力来测定。在溶血缓冲液(20 mmol/L Tris,150 mmol/L NaCl,pH 7.2)中分别加入质量浓度为64、32、16、8、4和2 ng/mL的AerA,然后加入25 μL脱纤维绵羊红细胞,在37 ℃中孵育15 min,10 000 r/min离心后测定上清液OD543nm吸收值,以1% Triton X-100代替AerA作为阳性对照,溶血百分比计算公式见式(1)。一个单位的溶血活性(HU)定义为能够导致绵羊红细胞释放出一半血红蛋白需要的AerA的量。

式(1)
式(1)中,A表示吸光值。
2 结果
2.1 aerA-pGEX-6p-1表达载体构建
通过PCR扩增得到了编码Pre-AerA的DNA片段,图1所示为aerA基因的琼脂糖凝胶电泳图,发现在1 500 bp附近有特异性扩增条带,其分子量大小与预期一致。该片段和载体经双酶切、连接后转化至大肠杆菌DH5α菌株中,挑取的4个单菌落经菌液PCR鉴定后发现菌落1、3、4、5含有aerA基因,2号菌落为空载体菌液PCR对照(图2)。提取阳性克隆菌落的质粒后,经双酶切鉴定发现有5 kb左右的质粒条带和1.5 kb左右的目的基因条带(图3),最终通过测序确定该片段与嗜水气单胞菌ATCC7966菌株气溶素基因同源性为100%。

图1 aerA基因PCR电泳图M: DNA分子量标准;1和2: aerA基因。Fig.1Electrophoretogram of aerA gene by PCR amplificationM: DNA marker; 1 and 2: PCR product of aerA.
2.2 Pre-AerA的表达和条件优化
重组表达菌在37 ℃、1 mmol/L IPTG条件下诱导表达6 h后,取菌体进行12% SDS-PAGE分析。从图4中可以看到,与诱导前相比,诱导后的大肠杆菌在分子量约为81 kDa处有融合蛋白表达条带,与理论分子量81 kDa一致,说明该重组载体在大肠杆菌BL21(DE3)菌株中能够表达。
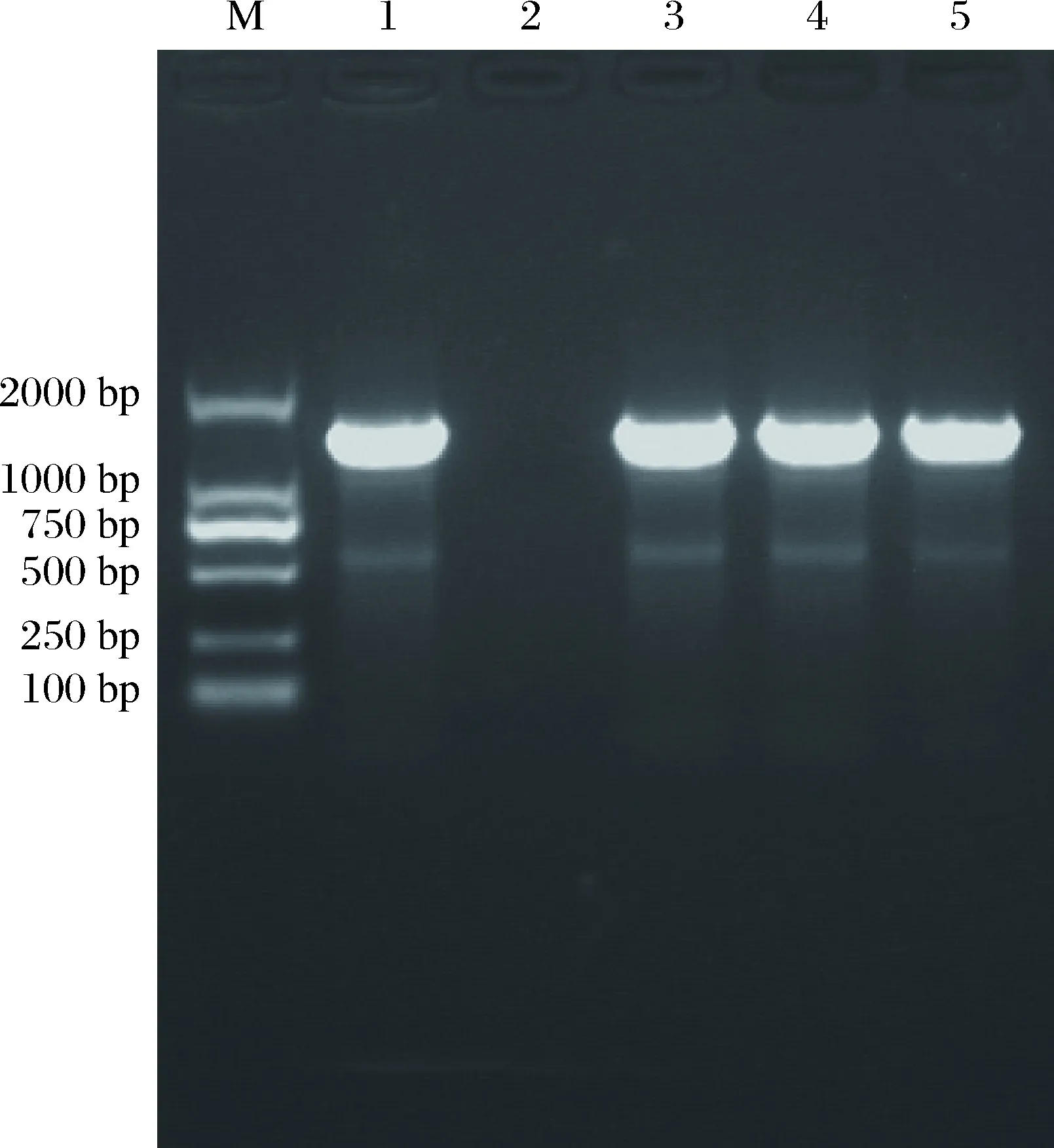
图2 菌液PCR鉴定电泳图M: DNA分子量标准;1, 3, 4, 5: 含有重组载体的菌液; 2: 空载体菌液。Fig.2Electrophoretogram of bacteria liquid PCRM: DNA marker; 1,3,4,5: PCR of recombinant vector; 2: PCR of blank vector.
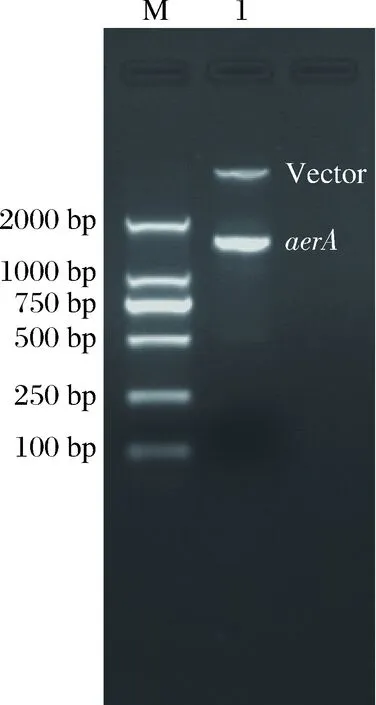
图3 重组质粒双酶切电泳鉴定图M:DNA分子量标准;1:质粒双酶切。Fig.3Electrophoretogram of double digestion of the recombinant plasmidM: DNA marker; 1: double digestion of the plasmid.
为了分析重组蛋白在不同温度下的表达形式,分别分析了37 ℃和16 ℃两个温度诱导下的表达情况。收集的菌体经溶菌酶裂解后高速离心,分别取上清和沉淀进行SDS-PAGE分析。如图5所示,16 ℃条件诱导下目的蛋白大部分位于裂解上清中,说明于16 ℃表达时该蛋白为可溶性表达;而37 ℃表达时目的蛋白位于裂解后的沉淀中,说明于37 ℃表达时该蛋白的表达形式为包含体。如图6所示,为了得到最大表达量,对诱导时间进行了优化,发现当加入IPTG诱导16 h后,气溶素融合蛋白的表达量达到最大。因此,为了得到具有生物学活性的可溶性蛋白,在试验中选择的表达温度为16 ℃,IPTG浓度为0.2 mmol/L,诱导时间为16 h。
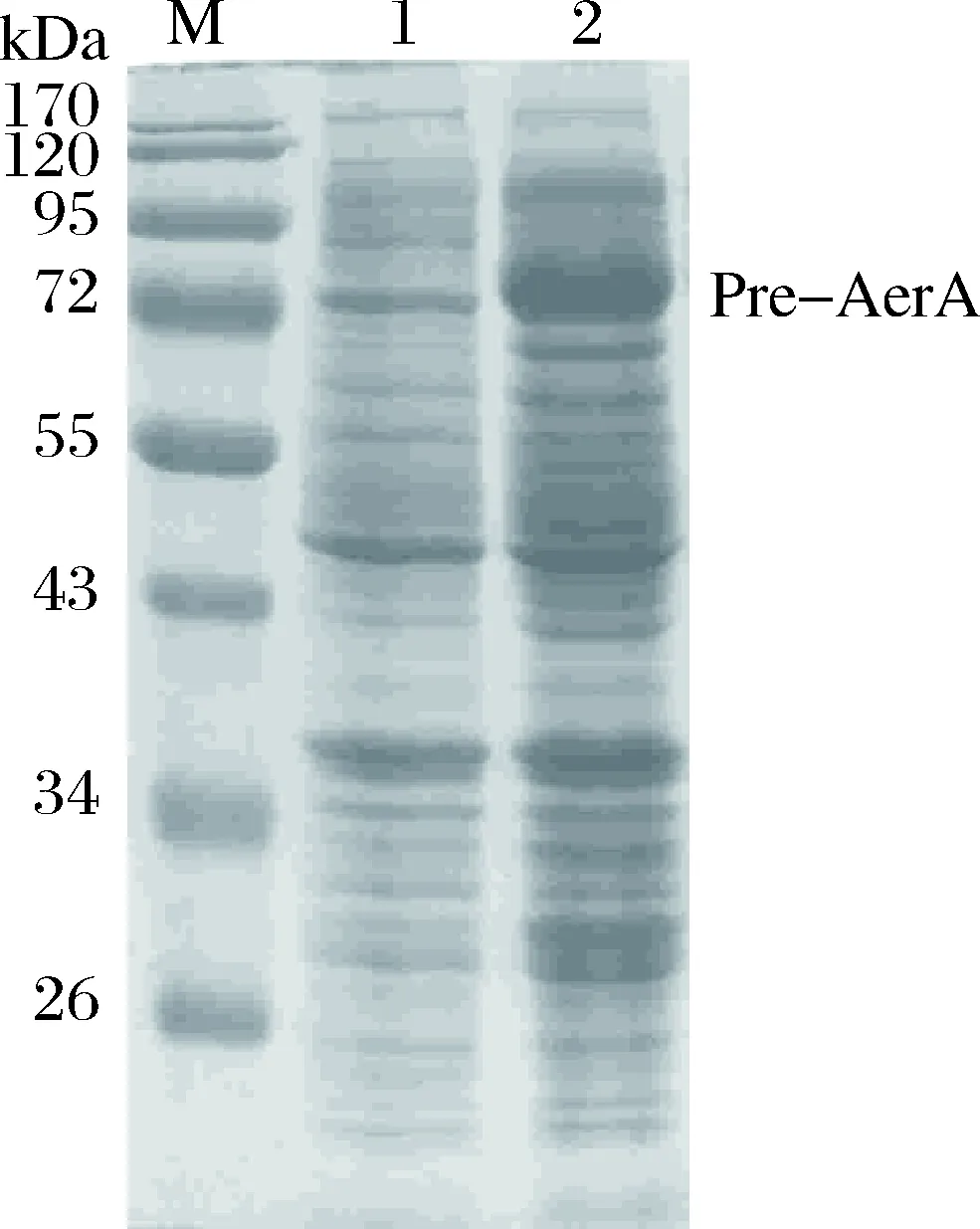
图4 气溶素融合蛋白预表达SDS-PAGE电泳图M: 蛋白质分子量标准;1: 诱导前;2: 37 ℃诱导6 h。Fig.4SDS-PAGE gel of pre-AerA expressionM: protein marker; 1: before induction; 2: induced at 37 ℃ for 6 h.
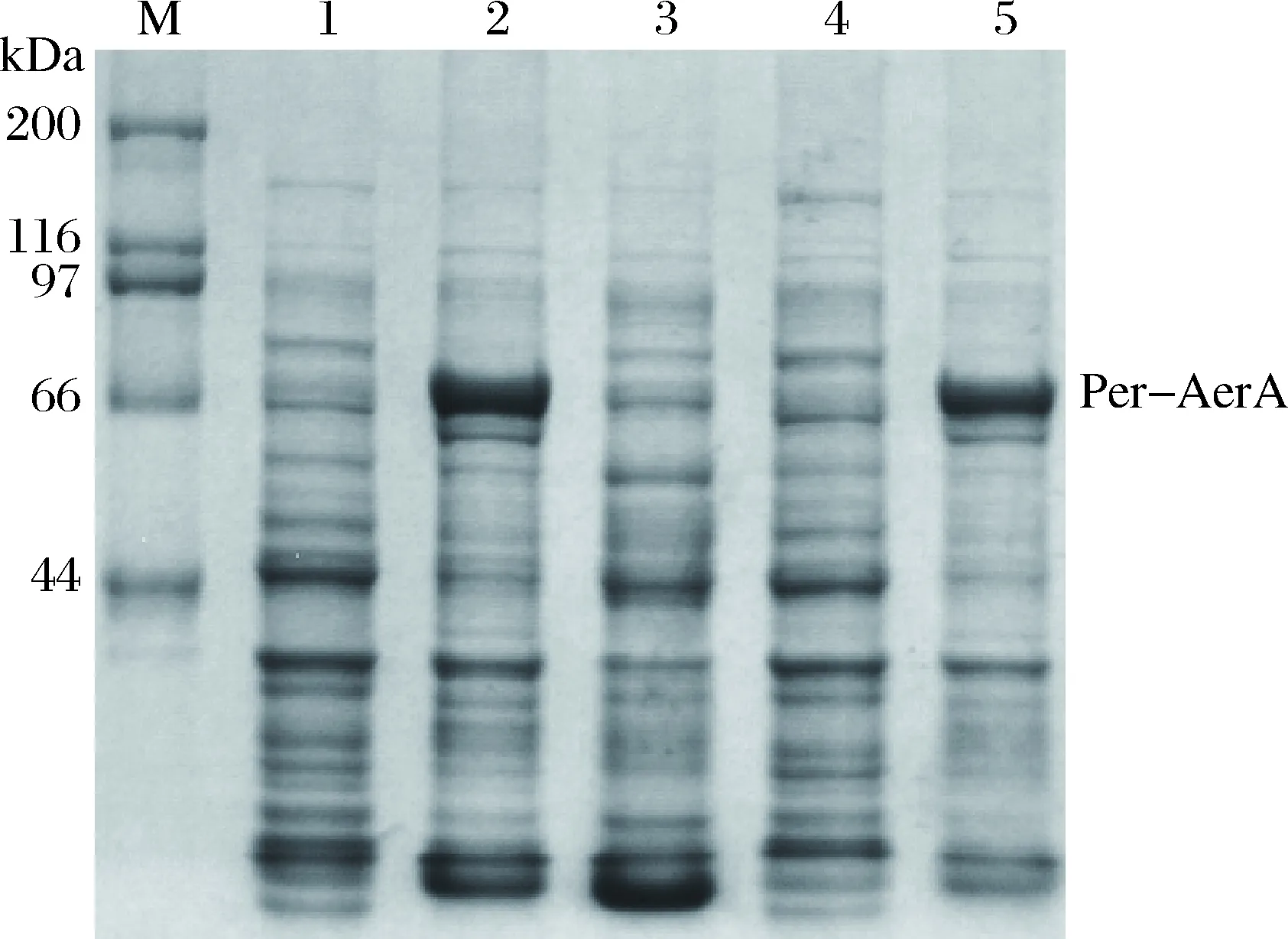
图5 不同温度下的表达形式SDS-PAGE电泳图M: 蛋白质分子量标准;1: 诱导前;2: 16 ℃诱导后菌体裂解上清;3: 16 ℃诱导后菌体裂解沉淀;4: 37 ℃诱导后菌体裂解上清;5: 37 ℃诱导后菌体裂解沉淀。Fig.5SDS-PAGE gel of the expressional form in different temperaturesM: protein marker; 1: before induction; 2: bacterial lysis supernatant after induced at 16℃; 3: bacterial lysis precipitation after induced at 16 ℃; 4: bacterial lysis supernatant after induced at 37 ℃; 5: bacterial lysis precipitation after induced at 37 ℃.
2.3 蛋白纯化
将表达后的菌体超声破碎和离心后,收集裂解上清液进行亲和层析,得到初步纯化的蛋白。将所得蛋白合并脱盐后进行离子交换纯化,经SDS-PAGE电泳检测得到纯度较高的目的蛋白(图7)。重组蛋白纯度经BandScan (Glyko)软件初步计算大于95%,符合试验要求。
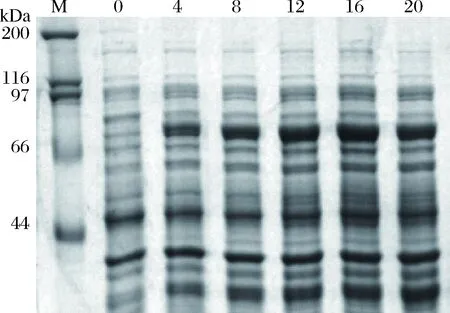
图6 不同诱导时间表达量SDS-PAGE电泳图M:蛋白质分子量标准;0:诱导前;4:诱导4 h后;8:诱导8 h后;12:诱导12 h后;16:诱导16 h后;20:诱导20 h后。Fig.6SDS-PAGE gel of target protein induced with IPTG in different timesM: protein marker; 0: before induction; 4: induced for 4 h; 8: induced for 8 h; 12: induced for 12 h; 16: induced for 16 h; 20: induced for 20 h.
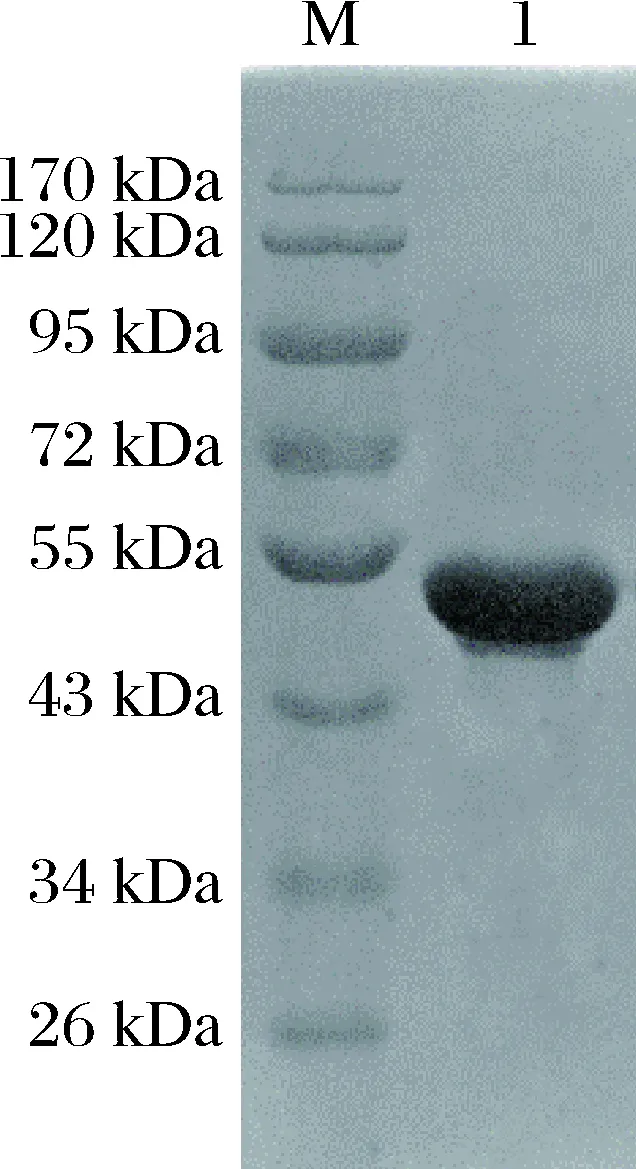
图7 离子交换纯化后的蛋白SDS-PAGE电泳图M: 蛋白质分子量标准;1: 纯化的气溶素前体蛋白。Fig.7SDS-PAGE gel of recombinant protein after anion exchange purificationM: protein marker; 1: purified pro-aerolysin.
2.4 重组Pre-AerA的溶血活性
将胰蛋白酶激活的Pre-AerA蛋白加入到溶血体系中进行溶血试验,结果如图8所示,随着AerA浓度的增加,其溶血活性逐渐增强。将受试蛋白能引起一半红细胞裂解的量作为一个溶血单位(hemolytic unit,HU),经测定在本实验条件下AerA对绵羊红细胞的溶血单位为54.17 HU/μg。
图8 不同质量浓度气溶素下绵羊红细胞的溶血活性Fig.8 Hemolysis assay of aerolysin by sheep red blood cells
3 讨论
很多病原菌通过分泌毒素导致各种疾病的发生,其中有一部分毒素能够在靶细胞表面产生孔道致细胞损伤,这类毒素被称为成孔毒素[16]。成孔毒素分为两类,一类是能够在细胞表面产生多孔结构域而导致细胞死亡的酶;另一类破坏细胞的渗透压导致细胞死亡,这一类也被称为溶细胞素[17]。目前已发现和鉴定了多种细菌分泌的溶细胞素,其中AerA是最重要、研究最多的溶细胞素之一[18]。通过动物实验已经证明AerA是嗜水气单胞菌的主要毒力因子,并与嗜水气单胞菌的致病力密切相关[19]。AerA单体是分子量约为52 kDa的水溶性蛋白,在细菌中以前体形式表达并分泌到细胞外,能被细胞表面的弗林蛋白酶、消化酶或细菌分泌的蛋白酶酶切形成有活性的单体形式[20]。AerA单体本身不具备孔道结构,为了成孔,需要结合到细胞表面的糖基磷脂酰肌醇(GPIs)受体上,聚合成孔后插入细胞膜中。GPIs受体是一组广泛存在于真核细胞细胞膜上的糖脂复合物,因此多数真核细胞对AerA敏感[18]。
目前得到AerA纯蛋白有从胞外成分中分离纯化和原核表达纯化两种方式。从胞外成分中分离的蛋白具有较好的生物学活性,但其操作复杂且产率较低,因此近年来原核表达成为获得AerA蛋白的主要方式。Pre-AerA是一种外分泌性蛋白,为了得到可在大肠杆菌胞内高表达的Pre-AerA融合蛋白以便于后期纯化,在设计PCR引物时去除了1~23位氨基酸的信号肽区域,以保证该基因在大肠杆菌胞内的高效表达[21]。杜娜等[14]、卢强等[15]分别在PET28b和PET32a质粒上构建了气溶素重组载体,但其表达形式为包含体。廖鏖等[22]采用pGEX-4T-1载体成功表达了含有GST标签的林蛙嗜水气单胞菌气溶素,但未对温度和诱导剂浓度进行优化,得到的重组蛋白均为包含体形式。朱大玲[13]研究了不同温度下重组工程菌的表达形式,发现重组菌株在25 ℃时有少量Pre-AerA以可溶性蛋白形式表达,但大部分仍位于包含体中。本实验为了提高Pre-AerA重组蛋白的可溶性表达,降低目的蛋白的包含体含量,选择了能提高重组蛋白可溶性的pGEX-6p-1载体,该载体在重组蛋白N端含有分子量为26 kDa的谷胱甘肽巯基转移酶(GST)标签。但在37 ℃,1 mmol/L IPTG诱导时重组蛋白表达形式仍为包含体(图5)。根据Vera等[23]研究发现降低温度可以提高蛋白的正确折叠,使目的蛋白包含体形成最小化。因此本实验尝试将温度降低至16 ℃,IPTG浓度降低为0.2 mmol/L后进行诱导,结果发现该条件下重组蛋白为可溶性表达(图5)。
重组蛋白在亲和层析后加入PreScission蛋白酶切除N端GST标签,在重组蛋白N端仍含有标签蛋白的5个氨基酸残基(GPLGS),但从溶血试验结果分析,残留的氨基酸未对Pre-AerA的功能产生影响。龚晖等[24]通过亲和层析法纯化得到了嗜水气单胞菌气溶素,发现其对绵羊红细胞的溶血效价为6.4 HU/μg,涂小林等[25]通过硫酸铵沉淀、纤维素层析和凝胶过滤纯化得到了气溶素,发现其对鲫红细胞的溶血效价为15.23 HU/μg。通过溶血单位比较发现本实验所得到的气溶素溶血活性远高于以上两种方式,初步分析原因可能与溶血试验方法、纯化温度条件、纯化方法及终产物纯度等因素有关。此外,气溶素对不同动物来源的红细胞的敏感性也有较大差异[25]。
综上所述,本实验成功构建了aerA-pGEX-6p-1原核表达载体,通过在目的蛋白N端融合提高可溶性的GST标签、降低表达温度和诱导剂浓度等方法,在大肠杆菌BL21(DE3)菌株中成功表达得到了可溶性Pre-AerA融合蛋白。融合蛋白经Glutathione SepharoseTM4B亲和层析柱初步纯化并切除标签蛋白后,根据等电点选择阴离子交换法对蛋白进行精细纯化,最终得到了纯度较高、电荷一致的重组蛋白。本实验建立了重组气溶素溶血活性的测定方法,其对绵羊红细胞的溶血单位为54.17 HU/μg,为下一步药物筛选和机制研究有较好的指导作用。
