黄颡鱼腹水征病原菌的分离与鉴定
2019-03-07周勇江南曾佳范玉顶刘文枝司凯歌曾令兵
周勇,江南,曾佳,范玉顶,刘文枝,司凯歌,曾令兵*
(1. 中国水产科学研究院长江水产研究所,武汉 430223; 2. 华中农业大学水产学院,武汉 430070;3. 上海海洋大学水产与生命科学学院,上海 201316)
黄颡鱼(Pelteobagrusfulvidraco)隶属于鲶形目(Siluriformes)、鲿科(Bagridae)、黄颡鱼属(Pelteobagrus),广泛分布于中国的江河湖泊中,是中国重要的特种淡水养殖品种[1]。据统计,2017年中国黄颡鱼养殖总产量为48万 t,比上年增长15%[2]。然而,随着黄颡鱼养殖规模的扩大,养殖集约化程度的提高以及养殖产量的增加,黄颡鱼的病害发生日渐严重,特别是由细菌引起的病害问题尤为突出,已威胁到黄颡鱼养殖业的健康发展[3]。黄颡鱼细菌性疫病包括溃疡病[3]、红头病[4]、腹水征[5]、败血症[6]等。近年来,黄颡鱼腹水征的发病频率日趋增高,其主要症状表现为腹腔内含有大量淡红色积水,鳍条充血、肛门红肿、鱼体表面溃烂等[5,7-8]。
2017年7月,湖北省荆州市黄颡鱼主养区域的池塘暴发黄颡鱼腹水征,引起养殖黄颡鱼大规模死亡。其发病的主要症状为腹部膨大、腹腔中充满大量半透明积水,但并无鳍条充血、肛门红肿、鱼体表面溃烂等特征,与以往报道的腹水征症状有所不同。本研究从该区域患病黄颡鱼肝脏中分离到一株细菌。通过菌体形态观察、回归感染试验、细菌生化鉴定和16S rDNA序列分析等方法对该菌进行了鉴定,同时,开展了患病鱼组织病理观察以及该菌敏感药物的筛选等研究,旨在查明该例黄颡鱼腹水征的病原,为该病的诊断与防控技术的进一步研究提供参考。
1 材料与方法
1.1 实验材料
1.1.1 实验动物
1.1.2 主要试剂与仪器
Taq DNA聚合酶、10×PCR 缓冲液、dNTPs、DNA marker 购自宝日医生物技术(北京)有限公司;药敏试剂盒购自杭州天和微生物试剂有限公司;BUG液体培养基和BHI液体培养基购自美国BD公司;Biolog细菌鉴定试剂盒和IF-A接种液购自美国Biolog公司;全自动微生物鉴定系统(Biolog GENIII OmniLog型)购自美国Biolog公司;PCR扩增仪(T-professional型)购自德国Biometra公司;凝胶成像系统(Chemidoc XRS型)购自美国Bio-Rad公司。
1.2 实验方法
1.2.1 病原分离与形态观察
用70%酒精将患腹水征黄颡鱼的体表消毒后,置于生物安全柜中进行解剖,取出肝脏,涂布于BHI琼脂平板上,于30 ℃恒温培养48 h。挑取平板中优势菌落,重新划线培养于BHI琼脂平板上,于相同的条件下培养,得到纯化的单菌落。挑取单菌落接种到5 mL BHI液体培养基中,于30 ℃、200 r/min条件下培养。待菌液OD600=0.5时,取出部分菌液用于革兰氏染色和负染观察[9-10],菌液加入甘油后分装到1.5 mL EP管中,置于-86 ℃超低温冰箱保存备用。分离的菌株命名为XJH01。
1.2.2 回归感染试验
将超低温保存的XJH01菌株接种于BHI液体培养基中,30 ℃、200 r/min振荡培养。待菌液OD600=0.5时,4 000 r/min离心菌液2 min。弃上清,沉淀用无菌PBS洗涤,重复离心洗涤3次。经平板菌落计数法测定出细菌浓度后,用无菌PBS将细菌10倍稀释至106、107、108和109CFU/mL。将暂养的健康黄颡鱼随机分成5组(感染试验4组和对照试验1组),每组30尾,感染试验组腹腔注射0.3 mL不同浓度的细菌稀释液,对照组注射0.3 mL无菌PBS,养殖条件与暂养条件保持一致。感染后,连续14 d观察记录发病和死亡情况。回归感染试验重复3次后,采用Reed-Muench法计算半数致死量(LD50)[11],并将感染试验组中出现典型腹部膨大的黄颡鱼进行细菌再分离和鉴定。
1.2.3 细菌生化鉴定
将XJH01菌株和回归感染试验中分离到的菌株分别进行BHI固体培养基培养。根据Biolog细菌鉴定试剂盒操作要求,将平板上生长出的单菌落划线培养于BUG固体培养基上,33 ℃培养24~36 h。用无菌棉签挑取BUG固体培养基上生长的单菌落,重悬于IF-A接种液中。将Biolog细菌鉴定板以每孔100 μL的剂量接种含有XJH01的接种液后,置于Biolog 全自动微生物鉴定系统中进行鉴定,记录鉴定结果。
最初,不知道该如何去承认苏珊娜与克洛特·盖博之间的情爱,小说中人物内心道德伦理的拷量,直接折磨着我,在写完他们激情爱欲之后,折磨一度达到了顶峰,几欲有删节复始的冲动。
1.2.4 细菌16S rDNA 序列分析
通过引物16S rDNA 27F:5′-AGAGTTTGATCAT GGCTCAG-3′和16S rDNA 1492R:5′-TACGGTTACCTTGTTACGACTT-3′对XJH01菌株的16S rDNA进行扩增。扩增程序为:95 ℃ 5 min;94 ℃ 1 min,56 ℃ 1 min,72 ℃ 1 min,30个循环;72 ℃ 10 min。将扩增产物置于1%的琼脂糖凝胶中进行电泳检测。回收阳性扩增产物,送至武汉天一辉远生物科技有限公司测序。利用NCBI中Blast检索系统,对XJH01菌株的16S rDNA测序结果进行同源性分析。选择常见水产病害致病菌的16S rDNA序列,采用邻接法(neighbor-joining method),构建XJH01菌株系统发育树。
1.2.5 组织病理学观察
取正常黄颡鱼和患病黄颡鱼的鳃、脾脏、肾脏和肠组织,经固定、包埋、切片及苏木精-伊红染色(HE染色)等过程后,观察患病黄颡鱼组织病理变化情况[12]。
1.2.6 药物敏感试验
在无菌环境下,取200 μL XJH01菌株的培养液,涂布于BHI固体培养基上,并将药敏试纸均匀的分布到该固体培养基上,30 ℃培养24 h后测量抑菌圈直径。
2 结果
2.1 临床症状
患病黄颡鱼临床症状表现为浮于水面、游动缓慢、腹部膨大(图1A)。解剖后发现腹腔内有大量积水、脾脏和肾脏失血等(图1B)。将从自然发病黄颡鱼肝脏中分离得到的XJH01菌株,经人工培养后,感染健康的黄颡鱼。感染后,患病黄颡鱼的症状与自然发病鱼体的症状一致(图1C和图1D),表明该菌是被检黄颡鱼病例的病原菌。
2.2 病原分离与形态观察
XJH01菌株生长在BHI琼脂平板上,菌落整齐、呈圆形、中央隆起、边缘光滑、灰白色、半透明,经革兰氏染色后呈红色,表明该菌为革兰氏阴性菌,菌体呈单个或成对排列(图2A)。菌体经2%磷钨酸负染后,在透射电镜下观察呈短杆状(图2B)。
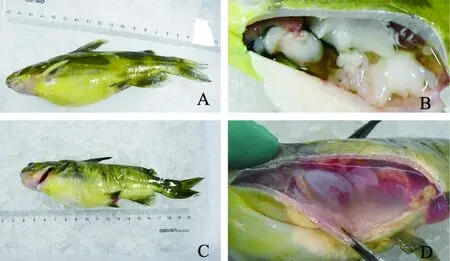
图1 黄颡鱼腹水征的临床症状A-B:自然发病黄颡鱼;C-D:人工感染患病黄颡鱼。Fig.1Clinical signs of ascites disease of Pelteobagrus fulvidracoA-B: ascites disease of Pelteobagrus fulvidraco with natural infection; C-D: ascites disease of Pelteobagrus fulvidraco with artificial inoculation.
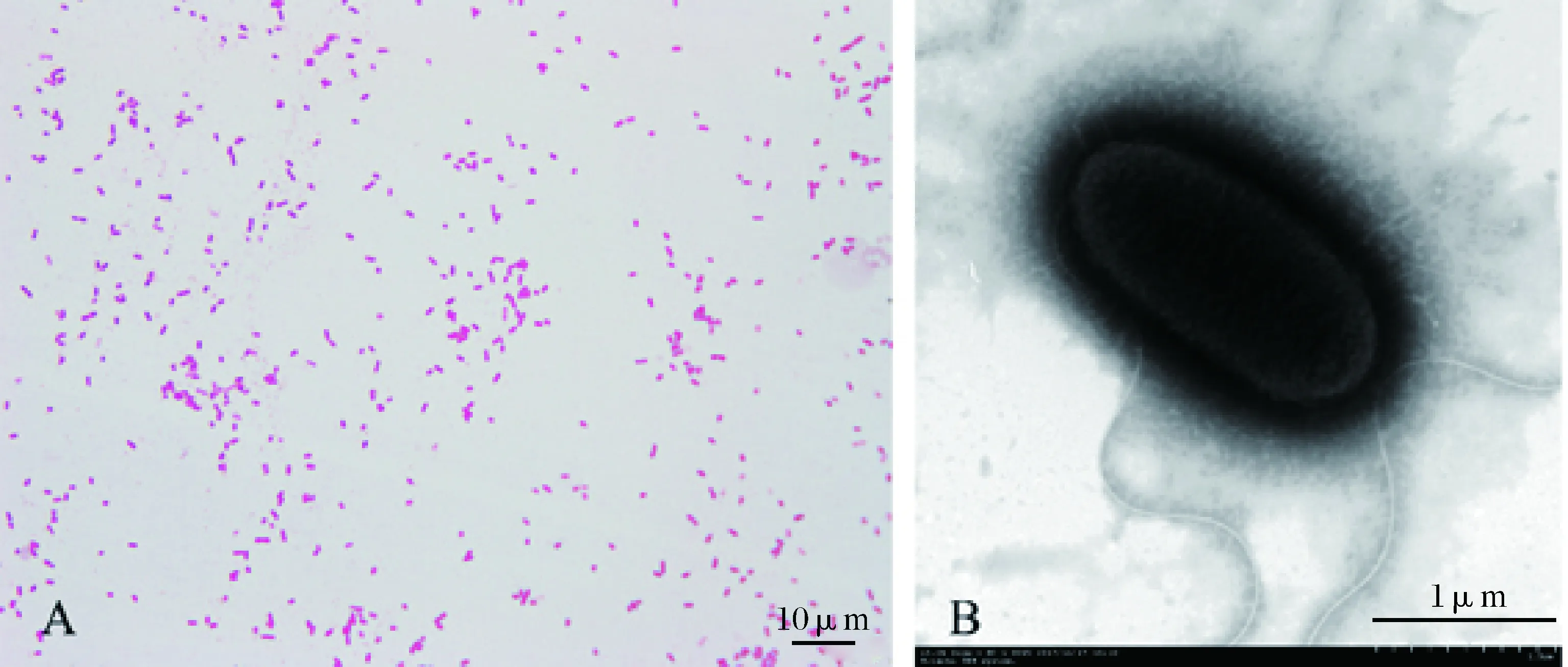
图2 XJH01菌株的革兰氏染色和负染A:革兰氏染色(100×);B:负染(5 000×)。Fig.2Gram staining and negative staining of bacterium XJH01A: Gram staining (100×); B: Negative staining (5 000×).
2.3 回归感染试验
用不同浓度的XJH01菌液注射感染健康黄颡鱼后,各感染试验组的黄颡鱼在14 d天内出现了不同程度的患病症状或死亡,对照组黄颡鱼未出现鱼体死亡(表1)。根据Reed-Muench法计算出XJH01菌的半数致死量为(2.27±0.33)×106CFU/mL。取感染试验组濒临死亡的黄颡鱼解剖后发现,腹腔内有大量积水(图1C和图1D)。从感染组濒死的黄颡鱼肝脏中分离得到一株细菌后进行再鉴定,确认分离菌的致病性。
2.4 组织病理变化
采集自然发病黄颡鱼和健康黄颡鱼的鳃、脾脏、肾脏和肠道等器官进行组织切片,通过观察比较,发现患病鱼的各组织结构均发生了显著的变化。健康黄颡鱼的鳃丝及鳃小片结构完整、排列整齐(图3A);患病鱼的鳃丝上皮细胞坏死、脱落,部分鳃小片增大,出现大量炎性细胞浸润,部分鳃小片有融合现象(图3E)。健康黄颡鱼的脾脏细胞排列紧密,红髓和白髓清晰(图3B);患病鱼脾脏细胞坏死,大量炎性细胞浸润,红髓和白髓界限不明显(图3F)。健康黄颡鱼的肾脏细胞排列紧密结构清晰(图3C);患病鱼肾脏出现广泛坏死,肾小球肿胀、坏死,肾小管细胞空泡化坏死(图3G)。健康黄颡鱼的肠道柱状上皮细胞排列紧密,肌层平整,肠绒毛完整,排列有序(图3D);患病鱼肠道黏膜上皮细胞肿胀坏死,下层有炎性细胞浸润(图3H)。
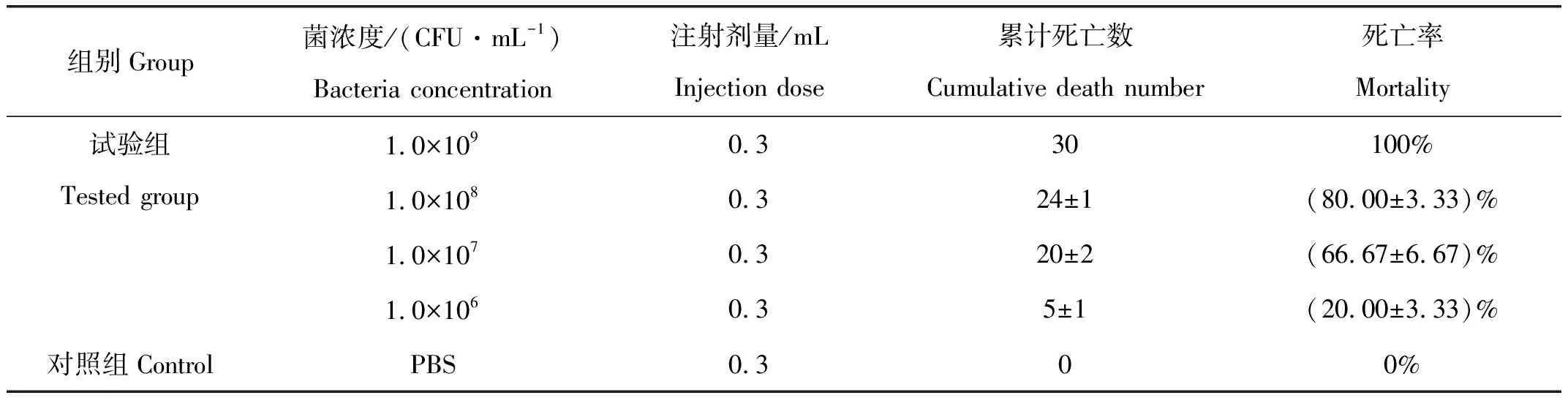
表1 不同浓度XJH01菌感染黄颡鱼死亡结果Tab.1 Mortality of Pelteobagrus fulvidraco infected with strain XJH01 at different concentrations
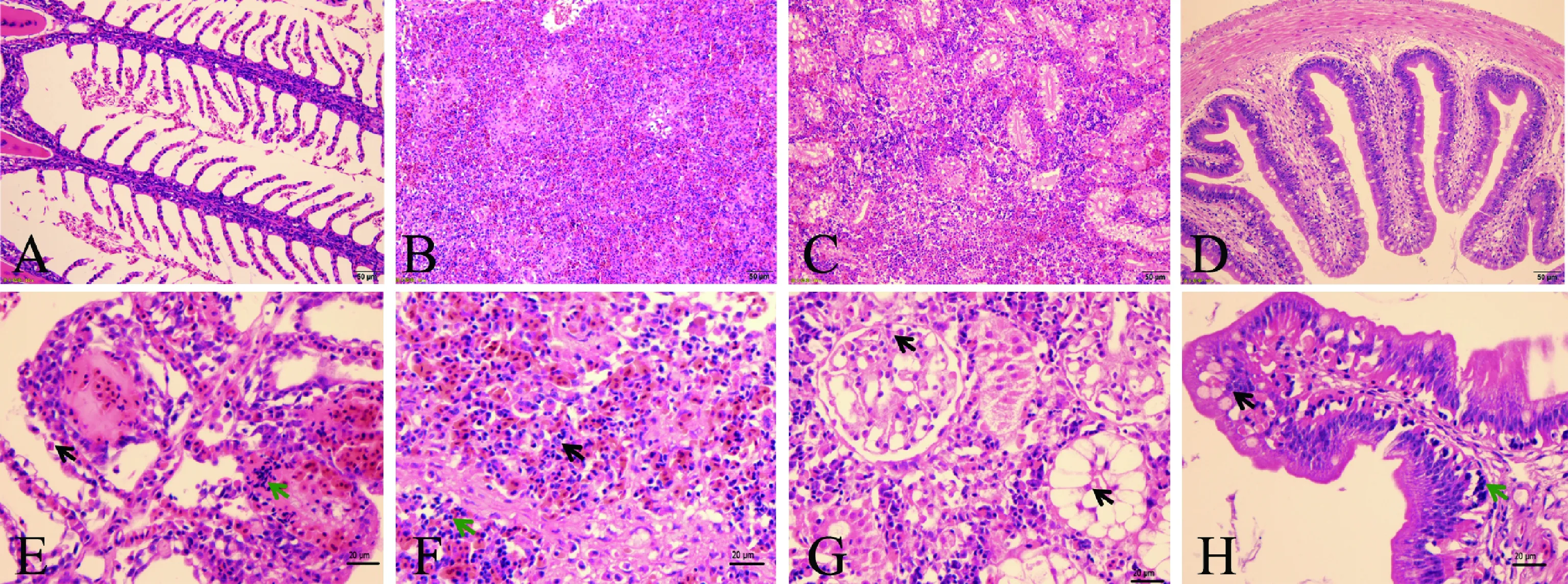
图3 黄颡鱼正常组织和腹水征病理组织观察(标尺: 50 μm)A:正常鳃组织;B:正常脾脏组织;C:正常肾脏组织;D:正常肠组织;E:患病鱼鳃组织;F:患病鱼脾脏组织;G:患病鱼肾脏组织;H:患病鱼肠组织;绿色箭头:炎性细胞;黑色箭头:坏死细胞。Fig.3Histopathological observation of tissues in Pelteobagrus fulvidraco from normal group and the ascites diseased group(bar scale: 50 μm)A: normal gill tissue; B: normal spleen tissue; C: normal kidney tissue; D: normal intestinal tissue; E: the gill tissue from diseased Pelteobagrusfulvidraco; F: the spleen tissue from diseased Pelteobagrus fulvidraco; G: the kidney tissue from diseased Pelteobagrus fulvidraco;H: the intestinal tissue from diseased Pelteobagrus fulvidraco. The green arrow: inflammatory cells;the black arrow: necrotic cells.
2.5 细菌生化鉴定
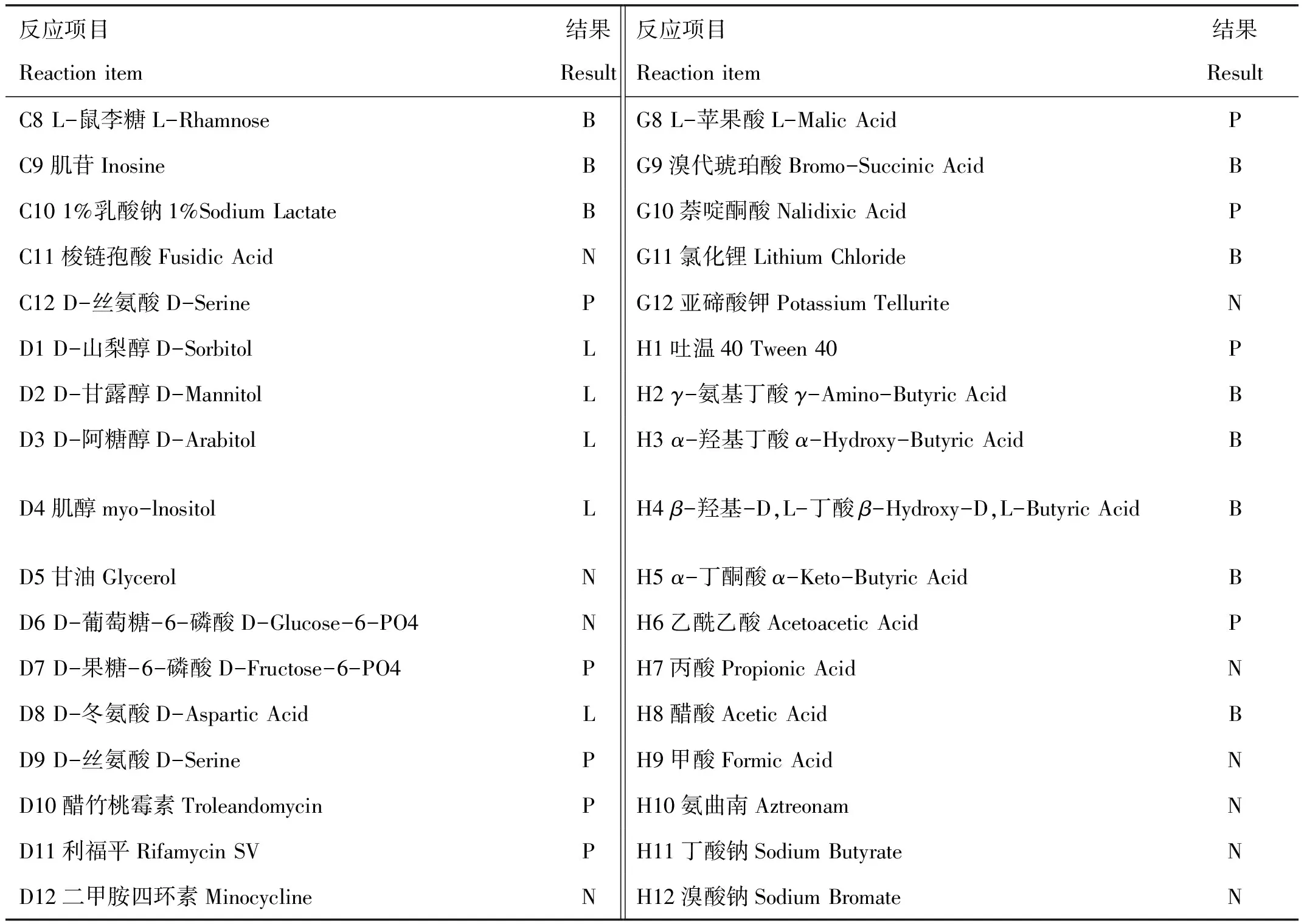
通过Biolog全自动微生物鉴定系统对XJH01菌株和回归感染试验中分离到的菌株分别进行鉴定。结果显示,两株分离菌均为维氏气单胞菌,置信度高达85%。具体的反应项目及结果见表2。
2.6 细菌16S rDNA序列分析及系统发育树构建
通过引物16S rDNA 27F/16S rDNA 1492R对XJH01菌株的16S rDNA进行扩增,扩增产物大小约为1 400 bp的序列。将扩增产物测序结果置于NCBI Blast系统中比对,结果显示,XJH01菌株16S rDNA基因序列与维氏气单胞菌的16S rDNA序列相似性达99%。利用邻接法(neighbor-joining method)构建XJH01菌株系统发育树的结果显示,XJH01菌株与维氏气单胞菌(基因号:KC210794.1、MG063198.1、MF716720.1)聚合为1支(图4)。

表2 XJH01菌株的Biolog鉴定结果Tab.2 Results of Biolog identification of strain XJH01
续表2,Tab.2 Continued
注:P表示阳性;N表示阴性;B表示临界值;L表示低于对照组A1。
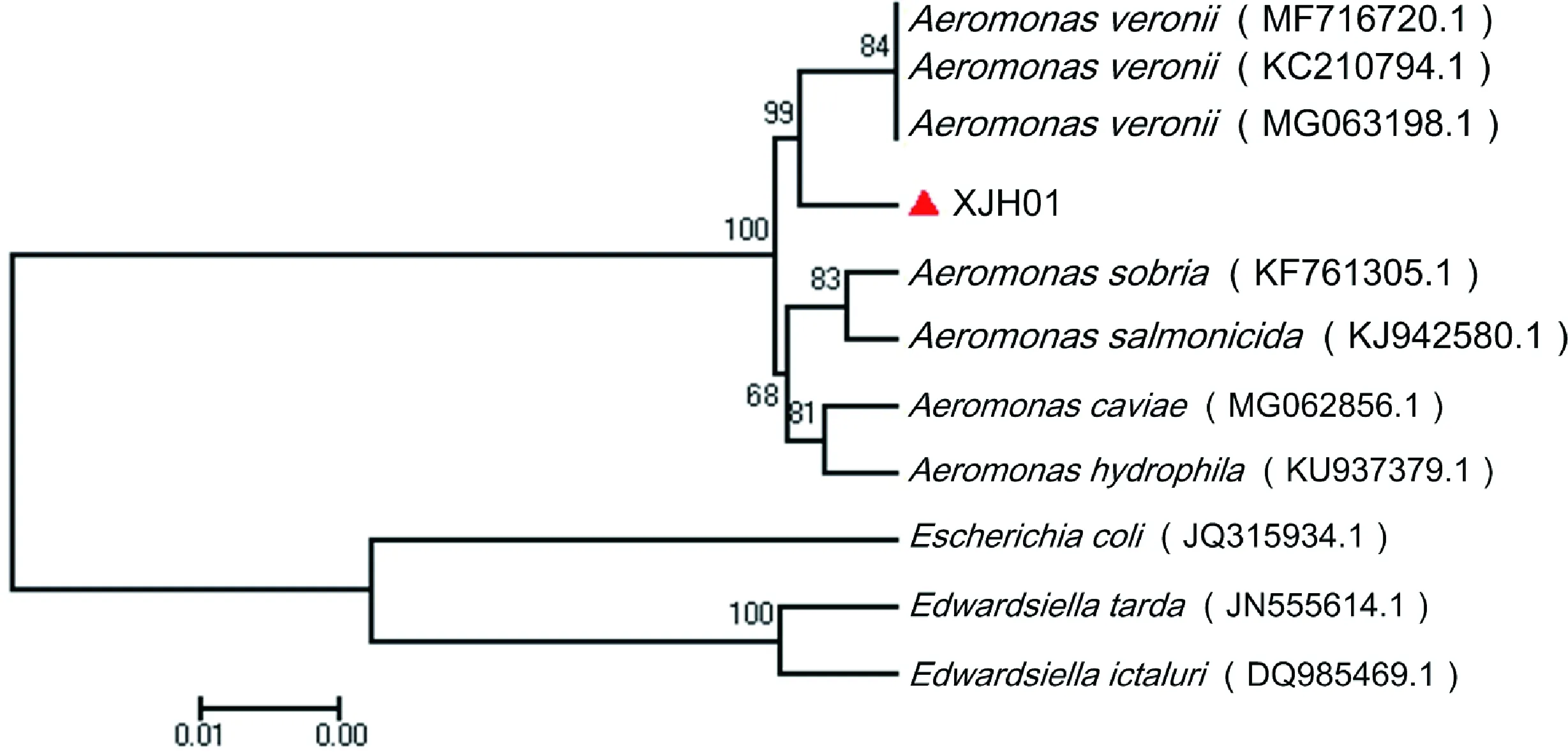
图4 基于16S rDNA构建的XJH01菌株系统发育树(数字代表自展值)Fig.4Phylogenetic tree of strain XJH01 based on 16S rRNA (The number represents bootstrap value)
2.7 药物敏感试验
按照药敏试剂盒使用说明,根据抑菌圈直径大小,确定XJH01菌株对药物的敏感性。药敏试验结果显示,该菌株对哌啦西林、克拉霉素、恩诺沙星、氟苯尼考、米诺环素、左氟沙星、多粘霉素B和复方新诺明等8种抗生素高度敏感;对麦迪霉素、氨苄西林、大观霉素、万古霉素、克林霉素、新霉素、妥布霉素和卡那霉素等8种抗生素中度敏感;对苯唑西林、阿米卡星和链霉素等3种抗生素不敏感(表3)。
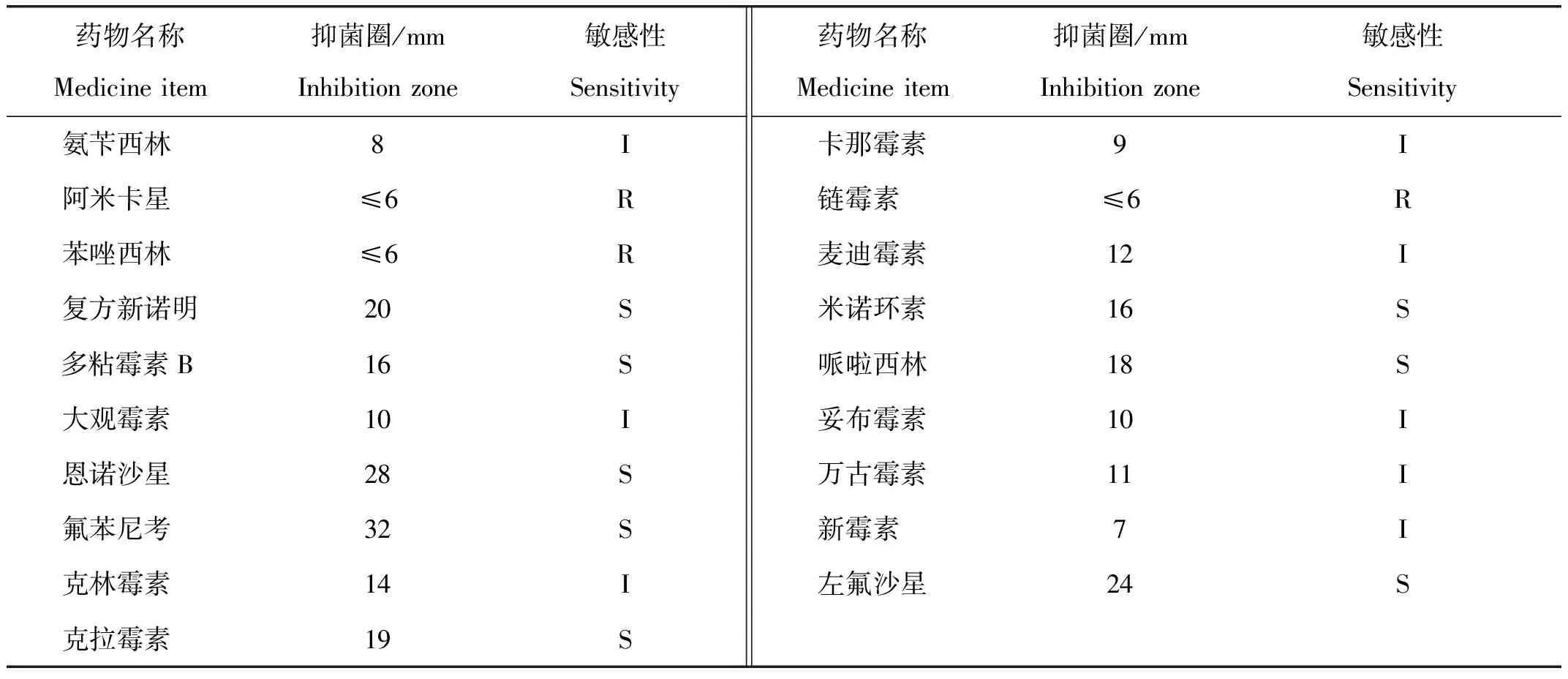
表3 药物敏感性试验Tab.3 Antibiotic susceptibility test
注: d代表抑菌圈直径,S表示敏感(d>15 mm);I表示中度敏感(6 mm 随着中国黄颡鱼养殖规模的不断扩大,关于黄颡鱼疾病研究的报道不断增多,主要为细菌性疾病。目前,已报道的黄颡鱼细菌性病原菌主要有迟钝爱德华氏菌(Edwardsiellatarda)[13]、嗜水气单胞菌(Aeromonashydrophila)[5]、类志贺邻单胞菌(Plesiomonasshigelloides)[14]、耶尔森氏菌(Yersiniaenterocolitica)[15]和维氏气单胞菌(Aeromonasveronii)[16]等。本研究从患腹水征黄颡鱼体内分离到一株病原菌XJH01,经菌体形态观察、回归感染试验、生化鉴定和16S rDNA序列分析等方法,确认了该病原菌为维氏气单胞菌。维氏气单胞菌是一种人-兽-鱼共同致病病原菌[17-18],该菌在水生动物中流行广泛,已从患病的罗非鱼(Oreochromisniloticus)[19]、斑点叉尾鮰(Ietaluruspunetaus)[20]、西伯利亚鲟(Acipenserbaeri)[21]、虹鳟(Oncorhynchusmykiss)[22]、岩原鲤(Procyprisrabaudi)[23]、异育银鲫(Carassiusauratus)[24]、框镜鲤(Cyprinuscarpio)[25]、中华鲟(Acipensersinensis)[26]和鳜(Sinipercachuatsi)[27]等水生动物体中分离得到该病原菌。已有报道表明,维氏气单胞菌[16]的感染能引起黄颡鱼出现腹部膨大、腹腔内含有大量淡红色积水、鳍条充血、肛门红肿、鱼体表面溃烂等症状[5, 7-8]。而本研究中发病黄颡鱼的主要症状为腹部膨大、腹腔中充满大量半透明积水,无鳍条充血、体表溃烂等症状,与前述研究描述的临床症状有明显差异。可能是由于维氏气单胞菌和养殖环境的共同作用,导致了患病特征的变化。 张涛等[8]发现黄颡鱼腹水病主要是由肾组织病变所致,与本研究中患病鱼肾脏出现广泛坏死,肾小球肿胀、坏死,肾小管细胞空泡化坏死的结果相一致。此外,本研究中患病黄颡鱼的鳃、脾脏和肠道等组织器官均发生不同程度病变,对各部位的组织功能均造成一定影响。由此推测,XJH01菌株感染黄颡鱼后,鱼鳃组织损坏导致鱼体缺氧、浮游于水面,而脾脏、肾脏和肠道等组织的坏死可能是导致鱼体最终死亡的主要原因。 有效抗菌药物的筛选是防治黄颡鱼腹水征的关键。本研究使用的19种抗生素中,XJH01菌株高度敏感的抗生素有8种,中度敏感的抗生素有8种,不敏感的抗生素有3种。与已报道的黄颡鱼源维氏气单胞菌药敏试验结果相比,XJH01菌株对链霉素、新霉素、妥布霉素等抗生素的敏感性由敏感变为中度敏感或不敏感,这种对抗生素敏感性的变化可能是因不同地域来源或不同血清型菌株间的差异造成的,也可能与不规范使用抗生素导致菌株产生耐药性相关[3,28-30]。因此,在实际生产中防治由该菌引起的黄颡鱼腹水征时,需结合药物敏感性试验结果,选择正确的抗生素和使用浓度。 本研究从患腹水征的黄颡鱼体内分离鉴定了一株致病的维氏气单胞菌,该菌株对黄颡鱼的半数致死剂量为(2.27±0.33)×106CFU/mL。回归感染试验表明,分离到的维氏气单胞菌具有致病性。患病黄颡鱼的鳃结构崩解,脾、肾组织及肠上皮细胞坏死。该株维氏气单胞菌对哌啦西林、克拉霉素、恩诺沙星和氟苯尼考等8种抗生素敏感。本研究结果不仅对黄颡鱼腹水征病原的诊断有重要意义,也为该病的防治提供了一定的参考依据。3 讨论
4 结论
