高效液相色谱法测定渔业用水中喹乙醇代谢物残留量
2019-03-07史艳伟孟丽华江桂英简康时彦民
史艳伟,孟丽华,江桂英,简康,时彦民
(1.济宁市渔业监测站; 2.济宁市任城区水产局:山东 济宁272000)
喹乙醇属于喹噁啉类化合物,是一种化学合成的抗菌促生长剂[1]。喹乙醇曾一度在水产养殖业中作为一种较好的生长促进剂添加于饲料中使用,可促进动物生长,提高饲料转化率和利用率[2]。喹乙醇本身不稳定,在动物体内的代谢产物有10余种,其中3-甲基喹噁啉-2羧酸(MQCA)是主要代谢物,理化性质相对稳定,是监控喹乙醇常用的目标残留物[3],也是国际食品法典委员会认定的标示残留物。3-甲基喹噁啉-2羧酸(MQCA)能抑制脱氧核糖核酸的合成,可导致染色体畸变,属致癌物[4],不仅对水生动物的健康造成威胁[5],进入人体后也会造成人体慢性中毒、产生耐药性及三致等危害[6]。因此,很多国家禁止在水产养殖中使用喹乙醇,如欧盟在EC2788/98决议中已将喹乙醇列为禁用药[7]。《中国兽药典》也明确规定,喹乙醇被禁止用于家禽及水产养殖[8]。但是,由于经济利益的驱使和科学知识的缺乏,养殖过程中违规使用喹乙醇作为饲料添加剂的现象仍然存在。有研究表明[9-10],不能被动物机体吸收的喹乙醇及其代谢物常以粪尿、饲料等形式排入生态环境,对土壤和水体造成污染,对生态环境构成潜在危害。因此,检测喹乙醇及其代谢物在水产品及养殖环境中的残留已非常必要。
目前,涉及MQCA残留检测的研究集中在水产品[11-15],动物组织[16-19]和奶类[20]等食品相关领域,对于MQCA在环境中的残留检测报道较少,仅见张冲[21]研究了喹乙醇及其代谢物在环境中的迁移转化规律及分析方法,渔业用水中MQCA的残留检测方法未见相关报道。本研究建立了适用于渔业用水中测定MQCA的高效液相色谱法,为喹乙醇代谢物残留检测提供了灵敏度高、重现性好的定量分析方法,为保护渔业环境、保障水产品质量安全提供了有力的技术支撑。
1 实验方法
1.1 仪器及试剂
主要包括:Agilent 1200型液相色谱仪(美国Agilent公司);分析天平(德国赛得利斯,感量0.000 1 g);旋涡混合器(上海医大仪器有限公司);玻璃离心管(天玻仪器厂,10 mL);氮吹仪(美国Agilent公司);固相萃取装置(美国Agilent公司);PAX固相萃取柱60 mg,3 mL(Agela);甲醇、乙酸乙酯、甲酸(色谱纯,科密欧化学试剂有限公司);盐酸(优级纯,国药集团化学试剂有限公司);乙酸钠(国药集团化学试剂有限公司);1.0%甲酸水溶液;0.05 mol/L乙酸钠甲醇溶液;2%甲酸乙酸乙酯溶液;3-甲基喹噁啉-2-羧酸(MQCA)标准品(德国Dr. Ehrenstorfer,纯度大于98.0%)。
实验用水符合GB/T 6682—2008中一级水的规定。所用试剂除另有指定外,均为分析纯。
1.2 样品预处理
依次用3 mL甲醇、3 mL水活化PAX固相萃取柱,然后准确量取60 mL经0.45 μm滤膜过滤后的渔业用水(采自山东省济宁市水产良种繁育场),转移至PAX固相萃取柱中,控制过柱流速小于1 mL/min,用6 mL乙酸钠-甲醇溶液淋洗固相萃取柱,抽干,最后用10 mL含2%甲酸的乙酸乙酯溶液洗脱。洗脱液在40 ℃条件下用氮气吹干,吹干后的残留物用1.00 mL流动相溶液溶解,超声1 min,涡旋混合1 min,过0.22 μm滤膜,待测。
1.3 标准系列测定
1.3.1 标准储备液配置
100 μg/mL标准储备溶液:准确称取MQCA标准品0.010 0 g,用甲醇溶解并定容于100 mL棕色容量瓶中,-18 ℃冰箱中避光保存,有效期为3个月。
1.3.2 标准使用液配置
10 μg/mL标准使用溶液:准确移取100 μg/mL的标准储备液10.0 mL,定容至100 mL,0~4 ℃避光保存,有效期为1周。
1.3.3 标准曲线绘制
准确量取MQCA标准使用液,用流动相溶液(甲醇-1.0%甲酸水溶液,体积比为4∶6)分别稀释成质量浓度为0.01、0.05、0.25、0.50和1.00 μg/mL的标准工作液。各取50 μL进样,以MQCA标准溶液浓度作为横坐标,对应峰面积作为纵坐标,绘制标准曲线。
1.4 色谱条件
色谱柱为Agilent Zorbax XDB-C18柱,250.0 mm×4.6 mm(i.d.),5.0 μm(或性能相当者)。流动相为甲醇-1.0%甲酸水溶液(4∶6,V/V),等度洗脱。流速为1.0 mL/min,检测波长320 nm,柱温30 ℃,进样量50 μL。
1.5 结果计算
试样中MQCA残留量按公式(1)计算,计算结果需扣除空白值,结果保留3位有效数字。
(1)
式(1)中:X为样品中MQCA残留量(mg/L);C为样品溶液中MQCA的测量浓度(μg/mL);V为样品溶液最终定容体积(mL);V0为样品溶液量取体积(mL)。
2 结果与讨论
2.1 固相萃取柱的选择
本实验选择PAX-SPE(60 mg/3 mL)柱作为固相萃取柱。本研究比较了HLB(60 mg/3 mL),PAX-SPE(60 mg/3 mL)以及C18(100 mg/1 mL)3种不同的固相萃取柱对净化效果的影响(n=6),结果表明,MQCA在3种固相萃取柱中回收率的大小为:PAX-SPE>HLB>C18(图1)。因此,本实验选择利用回收率最高的PAX-SPE(60 mg/3 mL)柱。固相萃取是一种利用选择性吸附与选择性洗脱的液相色谱分离原理的前处理方法,主要依靠固相萃取柱来进行,根据不同目标化合物的性质选择不同的固相萃取柱,其填料的类型决定了吸附能力的大小以及回收率的高低。PAX-SPE是以阳离子交换混合机理水可浸润型聚合物为基质的萃取小柱,更有利于MQCA的吸附,因此试验过程损失少,回收率高。
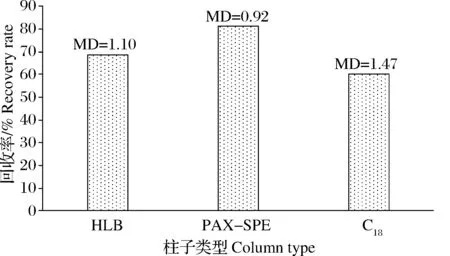
图1 不同类型固相萃取柱对MQCA回收率的影响(n=6)MD(%)表示开均差。下同。Fig.1Eeffect of SPE column type on MQCArecovery rate(n=6)MD(%)shows mean deviation.The same below.
2.2 上样体积对回收率的影响
以过滤后的渔业养殖用水为基底,加入MQCA标准溶液,分别考察10、20、30、40、50、60、70和80 mL上样体积(n=6)对回收率的影响。如图2所示,回收率随上样体积增加而增大,至60 mL时达最大值,之后有下降趋势,这可能是由于上样量少时,损失的目标物相对于上样量较大,而上样体积过大时,固相萃取柱不能及时吸附目标物,导致目标物损失,影响回收率。因此最终上样体积选择60 mL。
2.3 洗脱液用量对回收率的影响
用含2%甲酸的乙酸乙酯溶液作为洗脱液,分别考察3、6、9、12及15 mL洗脱液用量(n=6)对回收率的影响,结果如图3所示。随着洗脱液用量的增大,样品加标回收率逐渐升高,至9 mL时达峰值,后随着洗脱液用量的继续增大,样品加标回收率逐渐趋于平稳并略有下降,可能原因是随着洗脱液用量的增大,被洗脱下来的目标物逐渐增多,因此回收率逐渐增大。当洗脱液用量达到9 mL后,增大洗脱液用量对增加目标物的洗脱量不明显。另由于洗脱液用量增大,在氮吹步骤会增大目标物的损失,导致回收率会略有下降趋势。因此试验选择洗脱液用量为10 mL。
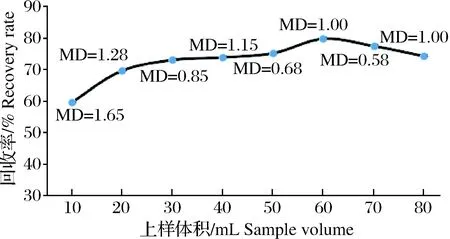
图2 上样体积对MQCA回收率的影响(n=6)Fig.2Effect of sample volume on MQCA recovery rate(n=6)
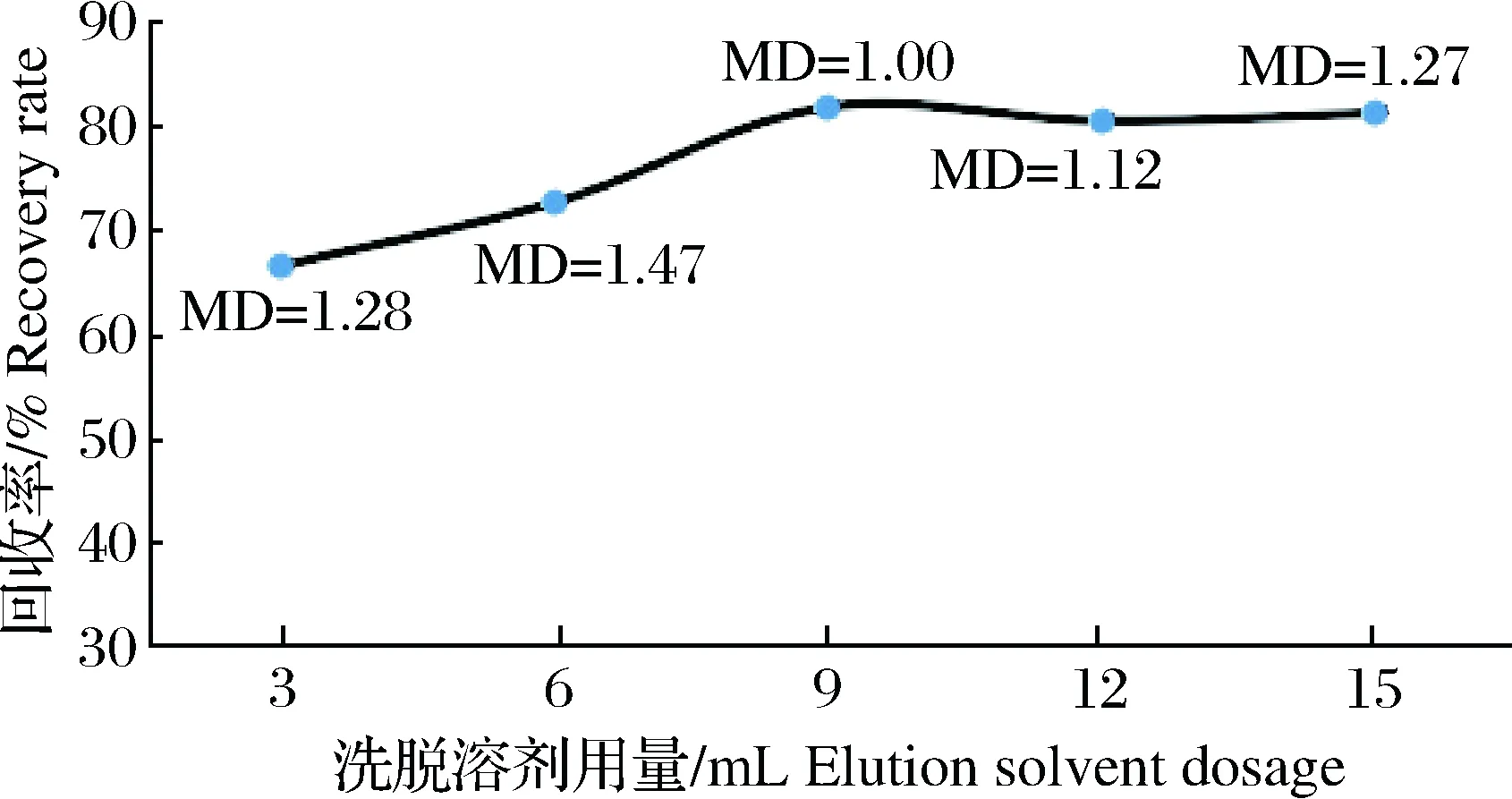
图3 洗脱溶剂用量对MQCA回收率的影响(n=6)Fig.3Effect of elution solvent dosage on MQCA recovery rate(n=6)
2.4 流动相对分离效果的影响
经查阅文献[6,22-23],发现HPLC测定MQCA含量时常用的流动相为1%甲酸水溶液-甲醇(6∶4,V/V),通常以甲醇、水和乙酸-乙酸钠缓冲液组成梯度洗脱或以0.1%甲酸水-乙腈进行梯度洗脱。经试验比较,流动相在紫外波长为320 nm的条件下,以上所提及流动相都能分离目标物。但本研究以1%甲酸水溶液-甲醇(60∶40,V/V)作为流动相时峰形和灵敏度最好,所以采用1%甲酸水溶液-甲醇(60∶40,V/V)作为流动相。
2.5色谱柱对分离效果的影响
不同的色谱柱对分离效果的影响见图4,使用ZORBAX SB-CN(250.0 mm×4.6 mm,5.0 μm)、XDB-C18柱(250.0 mm×4.6 mm,5.0 μm)、ZORBAX SB-C18柱(250.0 mm×4.6 mm,5.0 μm)分别进行色谱分离试验,ZORBAX SB-C18柱和ZORBAX SB-CN柱均出峰较早,但不能将目标物和杂质峰完全分离,并且响应值较低。XDB-C18柱出峰较晚,但能够将目标峰与杂质峰完全分离,且峰型很好,因此选择XDB-C18柱作为液相色谱分离柱。
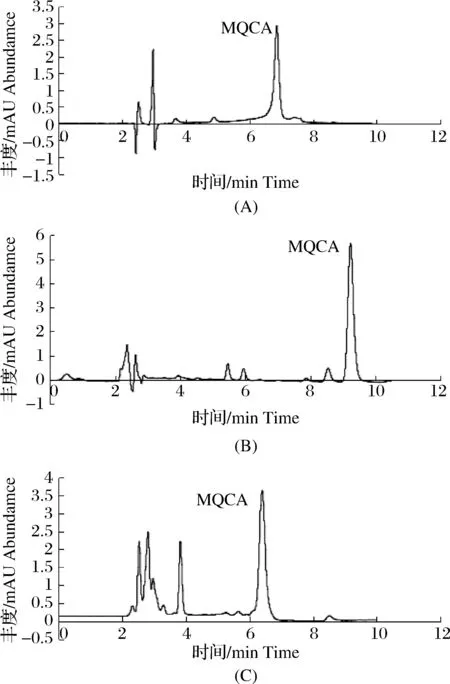
图4 不同色谱柱对分离效果的影响(A)ZORBAX SB-CN柱;(B)XDB-C18柱;(C)ZORBAX SB-C18柱。Fig.4Effect of different chromatographic column on separation effect(A)ZORBAX SB-CN column;(B)XDB-C18 column;(C)ZORBAX SB-C18 column.
2.6 标准曲线及检出限
配制标准溶液,其中MQCA质量浓度分别为0.01、0.05、0.25、0.50和1.00 μg/mL,按照本试验的仪器条件上机测试,以MQCA的质量浓度为横坐标,峰面积为纵坐标绘制标准曲线,得到MQCA标准曲线方程为y=64.526x-0.010,相关系数r=0.999 91。式中,x代表MQCA质量浓度,y代表MQCA峰面积。分别在空白样品中添加MQCA标准溶液,按信噪比大于3计算,确定该方法的检出限为0.01 mg/L;按信噪比大于10计算,定量限为 0.02 mg/L(表1)。

表1 MQCA药物线性范围和检出限Tab. 1 The linear range and detection limit of MQCA
2.7 精密度与准确度
标准品、添加样品及空白样品色谱图见图5,实验条件下,基线稳定,样品能与杂质有效分离,响应值高,可满足实验要求。向空白样品中添加标准溶液,制成2倍、5倍和10倍检出限的3组不同含量的标准添加样品,每个含量样品平行测定6次,计算方法回收率和精密度。结果表明,MQCA添加量为0.02~0.10 mg/L时,平均回收率79.0%~99.3%,相对标准偏差均小于10%(表2)。
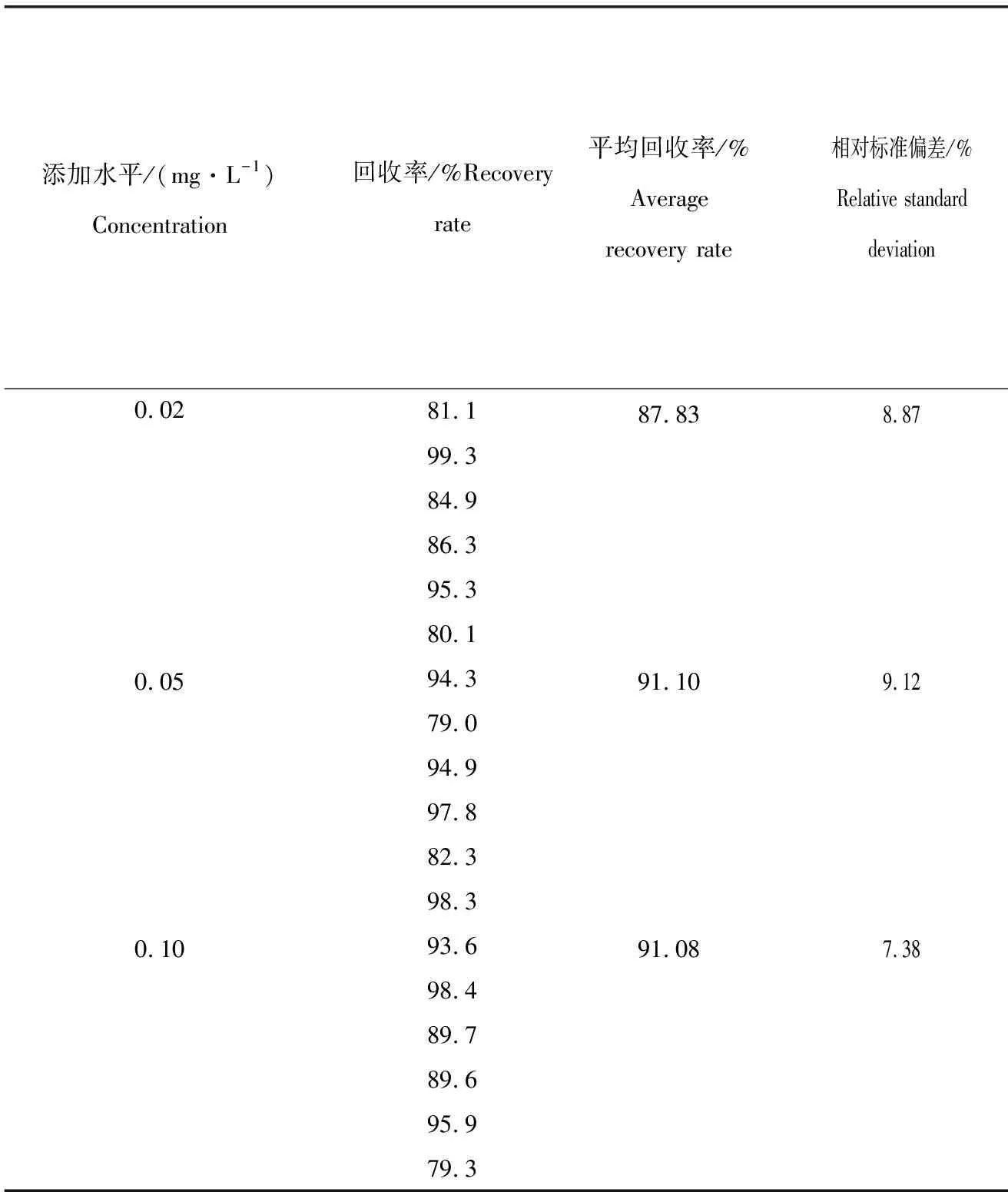
表2 渔业用水中MQCA药物加标回收率及精密度Tab.2 Recoveries and precision of MQCA infishery water n=6
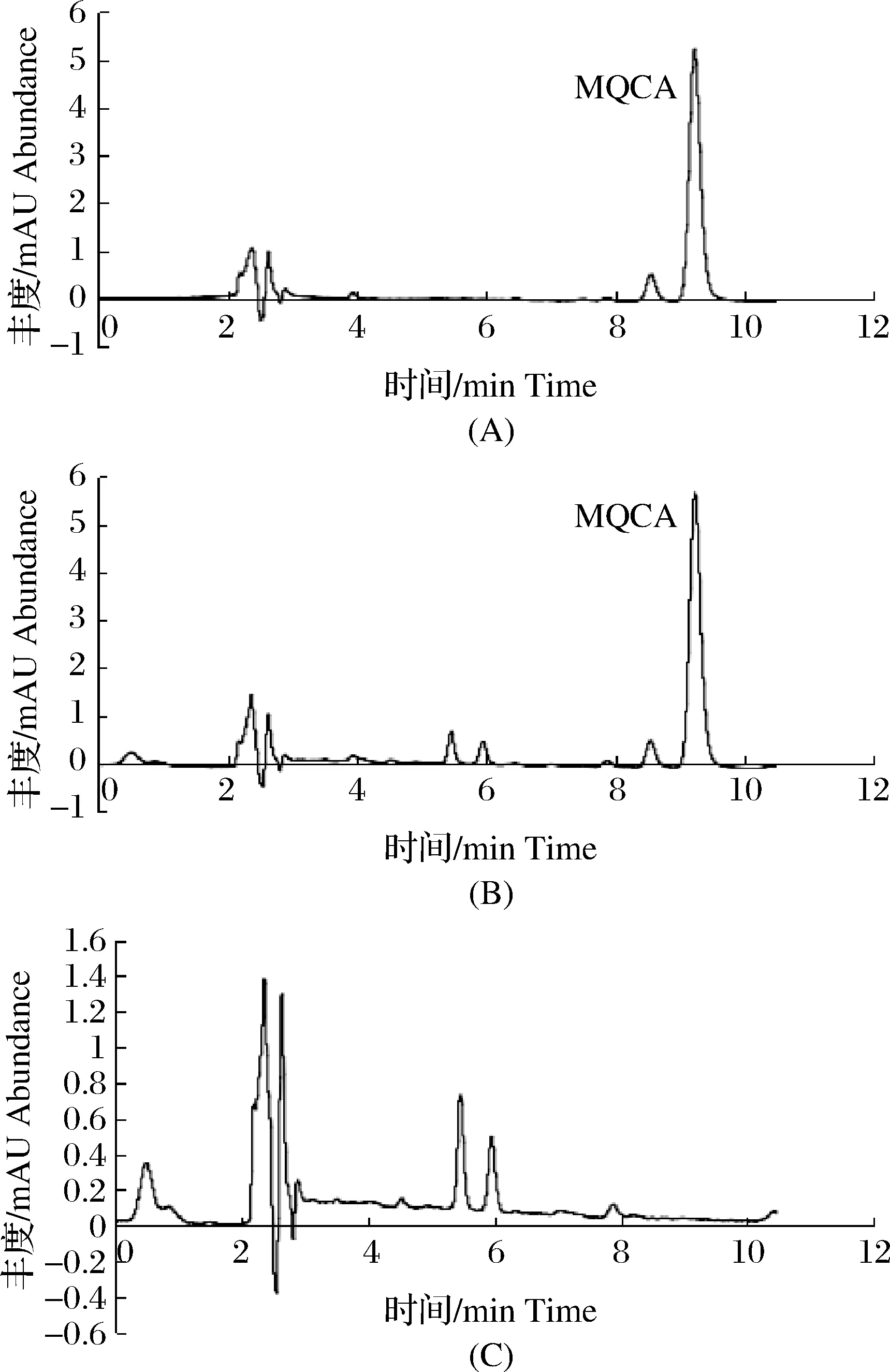
图5 MQCA液相色谱图A: MQCA标准溶液液相色谱图(0.5 mg·L-1MQCA);B:水样加标液相色谱图(0.02 mg·L-1MQCA);C:水样空白液相色谱图。Fig.5 Liquid chromatography of MQCAA:Liquid chromatography of MQCA standard solution (0.5 mg·L-1 MQCA);B:Liquid chromatography of water sample with MQCA(0.02 mg·L-1 MQCA);C: Liquid chromatography of control sample.
2.8 实际样品检测
分析了8份采自济宁市采煤塌陷区重点养殖区不同水域的渔业用水(表3)。结果表明,8个站位中,MQCA组分的浓度均低于检出限。
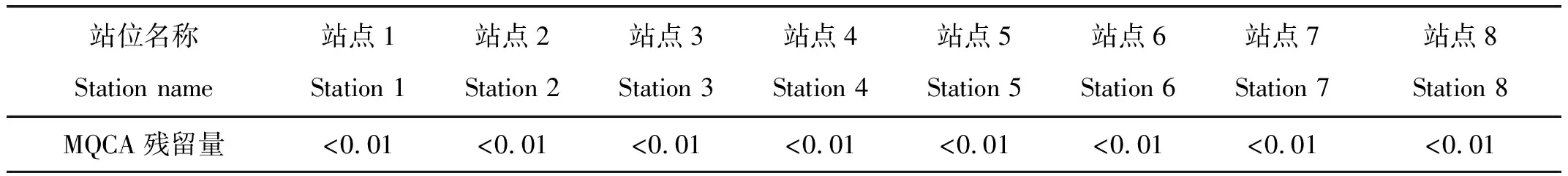
表3 8个采样站点渔业用水中MQCA的检测结果Tab.3 Detection result of MQCA in fishery water from 8 stations mg·L-1
注:站点1为西故塌陷区1;站点2为西故塌陷区2;站点3为陵城镇塌陷区1;站点4为陵城镇塌陷区2;站点5为太白湖区塌陷区1;站点6为太白湖区塌陷区2;站点7为兴隆庄塌陷区1;站点8为兴隆庄塌陷区2。
3 结论
本研究建立了一种简单、快速检测渔业用水中喹乙醇代谢物残留量的分析方法。该方法MQCA的检出限为0.01 mg/L,定量限为0.02 mg/L,平均加标回收率为79.0%~99.3%,相对标准偏差(RSD)在7.38%~9.12%之间。经对实际渔业用水样品检测,证明该方法具有灵敏、准确、简便、快速等优点,净化效果好,精确度高,且重复性好,为渔业用水中喹乙醇代谢物残留的检测提供参考。
