大黄蛰虫丸对脂多糖与肝星状细胞TLR4交联的影响*
2019-03-06刘旭东徐新杰赵壮志吕萍
刘旭东, 徐新杰, 赵壮志, 吕萍
广西中医药大学附属瑞康医院肝病科(广西南宁 530011)
内毒素主要来自肠道的革兰阴性杆菌,成分是其细胞壁上的脂多糖(lipopolysaccharide,LPS),内毒素血症与肝纤维化关系密切[1]。现有研究表明,LPS通过活化肝星状细胞Toll样受体4(Toll-like receptor 4,TLR4)通路,下调了转化生长因子-β(TGF-β)假受体骨成形蛋白-激活素膜结合阻断因子(BMP and the activin membrane-bound inhibitor,BAMBI,放大了TGF-β信号,促进了肝纤维化[2]。大黄蛰虫丸是祖国医学活血祛瘀的代表方药,中医认为肝纤维化主要病机是瘀血阻络,大黄蛰虫丸切合肝纤维化的病机,并且在中国中西医结合学会肝纤维化诊治指南中被推荐使用。2015年1月至2018年5月,为明确大黄蛰虫丸抗肝纤维化机制,是否能阻断LPS与TLR4的结合,我们设计了该实验。
1 材料与方法
1.1 实验动物 健康清洁级雄性,Wistar大鼠,250~300 g,动物合格证号SCXK(军)-2012-0010,购于第三军医大学实验动物中心。大鼠肝星状细胞系HSC-T6,购于上海中国科学院细胞库。
1.2 主要试剂和耗材 DMEM 培养基、M199培养基、胎牛血清、牛血清白蛋白(美国Gibco公司);胰蛋白酶;青霉素-链霉素溶液、DAPI、抗荧光淬灭剂(碧云天公司);PBS(北京中杉);DMSO、一抗LPS(美国Amresco公司);台盼蓝粉末(美国Sigma公司);多聚甲醛、TritonX-100(上海生工);山羊血清(美国Hyclone公司);激光扫描共聚焦显微镜(德国Leica公司)、LPS/PE(博奥森公司 批号:bs-2351R-PE)。
1.3 方法
1.3.1 大鼠原代肝星状细胞的分离培养鉴定
1.3.1.1 分离方法 将大鼠以10%水合氯醛麻醉,常规消毒后打开腹腔,经门静脉插管并肝素化(1 000 U/只)后,连接滴液瓶,剪断下腔静脉放血,快速灌注500 mL D-Hanks液至肝脏变白,流出液清亮。分离肝脏至大培养皿中,继续灌注0.05%链酶蛋白酶液100 mL和0.025%胶原酶液100 mL,每分钟约60滴。收集灌注液于烧杯内,剪碎肝脏剔除肝包膜及大血管后,连同收集的酶液置于磁力搅拌器上,加入DNaseI(终浓度40 μg/mL),调整至200 r/min,继续消化45 min,200目钢丝滤网过滤。
1.3.1.2 洗涤收集 室温条件下滤液离心低速离心(50g,3 min)1~2次,去除未消化完全的肝细胞,然后以1 200 r/min离心7 min,吸弃上清液,加入Hanks液,小心吹打使细胞充分离散悬浮,再按上述条件离心洗涤1~2次,直至上清液较澄清,弃上清液,得到沉淀的肝NPC,加20 mL的DMEM培养液充分吹散悬浮细胞。
1.3.1.3 分离纯化 将1份生理盐水加入9份的Percoll细胞分离原液,然后再稀释成30%和70% 2种浓度各10 mL。取7支5 mL的玻璃离心管,依次小心加入约1.5 mL 70%Percoll液(1.097 g/mL)、30%(1.045 g/mL)、和肝NPC悬液,低温离心(500g,4°)30 min。分别仔细吸取肝NPC悬液和30%Percoll液、30%Percoll液和70%Percoll液界面之间的细胞,上层为HSC细胞,下面的为枯否细胞。加Hanks液按上述条件再洗涤2遍,以含20%新生小牛血清的DMEM或M199培养液悬浮细胞。
1.3.1.4 活性的鉴定 活性检测采用台盼蓝染色法。细胞在325 nm波长紫外光的激发下自发绿色荧光。
1.3.2 原代HSC与HSC-T6细胞系培养传代
1.3.2.1 原代HSC培养传代 分离获得HSC细胞以1×104cells/cm2密度接种于含15%胎牛血清的DMEM培养液中贴壁培养。每隔2 d换去1/3的培养液,培养至7 d后,HSC细胞已基本融合,并开始明显分裂增殖成团簇状。细胞铺满底层时即可传代,用0.25%胰蛋白酶37℃消化3~5 min,小牛血清终止继续消化,收集细胞悬液,上述条件离心洗涤1~2次,以1×105cells/cm2的细胞密度接种于6孔培养板。贴壁培养12 h后,吸弃上清液,分别加入含20%药物血清或不含药物大鼠血清的M199培养液继续培养。
1.3.2.2 大鼠肝星状细胞系HSC-T6细胞培养 将细胞培养于含10%优质胎牛血清和1%青霉素-链霉素双抗的DMEM培养基中,2~3 d换液1次,细胞80% 融合度时传代,可按照1∶3传代比例进行,于37℃,5%CO2及饱和湿度培养箱中培养。
1.3.3 含药血清制备 根据《金匮要略》记载,大黄蛰虫丸的药物由熟大黄、土鳖虫(炒)、水蛭(制)、虻虫(去翅足,炒)、蛴螬(炒)、干漆(煅)、桃仁、苦杏仁(炒)、黄芩、地黄、白芍、甘草组成,其剂量比例为3∶0.3∶0.6∶0.45∶0.45∶0.3∶1.2∶1.2∶0.6∶0.3∶1.2∶0.9。将上述12味中药药物粉碎成粗粉,按照临床用药习惯,取500 mL水浸泡1 h后煎煮,先武火煮沸15 min,后改成文火煎煮,保持微沸状态30 min,共煎煮3次。合并后采用超声提取法,减压浓缩,冷冻干燥得到总提取物粉末。在使用时加生理盐水将上述材料调至412 g/L,成为大黄蛰虫丸提取液。正常Wistar大鼠10只,其中正常对照组与含药血清组各5只,正常对照组给予灌胃生理盐水0.8 mL;含药血清组给予大黄蛰虫丸提取液0.8 mL,每组持续灌胃7天,2次/d。各组大鼠于末次给药后1 h腹腔注射7%水合氯醛(0.5 mL/100 g)麻醉,腹主动脉采血。血样静置2 h以上,待血块收缩良好后,3 000 r/min,15 min分离血清,血清以55℃处理30 min,用0.22 μm微孔滤膜过滤除菌,置-20℃保存备用。
1.3.4 细胞造模分组 将原代HSC和HSC-T6细胞系各分为空白对照组、含药血清组、LPS处理组、含药血清和LPS共同处理组,每组3样本。其中空白对照组:细胞继续常规培养48 h;含药血清组:用含20%大黄蛰虫丸含药血清的培养液作用于细胞48 h;LPS处理组:细胞先常规培养44 h后再加入100 ng/mL LPS作用于细胞4 h;含药血清和LPS共同处理组:先加入含20%大黄蛰虫丸含药血清培养液作用于细胞44 h后再加入100 ng/mL LPS共同作用于细胞4 h。
1.3.5 免疫荧光染色 在培养板中将已爬好细胞的玻片用 PBS(0.01 mol/L)浸洗3次,3 min/次;用4%的多聚甲醛固定爬片15 min,浸洗玻片同前;在玻片上滴加0.5% TritonX-100室温打孔15 min,浸洗玻片同前;在玻片上滴加正常山羊血清,室温封闭60 min;吸水纸吸掉封闭液,不洗,每张玻片滴加足够量的稀释好的一抗LPS并放入湿盒,4℃孵育过夜;取出湿盒,37℃复温30 min,PBS(0.01 mol/L)浸洗3次,3 min/次,吸水纸吸干爬片上多余液体后滴加LPS-PE,湿盒中37℃孵育30 min;从加LPS-PE起,后面所有步骤都尽量在暗处进行。复染核:滴加DAPI避光孵育15 min,对标本进行染核,PBS 5 min×4次洗去多余的DAPI;用吸水纸吸干爬片上的液体,用含抗荧光淬灭剂的封片液封片,然后在激光扫描共聚焦显微镜下观察采集图像。免疫荧光图片采用ImageJ2x(Rawak Software Inc.,Stuttgart,Germany)计算ROI值。
1.3.6 激光共聚焦检测LPS与TLR4交联在肝星状细胞中荧光强度变化 每张玻片滴加正常山羊血清,温室封闭60 min,然后滴加足够量的一抗LPS,4℃孵育过夜,然后滴加LPS-PE,湿盒37℃孵育30 min,用含抗荧光淬灭剂的封片液封片,然后在激光扫描共聚焦显微镜下观察采集图像。

2 结果
2.1 自发荧光观察肝星状细胞的纯度 分离7 d的HSC呈星状细胞,细胞变长,胞体较大,胞浆内折光颗粒减少,部分细胞融合成片状。在激发波长325 nm 荧光显微镜下呈蓝绿色荧光,纯度>85%。见图1。

图1 原代肝星状细胞(×100)
2.2 LPS与TLR4交联在星状细胞中荧光强度变化 原代HSC中空白对照组、含药血清组、LPS处理组、含药血清和LPS共同处理组的ROI值分别是:9.48±0.05、4.07±0.68、18.44±2.61、14.20±2.21;HSC-T6空白对照组、含药血清组、LPS处理组、含药血清和LPS共同处理组的ROI值分别是:6.75±1.99、4.63±2.97、18.40±1.01、9.35±2.14。与空白对照组比较,LPS处理组的荧光强度增强(P<0.001);与LPS处理组比较,大黄蛰虫丸和LPS共同处理组的荧光强度减弱(P<0.05)。说明大黄蛰虫丸减少LPS与HSC TLR4结合。见图2、3,表1。
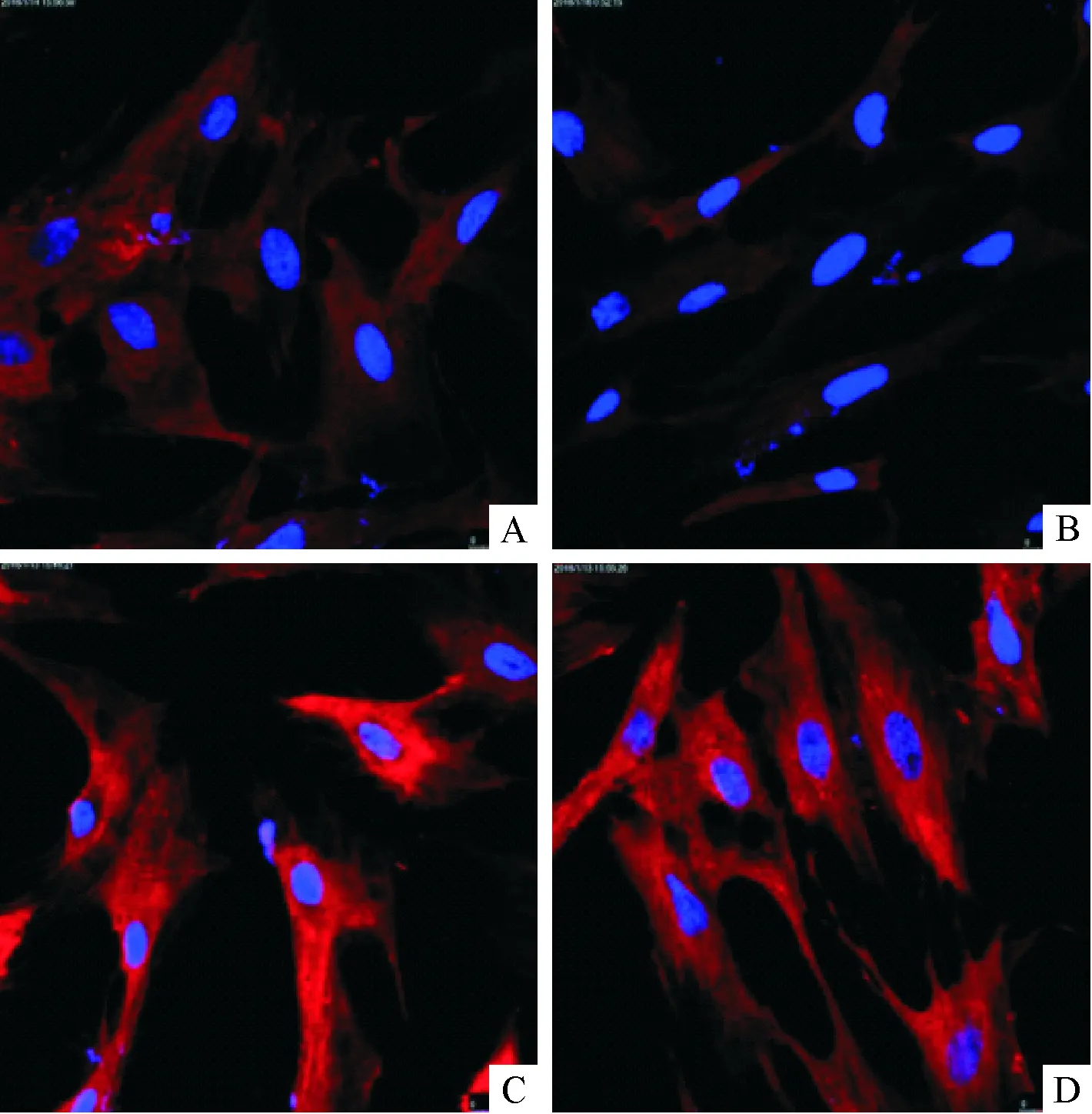
A:空白对照组;B:含药血清组;C:LPS处理组;D:含药血清组和LPS共同处理组
图2 LPS与TLR4交联后在HSC中荧光强度变化(×800)
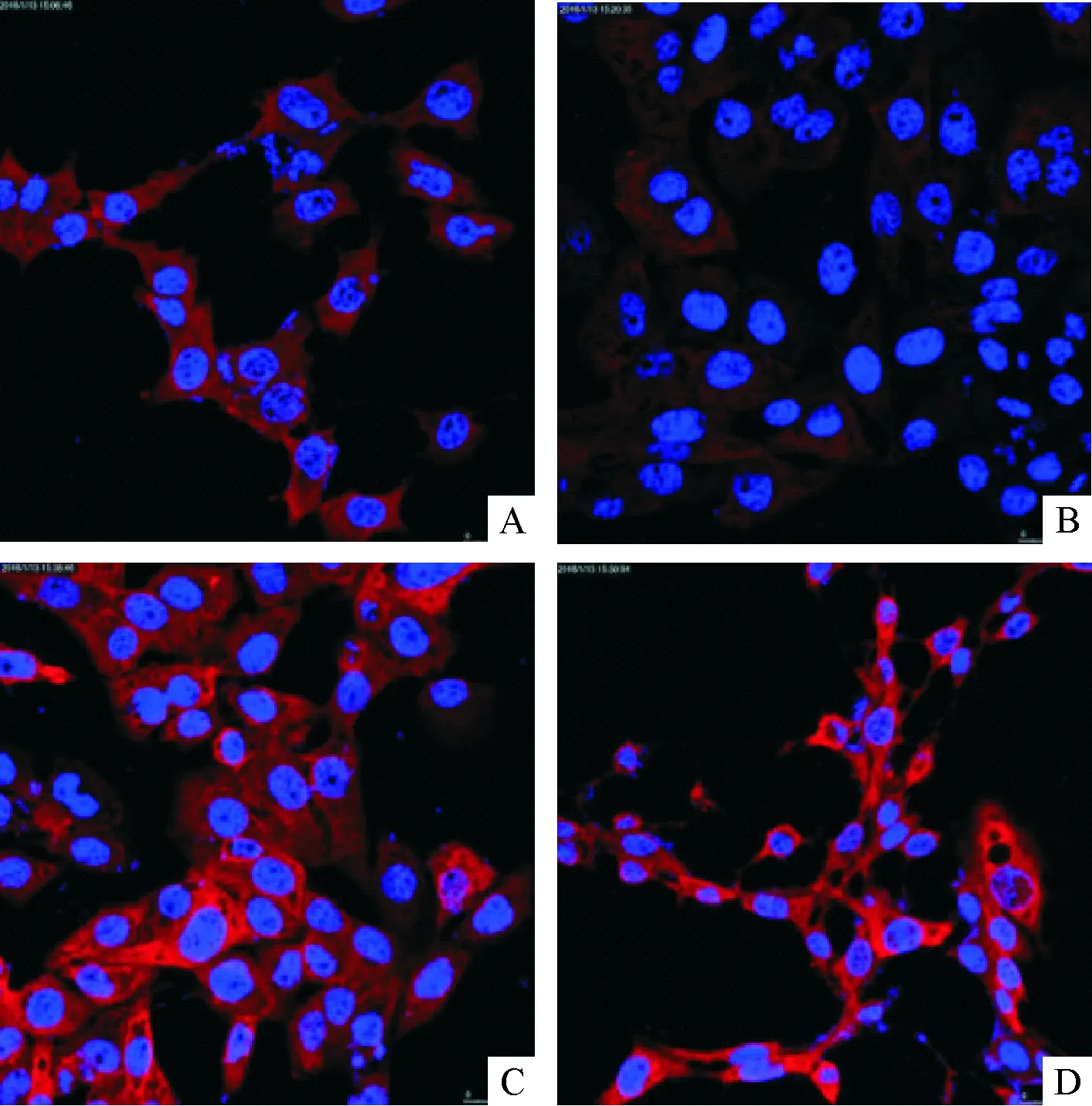
A:空白对照组;B:含药血清组;C:LPS处理组;D:含药血清组和LPS共同处理组
图3 LPS与TLR4交联后在HSC-T6细胞中荧光强度变化(×800)
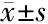

项目HSC ROI值HSC-T6 ROI值空白对照组9.48±0.056.75±1.99含药血清组4.07±0.684.63±2.97LPS处理组18.44±2.61∗18.40±1.01∗含药血清和LPS共同处理组14.20±2.21△9.35±2.14△△F值76.35247.835P值0.0000.000
*与空白对照组比较P<0.001;与LPS处理组比较△P<0.05,△△P<0.001
3 讨论
肠源性内毒血症对肝纤维化启动有重要作用,LPS 是革兰阴性杆菌细胞壁的主要成分。而肝星状细胞的活化是肝纤维化发生、发展的中心环节。肝星状细胞活化,使其转化为肌成纤维细胞,通过旁分泌与自分泌作用,使HSC增殖,合成大量胶原和蛋白多糖等细胞外基质,沉积于肝脏,肝纤维化逐渐形成。
在慢性肝病中,由于肠黏膜结构发生改变,比如紧密连接受损、细胞间隙变宽、血管阻塞促使屏障功能丧失,导致肠道细菌释放的内毒素进入肝脏,通过肠肝循环,使肝脏不断暴露于肠道来源的内毒素,肝脏对内毒素的清除不足,形成肠源性内毒素血症[3]。Toll样受体(TLR)作为天然免疫系统重要部分,是识别微生物(细菌、病毒等)的模式受体[4]。TLR4主要是LPS的配体,主要表达于肝细胞、枯否细胞、星状细胞[4]。正常枯否细胞不表达TLR4,受到LPS刺激的枯否细胞表达TLR4增多。LPS与TLR4交联,激活枯否细胞使其合成并释放转化生长因子、血小板衍生生长因子、肿瘤坏死因子、干扰素等多种细胞因子,诱导HSC转化为肌成纤维母细胞,细胞外基质沉积增加,促进肝纤维化形成[5]。肝细胞表面低表达TLR4 mRNA和蛋白,在LPS刺激下,肝细胞表达TLR4增加,肝细胞通过产生LPS结合蛋白来增强肝非实质细胞对LPS的反应[6]。枯否细胞和肝细胞都是间接刺激肝星状细胞,从而促进肝纤维化。而肝星状细胞是发生肝纤维化的直接细胞、活化肝纤维化的中心环节。目前已经发现[3],LPS是TLR4的外源性配体,通过肝星状细胞TLR4受体活化HSC,促进核转录因子NF-κB活化,下调了星状细胞TGF-β假受体BAMBI的表达,使HSC对TGF-β的刺激更加敏感,而促使纤维化发生。临床上慢性肝病患者常伴随肠道菌群移位,产生肠源性内毒素血症,导致血中LPS增加[7]。我们前期实验[8]发现大黄蛰虫丸可明显减轻大鼠肝纤维化,并降低血清中内毒素水平。LPS与HSC表面TLR4交联活化TLR4通路促进慢性肝病向肝硬化进展,因此阻断LPS与TLR4交联对于控制病情进展或逆转病情有重要作用。
大黄蛰虫丸[9]出自汉代医家张仲景的《金匮要略》:“五劳虚极羸瘦,腹满不能饮食,食伤、忧伤、饮伤、房室伤,经络营卫气伤,内有干血,肌肤甲错,两目黯黑。缓中补虚,大黄蛰虫丸主之。”其药物由熟大黄、土鳖虫(炒)、水蛭(制)、虻虫(去翅足,炒)、蛴螬(炒)、干漆(煅)、桃仁、苦杏仁(炒)、黄芩、地黄、白芍、甘草组成。诸药合用活血祛瘀、益气养阴、清热祛湿、泻下通腑,达到攻补兼施、扶正不留瘀、祛瘀不伤正的作用。大黄蛰虫丸是中国中西医结合学会肝病专业委员会制定的“肝纤维化中西医结合诊疗指南”推荐的防治肝纤维化的中成药。大量的临床研究结果表示[10-11],大黄蛰虫丸联合核苷酸类似物治疗慢性乙型肝炎不仅改善HA 、LN、PCⅢ等纤维化指标,也在改善ALT方面优于单用核苷酸类似物,目前大黄蛰虫丸在临床上广泛应用于肝纤维化的治疗。
本实验研究表明LPS处理组的荧光强度强于正常组,表明肝纤维化模型中LPS与TLR4交联增强;大黄蛰虫丸与LPS共同处理组的荧光强度明显弱于LPS处理组,表明这可能是大黄蛰虫丸能阻断LPS与TLR4的交联。这可能是大黄蛰虫丸抗肝纤维化机制之一。
