祛痰逐瘀方经miR-628/Pten/Runx2调控酒精性股骨头坏死骨稳态代谢机制研究*
2019-03-06洪郭驹魏秋实韩晓蕊何伟陈镇秋
洪郭驹, 魏秋实, 韩晓蕊, 何伟, 陈镇秋△
1 阿尔伯塔大学医学院外科部(加拿大阿尔伯塔省埃德蒙顿T6G 2R3); 2广州中医药大学第一附属医院关节骨科(广东广州 510405); 3广州市第一人民医院(华南理工大学第二附属医院)放射科(广东广州 510180)
酒精性股骨头坏死(alcohol-induced osteonecrosis of femoral head, AIONFH)是由于长期过量饮用含酒精类饮品所导致的骨组织活性降低或者死亡过程。其机制经研究发现,是由于酒精诱导骨髓间充质干细胞(BMSC)成骨能力减弱引起代谢紊乱[1-2]。microRNA(miRNA)是一类内源性非编码小RNA,miRNA通过与靶基因实现特异性结合,从而抑制或激活靶基因的降解或翻译功能,进而对相应的靶基因进行调控。miRNA 参与体内BMSC的增殖、分化和凋亡过程,决定股骨头坏死疾病发展走向[3-5]。选择特定的通过药物介导miRNA调控骨代谢作用,将有利于AIONFH治疗在未来的发展中找到新的突破口。中医药对股骨头坏死具有较为良好的效果,其中以祛痰逐瘀方(QutanZhuyu Decoction, QZD)在临床实践中对防治AIONFH效果明显,目前已广泛运用于中医临床当中,特别针对过度饮酒导致AIONFH的“痰湿血瘀”体质人群,可以降低组织内脂肪含量,提高成骨能力[6]。QZD在对抗骨组织内脂肪增加方面有较大的潜力和效力。鉴于此,本研究通过miRCURY LNATMUniversal RT microRNA PCR Panels检测AIONFH患者血清,并使部分患者服用QZD进而筛查和确定特异性miRNA;同时建立AIONFH大鼠模型,采用RT-qPCR、病理组织学染色、Micro-CT等检验方法,观察QZD经特异性miRNA调控AIONFH成骨分化的机制。
1 材料与方法
1.1 研究对象 研究团队于2017年1—3月间,选取在广州中医药大学第一附属医院保髋病区住院接受保髋治疗的AIONFH患者34例(AIONFH组),男20例,女14例,平均年龄(43±4.2)岁。AIONFH患者且服用QZD保守治疗8例(中药治疗组),男6例,女2例,平均年龄(41.2±5.5)岁。另外有相对健康志愿者34例(相对健康组),男18例,女16例,平均年龄(36.1±7.3)岁。所有纳入对象进行髋部MRI检查及临床体格检查。
1.2 纳入与排除标准 AIONFH患者纳入标准:(1)符合《成人股骨头坏死诊疗标准专家共识(2012年版)》中所列举的股骨头坏死诊断标准;(2)经检查无慢性基础疾病,如糖尿病、心脏病等;(3)既往无髋部受伤导致骨质破坏;无糖皮质激素使用史,排除创伤性和激素性股骨头坏死可能;(4)需具有较为明确的过度、长期饮酒史;(5)未曾长时间服用调节骨代谢药物;(6)20~60岁之间;(7)患者知情同意。排除标准:(1)经检查存在慢性基础疾病;(2)妊娠妇女;(3)20~60岁之间;(4)患者未知情同意。AIONFH且接受QZD患者的纳入与排除标准和AIONFH患者一致,且必须经过1个月QZD综合治疗。相对健康志愿者纳入标准:(1)无经影像学检查确定无股骨头坏死或其他髋关节疾病;(2)无慢性基础疾病;无传染性疾病;(3)年龄20~60岁;(4)志愿者知情同意。
1.3 采用的实验动物模型 本研究采用SD大鼠共24只。性别:雄性;级别:SPF级。体重230~250 g,由广东省医学实验动物中心提供,合格编号为SCXK(粤)2014-0035;所有动物实验在广州中医药大学动物实验中心执行,编号为SCXK(粤)2013-0001,并进行标准饲养,标准鼠粮适应性饲养,室温(23±2)℃,自由饮水,间隔光照12 h,并保持定期消毒、通风,各组大鼠按照单笼培养原则执行。
1.4 临床和动物伦理审查 本研究符合《赫尔辛基宣言》,并经开展临床研究所在单位的伦理委员会批准。每位患者在纳入研究前均签署知情同意书。所有原始数据来自广州中医药大学第一附属医院关节骨科数据库系统V1.0(登记号:2017SR274625)。动物实验经过广州中医药大学动物伦理委员会批准(No. TCM4834332)
1.5 试剂与仪器 1%甲苯胺蓝染色液(武汉赛维尔生物科技有限公司,中国)、抗酒石酸酸性磷酸酶试剂盒(北京百奥莱博科技有限公司,中国);PCR试剂盒(ROCHE公司,美国);PCR引物(生工生物工程(上海)有限公司,中国);TP1020自动脱水机(Leica Biosystems公司,美国)、Autos全自动染色机(Leica公司,德国);Leica RMZ126RT转轮式石蜡切片机;EG1150H全自动石蜡包埋机;BX53显微镜(Olympus公司,日本);μCT100柜式锥形束微型CT(Scanco公司,瑞士);image-pro plus软件(Media Cybernetics公司,美国)。QZD组成:半夏、陈皮、茯苓、甘草、熟地、芍药、当归、川芎,均购自广州中医药大学第一附属医院中药房。
1.6 方法
1.6.1 血清标本收集、RNA提取与质量检测 对纳入研究的AIONFH患者和相对健康组各5例的血清标本进行收集,应用EDTA-K2抗凝管采集静脉血8 mL。3 000 r/min离心10 min,将上层血清分装至离心管中。应用The miRCURYTM RNA Isolation Kit血浆miRNA抽提试剂,抽提总miRNA。随后运用紫外吸收测定法进行浓度检测。
1.6.2 PCR芯片检测与分析 根据Exiqon公司提供的miRCURY LNATMUniversal RT microRNA PCR Panels标准操作流程进行cDNA 合成和实时定量PCR,利用配套软件ExiqonGenEx qPCR analysis software 对纳入研究的AIONFH患者与相对健康组的miRNA进行差异分析,统计分析采用t检验,且取P<0.05,以及差异的倍数>2或<0.5为差异有统计学意义。
1.6.3 生物信息学分析 随后通过对所获得的差异miRNA进行GO 显著性功能分析,对差异miRNA对应的靶基因进行KEGG Pathway 显著性分析;根据数据库Microcosm(http://www.ebi.ac.uk/enright-srv/microcosm/htdocs/targets/v5/)、Miranda(http://www.microrna.org/microrna/home.do.)、Mirdb(http://mirdb.org/miRDB/)联合分析,及参照文献检索研究得到差异miRNA与破骨分化和成骨分化相关的靶基因,构建和预测miRNA调控网络。
1.6.4 RT-qPCR检测 用于人体血清、动物血清和骨组织中定量检测miR-628,以及动物骨组织内定量检测Pten和Runx2,以β-actin为内参。在人体试验中,收集各组受试对象血清。在动物试验中,收集各组腹主动脉血并分离血清,以及股骨头骨组织。采用TRIZOL对RNA进行提取,并进行cDNA的合成。具体的操作按照TaqMan MicroRNA Reverse Transcription Kit(ABI)和 TaqMan MicroRNA Assays(ABI)所提供的指导手册进行。RT-qPCR的反应条件如下:50℃ 2 min,95℃ 预变性2 min,设置的循环参数为95℃ 15 s,60℃ 60 s,总循环次数为40次。其中,每个加入的样品共设置3个复孔,并按上述流程在PCR仪上进行相应的扩增反应。采用ΔΔCt法进行相对定量分析。
1.6.5 动物实验设计 随机对照实验,于2017年8—10月在广州中医药大学动物实验中心及广州中医药大学岭南医学中心国家重点学科中医骨伤科学实验室完成。SD大鼠24只,共分为3组,正常对照组(正常组)、酒精组(模型组)、酒精+QZD组(实验组)。
1.6.6 AIONFH造模、干预、取材方法 所有SD大鼠参照Okazaki等[7]灌胃法,予食用白酒(乙醇体积分数为56%)8 mL/(kg·d),每天进食后灌胃1次,连续灌胃6周。随机抽取2只,行HE染色观察骨陷窝变化。各组适应性喂养7 d后进入实验期12周。腹部注射QZD按照人的临床等量剂量换算。正常组注射与QZD等体积生理盐水。干预实验结束后,吸入麻醉各组SD大鼠,抽取腹主动脉血液直至死亡,经外侧切口取出双侧股骨头,左侧于4%多聚甲醛保存,用于Micro CT检测和病理组织学检测,右侧股骨头和分离后血清于-80℃超低温冰箱储存,用于RT-qPCR检测。
1.6.7 Micro CT检测 本实验采用Scanco公司生产的μCT100型号锥形束Micro-CT。设备参数如下,采用5 μm焦点直径射线;使用探测器:3072×400;采用分辨率:1.25 μm, 4 μm;采用图像矩阵:511×511到8193×8193。采用Scan scale:100 mm×140 mm(ØXl)。取材方法:将AIONFH模型大鼠、实验组及正常组经尾静脉用注射器空气注射并处死,从大鼠两侧臀肌延外侧切开,剪开关节囊,全部暴露股骨头,取用咬骨嵌从股骨颈处咬下,取出左侧整个股骨头和转子部。对取下的标本给予4%多聚甲醛,固定两周,期间定时更换固定液。扫描时,将股骨近段纵轴与Micro-CT检查床的移动方向平行。将Micro-CT的获得图像经校准后股骨头区域建立感兴趣区(ROI),感兴趣区是完整股骨头区域。所采用的检测参数包括:组织体积(TV)、骨质体积(BV)、骨小梁数量(Tb.N)、骨小梁厚度(Tb.Th)、骨小梁分离度(Tb.Sp)。
1.6.8 病理学染色检查 对取下的左侧股骨剔除其周围组织肌肉,用组织剪刀剪下股骨头,并循冠状面切开,用10%甲醛溶液固定48 h,放置在10%EDTA-Tris中进行脱钙,定期更换脱钙液,确定完全脱钙,用清水冲洗,并用乙醇进行逐级脱水,二甲苯透明处理2 h,石蜡作包埋和切片处理,厚度保持4 μm,采用HE染色,染色完毕后在光镜下,观察股骨头骨髓腔中的骨细胞和骨小梁形态等;1%甲苯胺蓝染色,观察各组骨组织内成骨细胞形态及数量变化;Trap染色,观察各组骨组织内破骨细胞形态及数量变化。

2 结果
2.1 miRNA的表达谱分析与验证 芯片结果提示,与5例相对健康组相比,5例AIONFH组血清检测的miRNAs中表达差异高达2倍或低至1/5。其中10个miRNAs表达均增高,20个miRNAs表达均降低,miR-628在AIONFH组中表达下调了8倍。选取并抽取另外21例AIONFH患者和21例相对健康组的血清标本,应用RT-qPCR对miR-628验证了其表达,结果与芯片表达谱基本一致(P<0.01)(图1-A)。
2.2 QZD干预人体血清miR-628表达 AIONFH组与相对健康组相比miR-628表达量降低,结果与表达谱分析和验证结果一致。中药治疗组miR-628表达量高于AIONFH组,与相对健康组之间无差别(图1-B)。
2.3 miR-628生物信息学分析 通过数据库GO分析对miR-628的靶基因进行预测,在生物过程中miR-628的靶基因主要参与了细胞过程和生物调控过程。通过KEGG pathway数据库分析,可发现miR-628的下游靶基因主要富集于多个通路共15个,分别是细胞通讯、信号传导的细胞外机制与受体相互作用等,包括MAPK、TGF信号传导通路等。经检索获得与之相关的靶基因共有20个(P<0.05),并结合文献报告,确认Pten和Runx2与“成骨”和“破骨”效应相关联。
2.4 AIONFH造模过程事件分析与miR-628血清检测 SD大鼠24只。16只用于建立AIONFH模型的大鼠中有1只在服用酒精不明原因后48 h死亡,15只存活,存活率为95%,补足原计划数量。模型组共有8只出现不同程度AIONFH坏死征象,坏死发生率为100%(8/8),实验组共有7只出现坏死,坏死发生率为96%(7/8)。各组SD大鼠经抽取和分离血清,并进行RT-qPCR检测,结果提示AIONFH模型组血清miR-628表达降低,实验组较模型组升高,与人体血清表达趋势基本一致(P<0.05)(图1-C)。
2.5 大鼠标本HE染色检测 模型组:空骨陷窝率增多,出现核固缩,核偏移。底倍镜下骨小梁稀疏变细,出现骨髓细胞碎片,细胞数目及网状结构较正常稀疏。正常组:骨小梁完整,骨小梁中的骨细胞清晰可见。骨小梁形态较好。(图2)。
2.6 大鼠标本甲苯胺蓝染色和Trap染色检测 同等干预条件下,各组骨组织接受经甲苯胺蓝染色、Trap染色。QZD干预后形成的成骨细胞密度均显著高于模型组,结果提示QZD能显著增强坏死骨组织的成骨化能力。与模型组相比,QZD对破骨细胞分化有抑制作用,可显著降低细胞Trap活性。见图2。
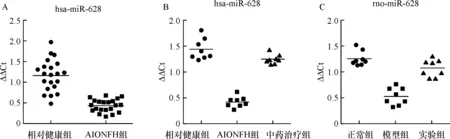
A:相对健康组和AIONFH组中血清的miR-628的表达情况;B:中药治疗组与相对健康组和AIONFH组进行血清miR-628表达比较;C:正常组、模型组、实验组大鼠血清中miR-628表达比较
图1 miR-628在人和动物血清中的表达情况

图2 大鼠模型组织病理学检测
2.7 Micro-CT检测AIONFH模型骨微结构 Micro-CT结果提示,模型组的BV/TV、Tb.N、Tb.Th值要比正常组降低,但Tb.sp值比正常组升高(P<0.05)。相反的,实验组的BV/TV、Tb.N、Tb.Th值比模型组更高(P<0.05),但Tb.sp值无明显差异(P>0.05)(表1)。在Micro-CT的图像中可见模型组出现骨小梁结构紊乱,骨小梁呈断裂,且股骨头内骨质较少;实验组与模型组比较,其股骨头内骨质与骨量均有改善,说明QZD增加AIONFH大鼠模型的坏死修复,促进微观骨性结构改善(图3)。
2.8 QZD调控动物模型骨组织miR-628和靶基因表达 miR-628在模型组内的表达低于正常组,而实验组高于正常组(P<0.05);Pten在模型组内的表达水平较正常组低,实验组较正常组高(P<0.05);Runx2在模型组内的表达水平较正常组低,实验组较正常组高(P<0.05)。见表2。
3 讨论
AIONFH是好发于嗜酒人群的骨科难治性疾病,也是股骨头坏死最常见类型之一[8]。由于我国是“酒文化”大国,因此合并AIONFH的病例也日益增多[9]。由于疾病的预后往往不佳,AIONFH严重影响着中青年(30~50岁)患者的工作学习和生活质量,成为社会和经济负担。目前,现代医学AIONFH缺乏有效的早期诊断方法和针对性的治疗手段。现代中医理论认为,AIONFH属于股骨头坏死中的“痰瘀”证型[10]。从生化角度看,“痰瘀”证型具体表现为“骨形成”减弱,“骨吸收”增强的病理机制。

组别BT/TV(%)TB.Th(mm)Tb.Sp(mm)Tb/N(mm)正常组12.31±0.5300.084±0.0060.35±0.0202.43±0.190模型组4.25±1.050∗0.021±0.007∗0.42±0.040∗1.56±0.320∗实验组8.16±0.120#0.054±0.004#0.41±0.030#1.19±0.130
*与正常组比较P<0.05;#与模型组比较P<0.05

组别rno-miR-628Runx2Pten正常组1.73±0.035.67±0.714.31±0.87模型组0.54±0.04∗2.21±0.31∗1.13±0.31∗实验组0.89±0.06#3.86±0.19#3.51±0.11#
*与正常组比较P<0.05;与模型组比较#P<0.05
以QZD为代表的“祛痰逐瘀法”经验证能够抑制骨细胞死亡,改善紊乱的骨小梁关系,或对修复AIONFH坏死组织有着优秀的骨稳态再平衡能力[11]。随着对AIONFH精准治疗的需求越来越受到临床关注,如何明确QZD调控骨稳态背后的分子靶向调控,确切落实中药复方的精确、准时、个体化,成为了目前QZD治疗包括AIONFH的关键所在。
本研究发现,以mRNA为主的转录组编码的不稳定,导致了AIONFH的复杂多样性,miR-628是其中差异性较大的一个。这为药物靶向干预提供了契机,而成为调控骨稳态的关键所在。在已有研究中,已揭示了miRNA和药物敏感性、有效性密切关系。miRNA是一类内源性非编码小RNA,能够通过与靶基因mRNA特异性结合而导致靶基因mRNA降解或翻译抑制,从而对基因进行转录后调控[12]。miRNA参与成骨细胞的增殖、分化和凋亡过程,同样在包括AIONFH疾病的发生过程中发挥重要的调控作用[13-15]。本研究表明,QZD通过介导AIONFH中的miR-628的转录后调控,最终促成靶向基因的表达与效用蛋白的活化,进而再平衡破骨能力和成骨能力,这也是AIONFH转录后调控骨稳态的基本骨架。
本研究提示,QZD可调控骨组织Runx2的表达变化。Runx2是调控成骨效应最关键的因子之一[16]。研究发现,BMSCs成骨分化可受到高浓度酒精的干预而减弱,并最终促成成脂分化的进一步加强。其内在机制与PI3K/Akt/mTOR信号转导通路激活有关。该通路激活可造成骨特异性转录因子Runx2表达下调,并激活p70S6K进而提高PPAR表达,造成成脂分化的增加[17]。将QZD干预下的Runx2的表达与病理组织变化相结合,可提示QZD对改善AIONFH骨稳态,促进成骨效应的巨大作用。
本研究结果同时提示,QZD可降低AIONFH骨组织中Pten的表达,进而抑制破骨细胞的增加。Pten脂质磷酸酶的活性对介导细胞的分化与凋亡发挥极为关键性的作用[18-19]。其生物机制或包括有以下情况:脂质磷酸酶在G1期内促成了细胞周期的快速阻滞,另外多种刺激诱导下促进了细胞的凋亡。研究发现,Pten可使PIP3处于较低水平,可阻断PI3K的AKT通路,进而诱导细胞凋亡及细胞周期的阻滞。抑制PTEN活性导致Akt磷酸化水平增加和细胞增殖增强[20]。另外,Pten过度表达可抑制RANKL激活的Akt和破骨细胞分化,以及骨桥蛋白所激活的细胞迁移[21]。
综上所述,本研究从人体实验和动物模型两个层面观察QZD对AIONFH的防治作用,筛选AIONFH中特异性表达miR-628,明确了QZD在人体血清中对miR-628表达的作用,以及在动物模型中对miR-628以及成骨和破骨相关基因Runx2和Pten的表达,验证QZD经miR-628/Runx2/Pten通路对成骨、破骨功能进行调控,为临床防治AIONFH 的合理用药提供实验依据。
