解脲脲原体感染对精子膜蛋白DCXR表达和精子凋亡的影响*
2019-03-06岳应权马晓萍高晓勤
岳应权, 马晓萍, 高晓勤
遵义医药高等专科学校组织胚胎学教研室(贵州遵义 563006)
解脲脲原体(ureaplasma urealyticum, Uu) 是人类泌尿生殖道感染的常见病原体[1],研究表明,Uu 吸附于精子,可影响精子穿透卵细胞的能力和干扰精子与卵细胞受精并导致不育[2-3]。研究证实, 人肾脏的双羰基/ L-木酮糖还原酶(dicarbonyl/L-xylulose reductase, DCXR)与附睾精子蛋白P34H是同一个蛋白[4]。精子DCXR(即P34H)是由附睾上皮分泌并定位于精子顶体部位的精子表面蛋白,精子在通过附睾时获得DCXR这种蛋白质,在人类精子与卵子的相互作用非常重要,且DCXR蛋白表达下降与男性不育有关[5];DCXR的检测可以作为诊断男性不育症的一项重要指标[6]。本研究为探讨Uu感染对精子DCXR蛋白的表达量和精子凋亡的影响,以阐明 Uu感染引起男性不育的机制,为临床诊断和治疗男性不育以提供基础理论和实验依据。
1 资料与方法
1.1 一般资料 选择2015 年7 月至2016 年11 月贵州医科大学第一附属医院门诊就诊男性不育症患者145例。年龄23~42岁,均为婚后1年以上不育(经妇科检查排除女方不孕因素),无外伤、遗传性疾病家族史及性功能障碍病史,生殖系统无器质性病变,精浆及血清抗精子抗体阴性,精液细菌培养阴性,血清衣原体抗体阴性。本研究经医院伦理学委员会批准,且患者知情同意。
1.2 主要试剂 Percoll分离液(美国Pharmacia公司);DCXR小鼠单克隆抗体(美国Abcam公司);Alexa Fluor®594标记山羊抗小鼠IgG(北京中山金桥生物技术有限公司);DAPI染色液(美国Abcam公司);Uu 培养鉴定试剂盒(珠海迪尔公司); TUNEL细胞凋亡检测试剂盒(武汉博士德公司);精子细胞BWW培养液(美国Toscience公司);RIPA裂解液和BCA蛋白浓度测定试剂盒(武汉博士德生物有限公司);PVDF膜和ECL化学发光试剂盒(Amersham Bioscience 公司)
1.3 实验方法
1.3.1 精液采集与分析 无菌采集精液,待完全液化后,进行精液常规检查(辅助精子分析仪型号: CASASQH-Ⅲ型),检测分析精液常规各项指标(精子浓度、精子活力、精子形态等)。严格按试剂盒操作说明书进行,对精液进行Uu 培养鉴定及药敏试验,根据精液Uu培养结果将不育患者分为Uu阳性不育组与Uu阴性不育组。采用Uu 敏感的抗生素对Uu 阳性者进行治疗,停药6周后待Uu 培养转为阴性后再次检测精液质量。
1.3.2 Western blot检测精子DCXR蛋白表达 精液标本采用密度梯度法离心分离出成熟精子。收集精子并悬浮洗涤2次,显微镜下调整精子浓度为2.0×107·mL-1。加入RIPA裂解液提取细胞蛋白,BCA蛋白浓度测定试剂盒测定蛋白浓度,提取蛋白50 μg经12%SDS-PAGE 电泳分离后, 转至PVDF膜, TBS封闭后加小鼠单克隆抗体DCXR(1∶1 000 稀释),4℃缓慢振荡过夜 ; 次日加 HRP 标记的酶标二抗(1∶10 000 稀释),洗膜后ECL显影,凝胶成像系统扫描。蛋白的相对表达量用目标蛋白积分吸光度与内参蛋白β-actin吸光度比值表示。
1.3.3 免疫荧光检测DCXR蛋白在精子的定位 多聚赖氨酸载玻片上滴加获能后的精子悬液并室温干燥,4%多聚甲醛固定,血清封闭液进行封闭。加入小鼠单克隆抗体DCXR(1∶400 稀释),4℃过夜。洗涤后加Alexa Fluor®594标记山羊抗小鼠IgG(1∶100稀释)室温孵育。DAPI染色孵育后PBS 漂洗后封片。用激光共聚焦显微镜观察并照相,分别随机选取多个视野摄片,计数精子DCXR标记阳性率,每组计数200个精子。
1.3.4 精子DNA链完整性的检测(TUNEL法) 严格按试剂盒操作说明书进行TUNEL细胞凋亡检测。4%多聚甲醛室温下固定精液涂片, PBS洗涤并用3% H2O2于室温处理;滴入稀释的ProteinaseK于标本片, TBS洗涤。标本片加脱氧核糖核苷酸末端转移酶(TdT)和地高辛标记的脱氧核苷酸(DIG-dUTP)的标记液标记,DAB显色后光镜镜检。在上述实验步骤中,标本片不加TdT酶的作为阴性对照组。精子凋亡为精子头部呈棕黄色染色为阳性。计算精子凋亡率,计数精子200个以上。
2 结果
2.1 Uu阳性不育组与Uu阴性不育组的精液常规检测结果 145例不育组中,精液Uu培养结果阳性47例,阳性率32.41%。Uu阳性不育组与Uu阴性不育组精液分析结果见表1。对Uu 阳性者给予Uu 敏感的抗生素治疗,停药6周后,Uu 培养阴性后再次进行精液常规检测。治疗后Uu阳性不育组的精子密度、精子活动率和精子正常形态率均明显高于Uu阳性不育组治疗前(P<0.05)。
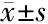

组别例数精子密度(×106·mL-1)精子活动率(%)精子正常形态率(%)Uu阴性不育组9885.14±11.2656.58±6.3128.63±4.05Uu 阳性不育组(治疗前)4764.32±8.15∗31.12±4.94∗13.36±3.87∗Uu 阳性不育组(治疗后)72.78±9.29#42.49±6.29#23.68±5.75#
*与Uu阴性不育组比较P<0.05;#与Uu 阳性不育组(治疗前)比较P<0.05
2.2 Uu阳性不育组与Uu阴性不育组的精子DCXR蛋白的表达 结果显示各不育组中精子多数存在DCXR蛋白的表达,Uu阳性不育组精子DCXR/β-actin 平均光密度均低于Uu阴性不育组(P<0.05)。见图1、表2,对Uu 阳性者进行Uu 敏感的抗生素治疗,治疗后Uu阳性不育组的DCXR/β-actin 平均光密度明显高于Uu阳性不育组治疗前(P<0.05)。

A:Uu阴性不育组; B: Uu阳性不育组(治疗前); C: Uu 阳性不育组(治疗后)
图1 Western blot检测DCXR蛋白在精子的表达
2.3 Uu阳性不育组与Uu阴性不育组的精子DCXR蛋白定位 Uu阳性不育组中多数精子顶体
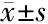
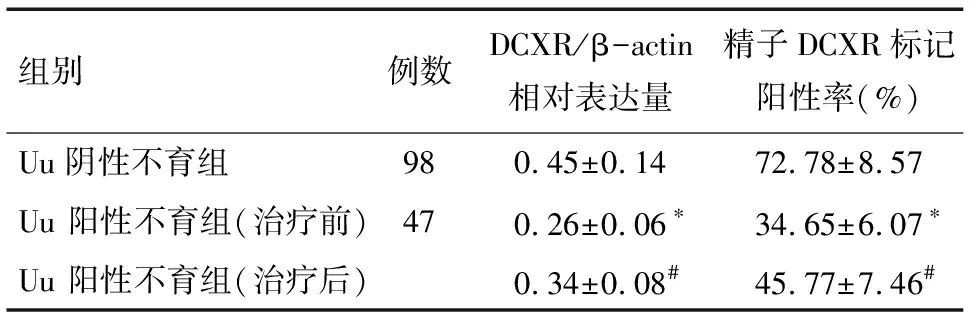
组别例数DCXR/β-actin相对表达量精子DCXR标记阳性率(%)Uu阴性不育组980.45±0.1472.78±8.57Uu 阳性不育组(治疗前)470.26±0.06∗34.65±6.07∗Uu 阳性不育组(治疗后)0.34±0.08#45.77±7.46#
*与Uu阴性不育组比较P<0.05;#与Uu 阳性不育组(治疗前)比较P<0.05
处DCXR表达不均匀,荧光强度较弱,荧光阴性的精子数较多,见图2、表2,对Uu 阳性者进行Uu 敏感的抗生素治疗,治疗后Uu阳性不育组的精子DCXR阳性率明显高于Uu阳性不育组治疗前,差异有统计学意义(P<0.05)。

A:Uu阴性不育组; B: Uu阳性不育组(治疗前); C: Uu 阳性不育组(治疗后);箭头示P34H蛋白在精子顶体的阳性表达
2.4 Uu阳性不育组与Uu阴性不育组的精子凋亡率 结果显示Uu阳性不育组的精子凋亡率高于Uu阴性不育组(P<0.05),见图3、表3,对Uu 阳性者进行Uu 敏感的抗生素治疗,治疗后Uu阳性不育组的精子凋亡率明显低于Uu阳性不育组治疗前,差异有统计学意义(P<0.05)。

A:Uu阴性不育组; B: Uu阳性不育组(治疗前); C: Uu 阳性不育组(治疗后)
2.5 精子DCXR蛋白表达量和精子DCXR阳性率与精子凋亡率的相关性 相关性分析提示精子DCXR蛋白表达量与精子凋亡率存在负相关性(r=-0.427,P<0.01);精子DCXR阳性率与精子凋亡率存在负相关性(r=-0.562;P<0.01)。
3 讨论
Uu是引起男性泌尿生殖道感染的常见病原体,常寄居于泌尿生殖道,引起非淋菌性尿道炎、慢性前列腺炎、附睾炎等,导致男性不育[7]。精子在附睾内达到功能成熟从而获得受精能力,并依赖附睾合成和分泌的蛋白产生作用[8]。研究报道,DCXR可作为一种“兼职蛋白”在人附睾组织中发挥其酶活性和蛋白结合特性,DCXR既可作为精子在附睾达到成熟的标志物[5],同时还具有L-木酮糖还原酶和双羰基还原酶活性,可杀灭附睾液中的细菌[9]。研究表明DCXR还可表达在附睾上皮细胞的细胞核内,具有清除附睾液及精浆中的某些对精子造成损伤的有毒物质的作用[9]。本研究对UU阳性不育者给予敏感抗生素治疗,并对治疗前后的精子蛋白DCXR表达和精子凋亡率进行检测分析,探讨Uu 感染对精子蛋白DCXR表达和精子凋亡率的影响。
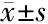

组别例数精子凋亡阳性率(%)Uu阴性不育组986.72±1.36Uu 阳性不育组(治疗前)4717.13±2.3∗Uu 阳性不育组(治疗后)8.98±1.45#
*与Uu阴性不育组比较P<0.05;#与Uu 阳性不育组(治疗前)比较P<0.05
本研究结果显示Uu阳性不育组的精子DCXR蛋白表达量明显低于与Uu阴性不育组,对Uu 阳性者进行Uu 敏感的抗生素治疗,治疗后Uu阳性不育组的精子DCXR蛋白表达量明显高于治疗前Uu阳性不育组。通过免疫荧光方法清晰显示DCXR定位于人精子顶体帽区,Uu阳性不育组的DCXR蛋白在精子顶体处的荧光强度和阳性率大幅减弱。进行Uu 敏感的抗生素治疗后,Uu阳性不育组部分精子DCXR阳性率升高。从结果可知,Uu 感染阳性不育者经治疗后其精子DCXR蛋白表达量和精子DCXR阳性率均较治疗前升高。研究已证实Uu 感染可广泛引起睾丸病理损伤并影响睾丸功能,干扰精子发生过程[10]。我们推测Uu 感染可能会引起附睾功能紊乱并导致DCXR蛋白表达减少和精子DCXR阳性率的下降从而引起不育患者生育能力低下;在对 Uu感染不育患者运用抗感染治疗后,精子DCXR蛋白表达有明显的升高。
Uu感染可造成生精细胞从曲精小管严重脱落,生精细胞结构破坏,还可引起生殖系统中吞噬细胞增多,产生一系列氧自由基与过氧化产物,诱导生精细胞凋亡[11-12]。本研究结果显示Uu阳性不育组的精子凋亡率高于与Uu阴性不育组,经过Uu 敏感的抗生素治疗后,Uu阳性不育组的精子凋亡率明显低于治疗前。说明Uu代谢产物和一系列氧自由基对精子具有毒害作用,可诱导精子发生凋亡,在对 Uu感染不育患者运用抗感染治疗后,精子凋亡率有明显的降低。
同时,本研究结果还显示精子DCXR蛋白表达量和精子DCXR阳性率分别与精子凋亡率呈负相关性,结果说明精子DCXR蛋白的表达可能还发挥了其双羰基还原酶的活性,能够清除Uu感染后精浆中的某些毒性物质, 对精子起一定的保护作用,促进精子的成熟并减少精子凋亡率。
从结果可知,Uu感染可引起附睾功能紊乱导致精子蛋白DCXR表达量降低,Uu 还可通过其代谢产物和氧自由基诱导精子发生凋亡导致精子凋亡率增高,从而引起男性不育;同时,精子DCXR蛋白的表达还可能具有清除UU感染后精浆中的某些毒性物质, 对精子起保护和减少精子凋亡率的作用。Uu阳性不育者通过敏感抗生素治疗后,可拮抗Uu 对精子结构的损伤,减少精子蛋白DCXR的缺失和精子凋亡的发生,促使精子蛋白DCXR含量上升和降低精子凋亡率。本研究表明,Uu 感染引起精子DCXR蛋白的表达量减少和精子凋亡率的增高,可能Uu 感染造成男性不育的重要原因之一。检测精子DCXR蛋白表达和精子凋亡率为男性不育症的诊断和药物疗效的判断提供有效的实验依据。
