多发性骨髓瘤的诊断和治疗进展
2019-03-06陈文萃综述王庆文审校
陈文萃 李 婷 综述 王庆文 审校
多发性骨髓瘤(MM)约占血液系统恶性肿瘤的10%,是血液系统第2位常见的肿瘤[1]。中老年人多发,至今尚不能治愈,该病呈现治疗-缓解-复发-治疗-再缓解-再复发的过程。随着检测技术的进步,新的诊断标准及预后影响因素逐渐提出,为患者的预后判断及危险分层提供了新的依据。另一方面,新药的不断开发应用,治疗理念及手段的更新,根据患者危险分层选择不同的治疗方案,改善了MM患者的预后。本文将对MM的诊断及治疗进展进行综述。
诊断及预后分层进展
诊断标准更新最初诊断MM主要根据临床表现及细胞组织等形态学检查。随着检测方法进步,免疫组化、流式细胞检查、细胞遗传学及基因学方法逐步应用于MM的诊断。2014年,国际骨髓瘤工作组(IMWG)提出的新诊断标准中,将一部分无靶器官损害表现,但符合符合一项或多项“SLiM”(骨髓单克隆浆细胞比例≥60%;受累/非受累血游离轻链比值≥100;核磁共振检查出现>1处局灶性骨质破坏)指标的患者诊断为有症状MM。SLiM纳入的3个生物学指标,每出现一项,患者进展至症状性终末器官损害的风险大约增加80%[2]。
检测内容更新对于临床怀疑MM的患者,中国多发性骨髓瘤诊治指南(中国MM指南)[3]建议血清M蛋白为必检项目,不分泌型MM患者(约2%)可检测血清游离轻链(FLC)用于病情评估,但要求受累FLC水平应该≥100 mg/L,并存在FLC比值异常(<0.26或>1.65)[3-4]。有条件的单位应在确诊时进行骨髓荧光原位杂交(FISH)检测,检测位点包括三倍体、免疫球蛋白重链(IgH)重排、1q21扩增、17p-(p53缺失)、13q-(13q缺失)等。对于FISH检测到IgH重排的患者,还需进一步检测染色体易位(11;14)、t(4;14)、t(14;16)、t(6;14)和t(14;20)等[5]。
预后分期系统与危险分层的更新细胞分子遗传学和基因组学特点能够反映肿瘤的细胞生物学特征,为判断疾病进展和预后提供重要信息。2013年,梅奥诊所研究组建立了基于细胞分子遗传学的梅奥骨髓瘤分层及风险调适治疗(mSMART)预后分层标准(表1),提出根据细胞遗传学特点进行危险分层及个体化治疗[6]。不同危险分层中位生存期差别较大[7]。2015年IMWG结合11个国家的3 060例患者的汇总分析了染色体异常及血清乳酸脱氢酶升高对MM预后的影响,提出了修订的国际分期系统(Revised International Staging System,R-ISS)(表2)[8]。该研究中位随访46个月,R-ISS Ⅰ 期、Ⅱ 期及 Ⅲ 期患者5年总体生存率(overall survival,OS)与5年无进展生存率(progession free survival,PFS)分别为82%、62%、40%及55%、36%、24%[8]。

表1 基于细胞遗传学特点的mSMART危险分层标准[6-7]
t:易位;Gain:扩增;del:缺失

表2 修订的国际分期体系(R-ISS)[8]
LDH:乳酸脱氢酶;t:易位;del:缺失
治疗模式进展
治疗模式更新
初治MM患者 初治MM患者应考虑患者是否适合自体造血干细胞移植(ASCT)及危险分层来选择治疗方案(图1)[1]。
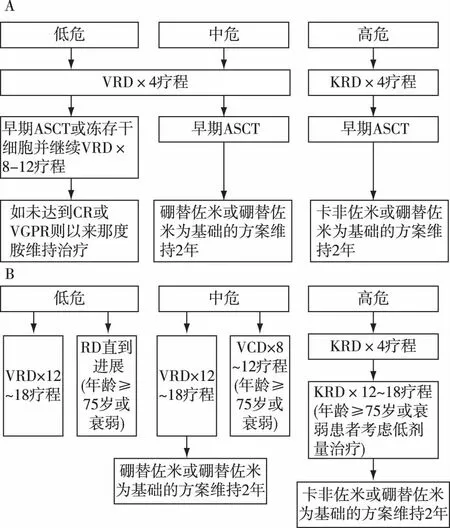
图1 适合ASCT(图A)和不适合ASCT(图B)多发性骨髓瘤患者的初治流程[1]A:适合自体造血干细胞移植(ASCT);B:不适合ASCT;VRD:硼替佐米/来那度胺/地塞米松;KRD:卡非佐米/来那度胺/地塞米松;RD:来那度胺/小剂量地塞米松;VCD:硼替佐米/环磷酰胺/小剂量地塞米松;CR:完全缓解;VGPR:非常好的部分缓解
适宜ASCT的患者 ASCT可作为一线方案,或者首次复发的挽救治疗。双次ASCT是否优于单次ASCT目前仍存在争议,可能对17p-的患者有价值。在采集干细胞前,患者需要接受3~4个疗程的诱导化疗。常用以蛋白酶体抑制剂为基础方案,如硼替佐米/来那度胺/地塞米松(VRD)、硼替佐米/环磷酰胺/地塞米松(VCD)、硼替佐米/沙利度胺/地塞米松(VTD)等。卡非佐米联合来那度胺/地塞米松(KRD)方案对初治MM有良好疗效[9]。对存在高风险细胞遗传学改变的年轻患者,可以尝试采用KRD方案作为初治方案。多药联合化疗方案,如VTD/顺铂/阿霉素/环磷酰胺/依托泊苷对快速进展型疾病有效,可作为浆细胞白血病和多发髓外浆细胞瘤患者的初治方案。
不适宜ASCT的患者 部分初治患者由于高龄或其他并发症不适合行ASCT,其初治方案与适合行ASCT的患者基本一致。以马法兰为基础的化疗方案存在干细胞损伤、继发骨髓增生异常综合征和白血病的风险,不作为首选方案。环磷酰胺的不良反应少于马法兰,且不会降低疗效,VCD可作为硼替佐米/马法兰/泼尼松的替代方案。来那度胺/地塞米松(RD)方案疗效及耐受性较好,服药方便,适合老年患者。VRD较RD方案治疗能够取得更大的生存获益,可作为硼替佐米和来那度胺为基础的治疗方案的优选方案。
异基因造血干细胞移植(allo-HSCT) allo-HSCT在MM的应用存在争议。虽然接受allo-HSCT有望治愈MM,但移植相关死亡率 (10%~20%)和移植物抗宿主病的发生率高,这些并发症在非清髓患者也非常常见,限制了其临床应用[10]。年轻、期望获得长期生存的高危患者,可以尝试接受allo-HSCT。
移植后的维持治疗 ASCT后是否需要进行维持治疗,以及维持治疗的方案和时间尚未达成共识。维持治疗可提高OS,也可能增加血液学毒副作用及二次肿瘤发生的风险[11-13]。维持治疗能够提高微小残留病变(minimal residual disease,MRD)阴性患者的比例,以检测MRD指导维持治疗时机可能是未来的发展方向。
复发/难治性MM(RRMM)的治疗 几乎所有的MM患者最终都会复发,RRMM治疗方案的选择受多种因素影响,包括一线方案和疗程、缓解深度、时间和毒副作用及复发的进展速度等;但目前RRMM的治疗时间仍存在争议。RRMM的治疗流程见图2[1],其中部分新药,国内尚未上市。
中国MM指南[3]建议:6个月内复发的患者可换用其他作用机制药物联合方案;6~12个月复发的患者,首选其他作用机制药物联合方案,也可用原方案继续治疗;12个月以上复发的患者,可用原方案再诱导治疗,也可换用其他作用机制的药物方案。未行ASCT或者ASCT后曾达到较长时间缓解的患者,可在第一次复发时采用ASCT挽救治疗。对初始方案疗效差、毒副作用明显的患者,其方案中应包含一种既往未使用过的药物。惰性复发或者一般情况差的患者,可采用2种药物联合的方案;临床复发或者生化复发快速进展的患者可选择3种或以上药物联合的方案。
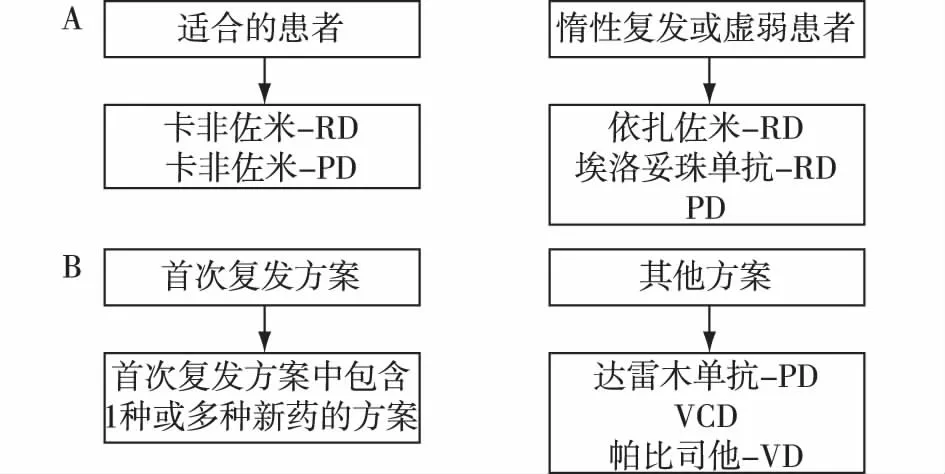
图2 首次复发(A)和两次或多次复发(B)患者的治疗流程[1]既斑未接受自体造血干细胞移植(ASCT)的患者,如果条件允许,可选择ASCT作为挽救治疗;如果首次ASCT治疗后接受维持治疗缓解>36个月或未接受维持治疗缓解>18个月,条件允许,可考虑二次ASCT;RD:来那度胺/小剂量地塞米松;PD:泊马度胺/小剂量地塞米松;ASCT:自体造血干细胞移植;VCD:硼替佐米/环磷酰胺/地塞米松;VD:硼替佐米/地塞米松
新药临床研究进展
近5年来,部分新药经美国食品及药品监督管理局(FDA)批准应用于治疗RRMM。
新型蛋白酶体抑制剂卡非佐米(Carfilzomib)及首个口服的蛋白酶体抑制剂依扎佐米(Ixazomib),二者均作用于蛋白酶体20S亚基,对硼替佐米抵抗的细胞系均有效,且外周神经毒性更小,但卡非佐米治疗时少数患者可能发生严重的心脏不良反应,而依扎佐米的消化道反应更大。
卡非佐米单药治疗既往经硼替佐米及来那度胺治疗的RRMM患者总体反应率(ORR)为23.7%,中位PFS、反应时间及OS分别为3.7、7.8及15.6月[14]。ASPIRE研究对比了KRD与RD方案,结果显示KRD方案ORR、PFS均显著高于RD方案,24月的OS分别为73.3%及65.0%,不良反应无明显差异[15]。ENDEAVOR研究显示卡非佐米/地塞米松的ORR及PFS均高于硼替佐米/地塞米松(VD)方案[16]。
Ⅰ期研究显示,依扎佐米治疗RRMM患者达到部分缓解以上的反应率为15%~18%[17-18]。TOURMALINE-MM1研究中RD联合依扎佐米治疗RRMM的PFS、ORR、中位反应时间及中位疾病进展时间均显著优于RD联合安慰剂组,两组间的严重不良反应发生率无显著差异[19]。其他新型蛋白酶体抑制剂如Marizomib和Oprozomib目前正在进行临床试验,尚未批准应用于临床。
新型免疫调节剂泊马度胺(Pomalidomide)是第三代的免疫调节剂(IMiDs),FDA于2013年批准用于RRMM。对来那度胺、硼替佐米抵抗的患者,泊马度胺治疗反应率为30%,且与小剂量地塞米松联合应用效果优于单药治疗[20-21]。泊马度胺/小剂量地塞米松治疗RRMM的ORR为47%~63%,中位PFS为4.8~11.6月,中位OS在13.9月及以上[20,22]。不同剂量泊马度胺(1d~21d/28dvs1d~28d/28d)联合地塞米松治疗RRMM,2组间的ORR、中位反应时间、中位PFS、OS及不良反应等并无显著差别[23]。泊马度胺治疗的3级及以上不良反应主要为骨髓抑制及感染,并且深静脉血栓风险增加[24]。
组蛋白去乙酰化酶(HDAC)抑制剂组蛋白乙酰化与去乙酰化主要参与基因表达的调节,高乙酰化的染色质转录活化,低乙酰化的染色质转录静止。改变染色质的乙酰化状态导致癌基因及肿瘤抑制基因表达变化,从而影响肿瘤的发生。帕比司他(Panobinostat)为口服的HDAC抑制剂。临床前研究显示帕比司他与硼替佐米联用有协同作用,增强抗骨髓瘤细胞的效应[25]。PANORAMA 1试验中,帕比司他/硼替佐米/地塞米松(Pan-VD)(n=245)或安慰剂/VD(n=240)治疗的中位PFS分别为12月及8.1月,Pan-VD组ORR高于VD组。因不良反应导致治疗中断的发生率分别为36%及20%[26]。PANORAMA 2试验中,治疗55例难治性MM(中位接受4种方案治疗),ORR为34.5%,中位PFS为5.4月[25]。2015年2月FDA批准Pan-VD方案用于既往至少经2种标准方案治疗的患者。
单克隆抗体达雷木单抗(Daratumumab,Dara)为抗CD38的单克隆抗体。Dara单药治疗既往经3种及以上方案治疗,95%的患者对蛋白酶体抑制剂及IMiDs耐药的RRMM,ORR为29.2%,中位PFS为3.7月,1年的总体生存率为64.8%[27]。而对于既往接受治疗方案中位数为5种,86.5%的患者为双重耐药的RRMM的综合分析显示,Dara 16 mg/kg治疗的ORR为31.1%,中位反应时间为7.6月,中位PFS为4.0月,OS为20.1月[28]。Dara联合来那度胺治疗RRMM的ORR为88%,主要不良反应为中性粒细胞减少(发生率81%)[29]。而16 mg/kg组反应优于8 mg/kg组,且无剂量限制性毒性报道[30]。2015年11月FDA批准达雷木单抗用于既往经3种以上方案治疗的RRMM[31]。
埃罗妥珠单抗(Elotuzumab,Elo)是抗CS1(CD2的亚单位,为信号淋巴细胞活化分子家族成员)的单克隆抗体。临床前研究显示,Elo能与蛋白酶体抑制剂及免疫调节剂产生协同抗MM作用。Elo治疗的输注不良反应发生率高达71%~89%,抗过敏药物能减少输注不良反应[32-33]。Elo /硼替佐米及Elo /来那度胺/地塞米松(ERD)治疗RRMM的ORR分别为48%及82%[32-33]。而不同剂量的Elo(10 mg/kg组vs20mg/kg组)治疗研究显示,ORR为84%(92%vs76%)[34]。ELOQUENT 2研究显示ERD组及RD组ORR有显著差异,分别为79%及66%[35]。2015年11月,ERD方案被FDA批准用于治疗RRMM。
小结:MM是一种克隆性恶性浆细胞病,临床表现多样。随着研究的深入,MM的诊断标准进行了更新,部分冒烟型骨髓病患者治疗提前,预后分层体系更加完善,尤其是分子生物学及遗传学检测方法应用于临床,为疾病的诊断、疾病进展、治疗的选择与治疗反应、预后判断均提供了帮助。2012年至今共有6种新药经FDA批准用于治疗RRMM,为临床治疗提供了更有力的手段,改善了患者预后。此外,大量的新药处于Ⅰ/Ⅱ期临床研究中。但就目前的诊治手段,MM仍难以治愈,早期诊断、准确全面的评估病情、及时有效的治疗有助于提高患者的长期生存,改善生活质量。
