肾癌患者单侧根治性肾切除术后肾功能的变化
2019-03-06吴晓静张暮寅徐丽梨王伟铭
李 欣 吴晓静 张暮寅 徐丽梨 郝 旭 李 灏 王伟铭
肾细胞癌(RCC)是起源于肾实质泌尿上皮的恶性肿瘤,占肾脏原发恶性肿瘤的80%~90%。对于局限性RCC(T1-2N0M0),仍首选外科手术治疗,包括根治性肾切除术与肾部分切除术。对于肿瘤体积较大,或不可行保留肾单位的肾部分切除术的患者,根治性肾切除术是目前最常采用的标准术式[1]。术中大量肾单位的丢失使得术后极易出现急性肾损伤(AKI)。虽经健侧肾脏代偿大部分患者肾功能可得到逐步恢复,但其远期慢性肾脏病(CKD)发病率仍显著高于一般人群。术前充分评估患者个体差异,选择合适的手术方式尽可能保存肾单位,对于降低远期CKD发生率,减少CKD相关并发症并改善患者生活质量十分必要。本研究通过回顾性分析单侧根治性肾癌术后患者的临床资料及长期随访结果,评估围手术期AKI及远期CKD发生情况,探讨此类患者术后发生不良肾脏事件的危险因素,为临床决策提供依据。
对象和方法
研究对象选取2013年1月至2018年1月上海交通大学医学院附属瑞金医院泌尿外科行单侧根治性肾切除术的85例肾癌患者。排除标准:年龄<18岁或>80岁,双肾或孤立肾肿瘤,肾肿瘤复发或转移,伴随其他恶性肿瘤,严重肾功能不全[eGFR<15 ml/(min·1.73m2)]或其他脏器功能衰竭,随访时间<3月及重要资料不全。
资料收集
临床病理资料 一般资料[年龄、性别、体质量指数(BMI)]、实验室数据[99mTc-DTPA肾动态显像测定肾小球滤过率(GFR)、血清肌酐(术前、术后48h内及出院前一日)、血尿酸、血清白蛋白、术前及术后血红蛋白]、合并症、肿瘤情况(病理类型、侧别及大小)、手术方式(开放性/腹腔镜)、输血及围手术期并发症。
随访资料 术后不同随访时间点的肌酐及eGFR变化情况。
肾功能评估及分组根据术前及术后48h内肾功能评估患者术后是否发生AKI,根据出院前一日肾功能将AKI的患者分为肾功能恢复组与未恢复组,AKI诊断标准及分期参考KDIGO临床实践指南[2],肾功能恢复定义为出院时血清肌酐下降至低于基线水平1.5倍[3]。
根据末次随访时肾功能估算eGFR,将术前肾功能正常[eGFR≥60 ml/(min·1.73m2)]患者分为CKD组与非CKD组。eGFR计算公式采用简化MDRD公式[4],CKD诊断标准及分期参考K/DOQI指南[5]。
统计学方法采用SPSS 22.0软件进行数据处理。正态分布的计量资料用均数±标准差表示,组间比较采用两独立样本t检验及方差分析;非正态分布的计量资料用中位数(四分位间距)表示,组间比较采用非参数检验;计数资料用频数和率表示,组间比较采用χ2检验;采用Kaplan-Meier生存曲线分析肾癌术后远期CKD的发生率,多元危险因素分析采用Logistic回归。P<0.05为差异有统计学意义。
结 果
患者情况85例肾癌患者,男女比例1.58,平均年龄56.4±10.9(28~78)岁,随访3个月以上,中位随访时间18(7~26)月。
总体肾功能变化85例患者术前平均eGFR 82.5±16.7 ml/(min·1.73m2),其中26例(30.6%)eGFR≥90 ml/(min·1.73m2),52例(61.2%)eGFR 60~90 ml/(min·1.73m2),7例(8.2%) eGFR<60 ml/(min·1.73m2)。术后48h时,总体平均eGFR急剧降至51.6±12.3 ml/(min·1.73m2),与术前存在显著差异(P<0.001);术后3月,总体平均eGFR逐步回升至60.0±15.7 ml/(min·1.73m2),与术后48h存在显著差异(P<0.001);术后随访6月、12月、18月、24月、36月,总体平均eGFR相对稳定,各随访点eGFR无统计学差异。术前不同eGFR患者eGFR呈现类似变化趋势(图1)。

图1 术前不同估算的肾小球滤过率(eGFR)水平患者随访期间变化情况
术后AKI情况47/(55.3%)患者术后发生AKI,AKI 1期43例(91.5%),AKI 2期4例(8.5%),无AKI 3期,术前不同eGFR组患者AKI发生率无统计学差异(P=0.719)。
AKI患者中26例(55.3%)出院时肾功能恢复,21例(44.7%)肾功能未恢复。术前不同eGFR患者肾功能恢复情况存在统计学差异(P=0.028),eGFR<60 ml/(min·1.73m2)组肾功能恢复比例最低(表1)。
表1术前eGFR不同分组患者AKI发生及恢复情况[n(%)]

分组[ml/(min·1.73m2)]患者人数术后AKIAKI恢复eGFR≥9026(30.6)16(61.5)13(81.3)60≤eGFR<9052(61.2)27(51.9)12(44.4)eGFR<607(8.2)4(57.1)1(25.0)
eGFR:估算的肾小球滤过率;AKI:急性肾损伤
根据术后是否发生AKI将全体患者分为AKI组与非AKI组,单因素分析发现,两组患者在性别、合并糖尿病、合并高尿酸血症、健侧GFR、肿瘤最大径方面有统计学差异(表2)。多元Logistic回归分析提示健侧GFR水平较低(OR=0.892,P=0.018)与合并糖尿病(OR=7.856,P=0.038)是导致根治性肾切除术后发生AKI的独立危险因素(表3)。
CKD发生情况78例患者术前eGFR≥60 ml/(min·1.73m2),截止末次随访,36例(46.1%)进展为CKD。其中术前eGFR≥90 ml/(min·1.73m2)5例(19.2%)进展为CKD,术前eGFR 60~90 ml/(min·1.73m2)31例(59.6%)进展为CKD。使用Kaplan-Meier生存曲线比较术后远期进展为CKD的发生率,组间具有统计学差异(图2)。根据生存曲线估算总体患者1年、3年及5年的累积CKD发生率分别为38.9%、50.8%及57.0%。

图2 术前不同eGFR水平患者随访期间发生CKD的Kaplan-Meier生存曲线eGFR:估算的肾小球滤过率;CKD:慢性肾脏病
根据末次随访时是否进展为CKD将78例患者分为CKD组与非CKD组,单因素分析发现,两组患者在年龄、健侧GFR、术前eGFR、术后eGFR、术前eGFR分组方面有统计学差异(表4),多元Logistic回归分析提示术前eGFR偏低(OR=0.794,P=0.005)是导致根治性肾切除术后进展为CKD的独立危险因素(表5) 。

表2 根治性肾切除术后发生AKI的单因素分析
Hb:血红蛋白;GFR:肾小球滤过率;AKI:急性肾损伤

表3 根治性肾切除术后发生AKI的多元Logistic回归分析
AKI:急性肾损伤;GFR:肾小球滤过率
讨 论
根治性肾切除术是RCC患者术后AKI及发生远期CKD的独立危险因素,这一观点近年来已得到国内外大多数学者的广泛认同。与部分肾切除术相比,根治性肾切除术增加术后AKI风险约1.2~10.4倍,增加远期CKD或ESRD风险1.3~25.8倍[6]。
本研究中,超过半数患者(55.3%)于根治性肾切除术后出现AKI。AKI的发生与手术造成肾单位突然大量丢失而残余的健侧肾脏未来得及充分代偿有关,之后健侧肾脏的残余肾单位逐步出现功能性代偿,包括肾单位代偿性肥大,肾脏体积增加,GFR增加,肾功能缓慢恢复,典型患者的eGFR水平会呈现术后快速下降(急性期)、短期内逐步恢复(恢复期)和后期相对稳定(稳定期)三个阶段。动物实验显示健侧肾脏代偿期持续2~4周[7-8],而临床上由于患者个体差异及众多影响肾功能恢复的因素,部分患者会出现 AKI延迟恢复或不恢复,尤其是基础肾功能较差、健侧肾脏代偿能力不佳者,此外,年龄、男性、高血压或糖尿病等合并症、高BMI及开放性手术也可能造成术后AKI或AKI持续状态[9-11]。本研究发现,健侧肾功能低下与合并糖尿病是患者根治性肾切除术后发生AKI的独立危险因素。健侧肾脏功能低下或原有肾脏基础病变不仅造成术后即刻GFR下降,并且由于不能够充分代偿缺失肾单位使得残余肾小球处于超滤过高负荷状态,加剧肾单位减少,为日后进展为CKD埋下隐患。糖尿病患者本身较常合并血管病变,且肾小球常处于高滤过高灌注高压力状态,eGFR易被高估,代偿能力减低,故围手术期及远期肾脏并发症均高于一般人群。
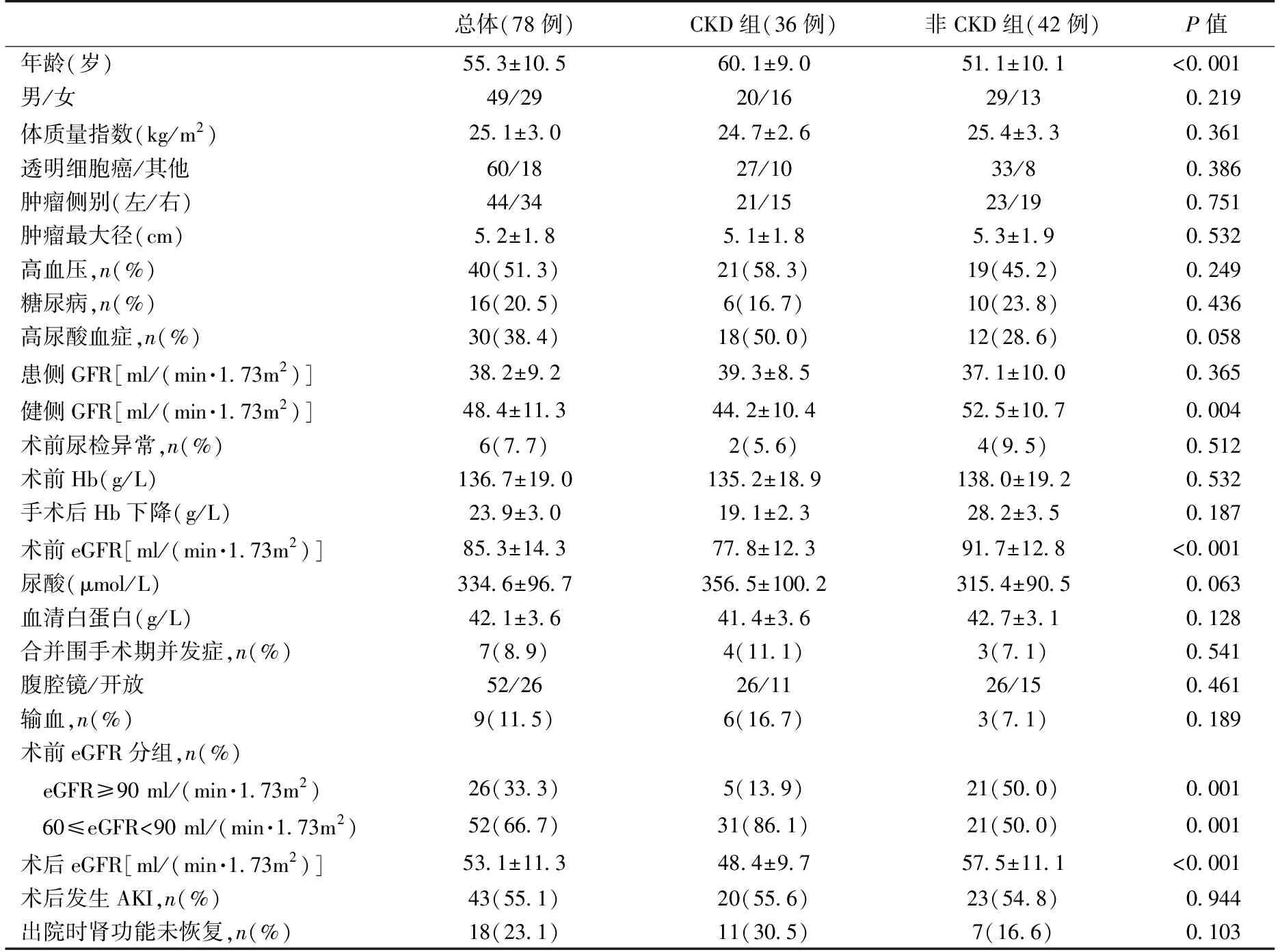
表4 根治性肾切除术后进展为CKD的单因素分析
CKD:慢性肾脏病;GFR:肾小球滤过率;Hb:血红蛋白;AKI:急性肾损伤
表5根治性肾切除术后进展为CKD的多元Logistic回归分析

项 目ORP值95%CI年龄1.0570.2430.963~1.160健侧GFR0.9620.4210.876~1.057术前eGFR0.7940.0050.676~0.931术前eGFR分组0.2000.3560.007~6.083术后eGFR0.9550.4410.851~1.073
CKD:慢性肾脏病;GFR:肾小球滤过率
近年来,早期肾癌患者的预后明显改善,患者寿命的延长必然带来对术后远期肾脏功能的关注。尽管肾切除术后残余肾单位具备一定的代偿能力,大部分患者能够从术后AKI阶段得到恢复,但绝大多数不能恢复到术前水平。随着年龄增加,GFR每年以一定速率下降,术后因功能代偿导致的高滤过高灌注状态又进一步加重肾脏负担并加速肾单位丢失,再加上患者因年龄特点常伴随某些易造成肾损伤的合并症(如高血压、糖尿病及高尿酸血症等),根治性肾切除术患者术后远期CKD的发病率很高。文献统计,术后3~5年的CKD发生率至少在30%~50%[6,12-13],大多发生在术后1年内[14]。本研究应用Kaplan-Meier生存曲线估计根治性肾切除术后1年、3年及5年累积CKD发生率分别为38.9%、50.8%及57.0%,与文献报道相近。实际上,仅将血清肌酐或依据血清肌酐估算的eGFR作为随访过程中是否发生CKD的评判标准并不准确,临床中发现早在血清肌酐升高或eGFR下降之前患者已存在尿蛋白排泄率异常及GFR减低,故根治性肾切除术后CKD实际发生率可能远高于现有数据。既往研究显示高龄、术前GFR低下、糖尿病等合并症、肿瘤大小、手术方式、术后AKI或AKI延迟恢复等因素均可能与远期CKD高发有关[6,12-13,15-17]。在本研究中,患者术前eGFR水平低下是远期CKD发生的独立危险因素,与既往文献报道相符,而AKI及AKI延迟恢复未达到显著性差异,推测可能与本研究样本量较小及不同研究之间采用AKI诊断标准存在差异有关。此外,26%~44%的肾癌患者术前已存在不同程度的CKD[18],即使患者术前肾功能正常,既往隐匿性肾脏基础疾病包括蛋白尿也与术后CKD进展有关。Lucas等[19]分析242例T1a肾癌患者后发现,术前CKD高风险患者与对照组相比,无论是根治性肾切除(82%vs38%,P<0.001)还是保留肾单位的手术(22%vs14%,P=0.01),术后发生CKD或CKD进展的风险均显著增高。本研究中合并术前尿蛋白的患者比例较低,且未能达到显著差异,这是由于更为精细的检测手段如尿微量白蛋白/肌酐等并非外科手术科室术前常规检查项目,而随机尿及单纯血清肌酐检测对CKD患者漏检率较高造成。
本研究的局限性在于:单中心研究样本量偏小,随访时间相对较短;此外,由于术前筛查手段单一,且未对术后肾切除标本中癌旁组织进一步行病理分析,可能漏诊部分术前即存在基础肾脏疾病的患者,在今后的研究设计中应当加以改进。
综上所述,根治性肾切除术后AKI与远期CKD发病率均较高,需引起临床重视。选择手术方式时,应根据患者个体差异并充分评估手术获益与肾脏不良事件风险,对高危人群在条件允许时应尽量选择保留肾单位术式如部分肾切除或射频消融以保存患者肾脏功能,同时加强术后监测及定期随访,及早对潜在的CKD患者进行预警和干预,减少远期CKD进展。
