尿毒症脑病磁共振诊断研究进展
2019-03-06孙迎香马雪英综述麻少辉审校
孙迎香 张 明 马雪英 综述 麻少辉 审校
尿毒症脑病(uremic encephalopathy,UE)是指各种原因引起肾脏病尿毒症期所出现的神经精神异常,亦称为肾性脑病。该病由Richard Bright于1831年首次描述,因严重影响患者的生活质量,明显提高患者死亡率,引起临床广泛关注。目前UE诊断主要依赖临床症状及体征的判别,血生化指标及影像检查加以协助,缺乏对疾病客观认识和国际统一的诊断标准。UE的临床表现复杂多样,包括头痛、运动障碍,重者出现谵妄、昏迷甚至出现癫痫样发作等,缺乏特异性,为诊断带来一定困难。多数UE在及时治疗后脑损伤可逆转,因此,早期诊断对患者预后有重要意义。
目前临床诊断过程中,影像学检查仅用于对大脑异常征象的描述及排除诊断,包括脑萎缩、低密度病灶或长T1、长T2异常信号,缺乏深入归类及相应发病机制的分析,对临床诊治的指导力度不够。磁共振(magnetic resonance imaging,MRI)检查作为一种无创、高空间分辨率及组织对比度的影像检查手段,可用于对UE的异常征象的归类与分析,不仅辅助临床诊断及判断脑损伤的严重程度,还可指导下一步临床诊疗。同时,随着磁共振高级成像技术的发展,在未出现症状之前发现脑损伤,对早期诊断并开展预防干预具有不可替代的作用。本文拟对UE磁共振诊断及磁共振新技术对UE早期脑改变研究进展进行综述。
分类及诊断
根据累及部位不同,UE可分为4类:(1)累及皮质及皮质下区;(2)累及基底节区;(3)累及脑白质区域;(4)累及上述两个及以上部位。每一类型不仅有其相应的MRI特征,在发病情况及发病机制上也有不同,可提供相应的临床诊治线索。
皮质及皮质下病变此型多由治疗过程中血压突然升高所致,典型表现为后部可逆性脑病综合征(posterior reversibility encephalopathy syndrome,PRES)[1],患者以头痛、视物模糊、癫痫发作、意识障碍甚至昏迷等高血压症状为主。MRI多表现为单侧或双侧大脑后部(以顶、枕叶为主)长T1长T2信号(图1),也可发生于大脑任何部位,弥散加权成像(diffusion-weighted imaging,DWI)多为等信号,表观弥散系数(apparent diffusion coefficient,ADC)值一般以升高为主,提示血管源性水肿。值得注意的是,部分无血压升高的患者中也会出现类似症状及MRI表现[2]。

图1 后部可逆性脑白质病综合征男性,59岁,慢性肾脏病5期,突发癫痫入院;T2 FLAIR示:双侧颞、枕、额叶皮层及皮层下区稍高信号
关于PRES存在两种假说[3],其一为高灌注假说,血压突然升高,超过脑血管自主调节阈值,引起血压调节异常,脑小动脉被动扩张,大脑呈现高灌注状态,外渗的液体于细胞外间隙蓄积,尤以相对松懈的白质区域为著,且后循环脑血管交感神经支配少于前循环,从而发生大脑后部血管源性脑水肿。另一种为低灌注假说,由内皮细胞功能障碍引起血管强烈收缩,缺氧引起毛细血管通透性增加造成局部水肿,并可发生于任何脑区,多见于分水岭,该假说可解释在无高血压患者中出现PRES的原因。
尿毒症患者普遍存在诱发PRES的危险因素:高血压、内皮细胞功能障碍等,当出现急性意识障碍并伴血压波动或存在内皮功能障碍等高危因素时,均应考虑PRES。PRES并非完全可逆,延误治疗可能会造成细胞不可逆变性死亡,因此及时通过MRI诊断并进行降压及强化透析治疗至关重要[3]。
基底节病变此型多见于糖尿病肾病患者,发病时多合并代谢性酸中毒,临床表现一般为锥体外系运动障碍及意识障碍,可有帕金森样运动或舞蹈征,病情的严重程度常取决于代谢紊乱的程度[4-5]。MRI表现为双侧基底节区对称性T2高信号,典型表现为“餐叉征”(lentiform fork sign,LFS)[6-7],即T2、T2FLAIR出现线性高信号(由外向内分别为外囊、外髓帆、内髓帆)以包绕内囊及豆状核(图2),“餐叉征”的出现是早期诊断的可靠征象之一。DWI及ADC表现为血管源性水肿,部分病例在病灶中心尤其是双侧苍白球会发生不可逆的细胞毒性水肿,并遗留囊性变[8]。
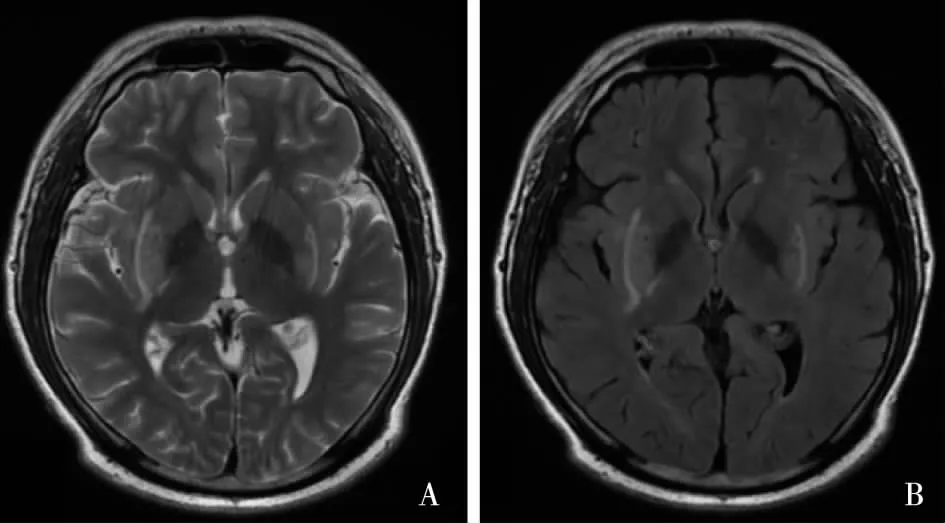
图2 T2(A)T2 FLAIR(B)示:双侧基底节区外囊及右侧内囊后肢对称性线状高信号,呈“餐叉样”男性,28岁,慢性肾脏病5期,表现为反应迟钝,实验室检查提示电解质紊乱
研究认为基底神经节神经元与周围脑白质中星形胶质细胞对代谢损伤的敏感程度不同,导致其在T2WI上出现以LFS为典型征象[9]。代谢损伤以尿毒症毒素长期作用及发生代谢性酸中毒为主[10]。由于糖尿病引起脑血管调节异常、内皮细胞功能障碍,血脑屏障通透性增加,脑细胞间质水分增多,发生脑水肿,同时脑组织缺血缺氧,酸中毒引起pH下降。当低灌流量不能维持脑细胞的最低耗氧量,有氧代谢不能进行,使得脑组织处于无氧代谢,其中以基底节对缺血缺氧及代谢损伤最为敏感,损伤最为显著。
因此,在UE患者出现急性锥体外系运动障碍及意识障碍,并存在糖尿病病史的情况下,应警惕代谢性酸中毒,及时严格控制血糖、强化透析,预防脑损伤发展至不可逆程度,改善患者预后。
脑白质病变此型患者一般无高血压、糖尿病病史,发病年龄轻,临床表现运动障碍及意识障碍等,缺乏特异性。MRI可见累及双侧幕上白质的长T1长T2信号,以累及半卵圆中心为主,DWI高信号,ADC值降低[11-13]。由于其不同于以上两者,由Carlos于2014年提出将其纳入UE影像学分型[11]。此型发病机制并不清楚,DWI提示细胞毒性水肿,可能与长期慢性肾脏病及尿毒症毒素所致细胞损伤、大脑氧耗下降、细胞代谢降低有关,因为细胞处于不可逆损伤边缘,因此早期诊断、及时治疗至关重要。
多个部位病变UE累及多个部位一般出现在病情较为严重,并发症及合并症较多的情况下。文献报道1例同时累及基底节区及脑皮质区,该患者同时伴有高血压、糖尿病,在经过及时强化透析后病情改善[14]。此型发病机制同样不清,往往多种机制并存,且病情较重,预后较差,需谨慎对待[15]。
发病机制研究
慢性肾脏病对大脑的损伤是长期累积的过程,在出现症状之前脑损伤已然存在。在过去十年,研究者通过对肾脏病引起的脑损伤不断研究,提出了“肾脑轴”这一概念。围绕该轴提出两条假说[16-17],即“血管源性假说”及“神经退行性改变假说”。在慢性肾脏病患者中,传统血管疾病的危险因素如:老龄、糖尿病、高血压、高脂血症的发生率均高于正常人,同时高同型半胱氨酸血症、高凝状态、免疫紊乱及氧化应激等非传统性血管疾病危险因素,会加速动脉硬化及血管内皮细胞功能障碍[17]。然而血管因素仅可解释部分患者脑损伤原因,神经退行性改变是另一重要原因。尿毒症毒素的累积导致大脑内皮细胞功能紊乱,并具有神经毒性作用,长期作用引起神经退行性改变,研究发现尿毒症患者脑脊液及大脑中胍类化合物水平(如肌酸)显著增高,这些毒素在大脑的浓度10倍于正常人,但毒素如何影响认知功能尚未知[18]。
通过磁共振高级成像技术,从结构、功能、代谢等角度阐述疾病的发病机制,已被广泛应用。因此,我们推测在早期UE中,磁共振高级成像技术在发现早期脑损伤、研究损伤机制及疗效评估具有潜在应用价值。
磁共振弥散张量成像(diffusion tensor imaging,DTI) DTI是一种通过磁共振检测脑组织内水分子的扩散程度及扩散方向,进而无损地评估脑白质纤维束的完整性及连续性,定量评估其受损程度的成像技术。通过基于体素的DTI研究证实尿毒症患者存在无症状的白质纤维损伤,包括FA值减低,AD、MD、RD值相应升高,提示与轴索变性及髓鞘脱失有关[19]。弥散张量纤维束成像(Diffusion Tensor Tractographies,DTTs)是利用弥散张量数据,三维直观显示白质纤维束的成像方法。通过DTTs发现,UE患者均存在皮质脊髓束、穹窿、上下纵束及下额枕束中至少一处白质结构异常,并进一步影响认知功能[20]。因此,DTI可用于阐明白质损伤的模式及严重程度,探索由白质损伤造起患者认知障碍的机制。
基于体素的形态学分析方法(voxel-based morphometry,VBM) VBM是一种在体素水平测量脑组织体积差异的形态学磁共振方法。使用VBM方法,可精确测量脑灰质及脑白质体积并形成量化指标,早期评估微观结构改变引起的脑萎缩。通过对年轻尿毒症患者脑萎缩程度及认知损伤相关性的VBM研究[21]提示,患者出现广泛大脑灰质及白质体积缩小及不同程度的认知功能损伤,且多个脑区灰质体积缩小与神经心理学评分密切相关。对血液透析及腹膜透析患者全脑VBM研究[22-23]提示,患者存在双侧大脑灰质及基底节核团如尾状核、壳核的萎缩,并与认知功能损伤及透析龄密切相关,随着透析治疗时间的延长,脑萎缩程度越重。VBM方法有助于早期发现患者出现脑萎缩,并评估其程度及范围,监测疾病进程中脑萎缩的进展。
基于血氧水平依赖的功能磁共振成像(blood-oxygen-level dependent functional MRI,BOLD-fMRI) BOLD-fMRI是近些年来神经影像领域研究脑功能异常改变最主要的MRI方法,可反映局部神经元活动并确切定位,包括静息态fMRI及任务态fMRI,因静息态无需特定实验设计,患者易配合,尿毒症患者研究多集中于静息态fMRI,分析方法包括局部一致性(regional homogeneity,ReHo)、低频振荡振幅算法(amplitude of low frequency fluctuations,ALFF)及独立成分分析(independent component analysis,ICA)。研究发现UE患者较对照组存在认知相关脑区ReHo值改变及ALFF值减低[24-26]。另有研究发现UE患者存在全脑多个网络功能连接异常,并与其出现的认知损伤相关,而血红蛋白及血钙浓度与脑网络连接异常密切相关,可能是造成异常的原因[27-28]。因此,静息态fMRI对于揭示尿毒症患者认知损伤的神经病理机制具有应用前景。
磁共振波谱(magnetic resonance spectroscopy,MRS) MRS是一种无创的、可直接测定人体活体组织内代谢物质变化的MRI功能成像方法,其中主要用于脑实质的代谢物峰值有:胆碱(Cho)峰、N-乙酰天门冬氨酸(NAA)峰、肌醇(mI)峰、肌酸(Cr)峰、乳酸(Lac)峰等,这些脑中代谢物变化可反映尿毒症患者轴突或神经元活性变化、细胞膜及细胞能量、状态的信息。研究发现UE患者存在Cho/Cr值、mI/Cr值升高[29-30],Cho峰增高可提示患者存在脱髓鞘改变,mI峰增高则代表患者渗透压改变及胶质细胞增多,且这些代谢物的改变可能与其出现如记忆及学习功能减退等认知功能损伤密切相关[31]。MRS可检测尿毒症患者脑代谢物含量改变及调节异常,可用于研究评估患者脑损伤的影像学标记。
动脉自旋标记法(arterial spin-labeling,ASL) ASL灌注成像是一种无创的定量测量组织血流灌注的MRI成像方法,以动脉血中的水分子作为内源性示踪剂,对脑血流量(cerebral blood flow,CBF)进行测定,无需注射对比剂。利用ASL技术研究尿毒症患者存在弥漫脑区灌注增高,且与血红蛋白水平呈负相关,与认知功能损伤密切相关,提示贫血可能是造成终末期肾病患者出现CBF值增高及认知功能损伤的原因之一[32]。通过ASL可进一步研究患者局部脑灌注异常及其损伤机制。
磁敏感加权成像(susceptibility-weighted imaging,SWI) SWI是一种根据组织间磁敏感不同而形成对比差异的MRI成像技术,对微出血灶的检出优势明显。有研究指出,在尿毒症患者中颅内出血的发病率较同年龄段正常人群高5~10倍[33]。因此,早期发现脑内微出血灶对预防尿毒症患者颅内出血至关重要。同时纵向研究发现,存在脑微出血的尿毒症患者认知功能损伤程度更严重,新发脑微出血灶及其位置可能是患者认知损伤类型差异的原因[34]。应用SWI可早期发现脑内微出血灶,研究由微小血管病变引起认知障碍的机制,并为临床及时干预提供直接证据。
小结:UE患者MRI表现多样,发病机制复杂,临床表现常缺乏特异性。但是通过对MRI表现进行汇总与分类,不仅可为诊断及鉴别诊断提供客观依据,对下一步进行诊疗也具有提示作用,且大部分UE可逆,早期诊断、早期治疗对减少患者脑损伤和提高患者生活质量至关重要。同时,采用磁共振高级成像技术,探索肾脑之间相互作用关系,在早期发现脑损伤并评估其严重程度,探索其危险因素,对于未来减少脑损伤十分重要,成为该领域研究的主要方向之一。
