MDSCs对肺癌小鼠CD8+T细胞及生存期的影响研究
2019-03-06江茂琼贾钰铭江玉兰叶文静
江茂琼,贾钰铭,李 婷,邱 野,江 健,江玉兰,叶文静
四川省宜宾市第二人民医院肿瘤科(宜宾644000)
肺癌发病率呈逐年上升的趋势,每年全球新确诊肺癌患者约160万[1],其病死率位居各恶性肿瘤中首位,虽然近年来肺癌的生存率有所提高,但5年生存率仅为16%左右[2],严重威胁患者的生命安全。肺癌的发病机制尚无明确,相关研究报道[3],机体正常的免疫应答状态与肿瘤的发生发展存在密切联系。在机体抗肿瘤免疫中,CD4+和CD8+T细胞介导的细胞免疫应答发挥主要作用[4]。CD8+T细胞主要通过释放细胞毒性物质如穿孔素、颗粒酶等对肿瘤细胞产生直接杀伤作用,而CD4+T细胞除本身具有直接杀伤肿瘤细胞的作用,同时可通过分泌Th1型细胞因子,从而对CD8+T细胞、NK细胞及巨噬细胞等杀伤肿瘤细胞。骨髓源性抑制细胞(Myeloid-derived suppressorcells,MDSCs)是一群未成熟的异质性骨髓细胞,其主要由树突状细胞、巨噬细胞及粒细胞的祖细胞或前体细胞组成[5]。研究证实[6]在肿瘤微环境下MDSCs水平表达显著上调,具有抑制抗肿瘤免疫的作用,且剔除MDSCs,去除其抑制作用或诱导MDSCs转化为树突状细胞可能在目前治疗肿瘤的相关研究中具有一定现实意义。目前较多关于肺癌小鼠免疫器官MDSCs和CD8+T细胞的比例的研究,而关于MDSCs对肺癌小鼠CD8+T细胞及生存期的影响仍较少,笔者就此展开报道,现总结如下。
材料和方法
1 材 料
1.1 实验动物和细胞:选取6~8周雌性C57BL/6小鼠,共15只,体重18~20 g,购自广东省医学实验动物中心。Lewis肺癌细胞LLC细胞购自上海研生实业有限公司研究所,LLC细胞培养采用DMEM-F12培养基加10%胎牛血清。培养条件:37℃、5% CO2、饱和湿度,间隔3d当细胞达到约90%融合时,采用胰蛋白酶-EDTA(0.25%)消化传代培养。
1.2 主要试剂和仪器:Gr-1删除抗体、PE标记的Gr-1抗体、FITC标记的CD11b抗体、CD3-PE/CY7、CD8-PE。流式细胞仪购自艾森生物(杭州)有限公司。
2 实验方法
2.1 动物实验:消化收集Lewis肺癌细胞LLC细胞,磷酸盐缓冲液(PBS)洗涤后行台盼蓝染色使细胞活力>95%,细胞计数。采用PBS调整浓度至1×107个/ml并混合均匀,而后于雌性C57小鼠背部行皮下接种,每只接种100μl×106个,制作Lewis肺癌模型。选取肿瘤大小符合规定(肿瘤直径约3~6mm)的小鼠12只,采用随机数字表法分为对照组(6只)和观察组(6只)。对照组小鼠尾静脉注射100μg兔IgG,观察组小鼠尾静脉注射Gr-1抗体或对照抗体以删除荷瘤小鼠血液中的MDSC。分别于注射抗体注射后第3天、7天及10天留取血液并行细胞检测。间隔3~4d行肿瘤直径测量,计算公式:v=0.52×a×b×b。同时记录荷瘤小鼠的生存时间。
2.2 流式细胞仪检测:将荷瘤小鼠尾巴在规定的时间减去一小段,留取约20μl血液,红细胞裂解完成后将白细胞浓度调整为1×107/ml,检测MDSCs并用Gr-1-PE和CD11b-FITC标记染色,采用CD8-PE和CD3-PE/CY7对CD8+T细胞进行标记染色,检测仪器为流式细胞仪。数据分析采用FlowJo 7.6软件。

结果
1 皮下肺癌小鼠模型制备 15只小鼠行皮下接种LLC细胞,制作Lewis肺癌模型。8d后腋下开始出现可触及的肿瘤的小鼠共12只,成瘤率达80.00%(12/15)。15 d后小鼠腋下肿瘤明显增大,22d可见小鼠的整个腋窝几乎全为肿瘤,肿瘤体积可达(6512.8±845.985)mm3。
2 荷瘤小鼠外周血中MDSC和CD8+T细胞的变化 注射Gr-1前两组荷瘤小鼠外周血中MDSC和CD8+T细胞比例无统计学差异(P>0.05);注射Gr-1第3天,观察组MDSC比例为(1.58±0.30),显著低于对照组(38.35±3.22),CD8+T细胞比例为(9.47±0.83),显著高于对照组(4.23±0.47);注射Gr-1第10天,MDSC比例为(31.95±3.60),显著低于对照组(63.67±5.77),CD8+T细胞比例为(5.82±0.56),显著高于对照组(2.88±0.34),差异具有统计学意义(P<0.05)。

表1 荷瘤小鼠外周血中MDSC和CD8+T细胞变化
3 C57小鼠荷瘤注射不同抗体后肿瘤生长曲线 如图1所示,在荷瘤小鼠肿瘤生长25d左右,随着抗体的代谢消除,两组肿瘤大小差异无统计学意义(P>0.05)。
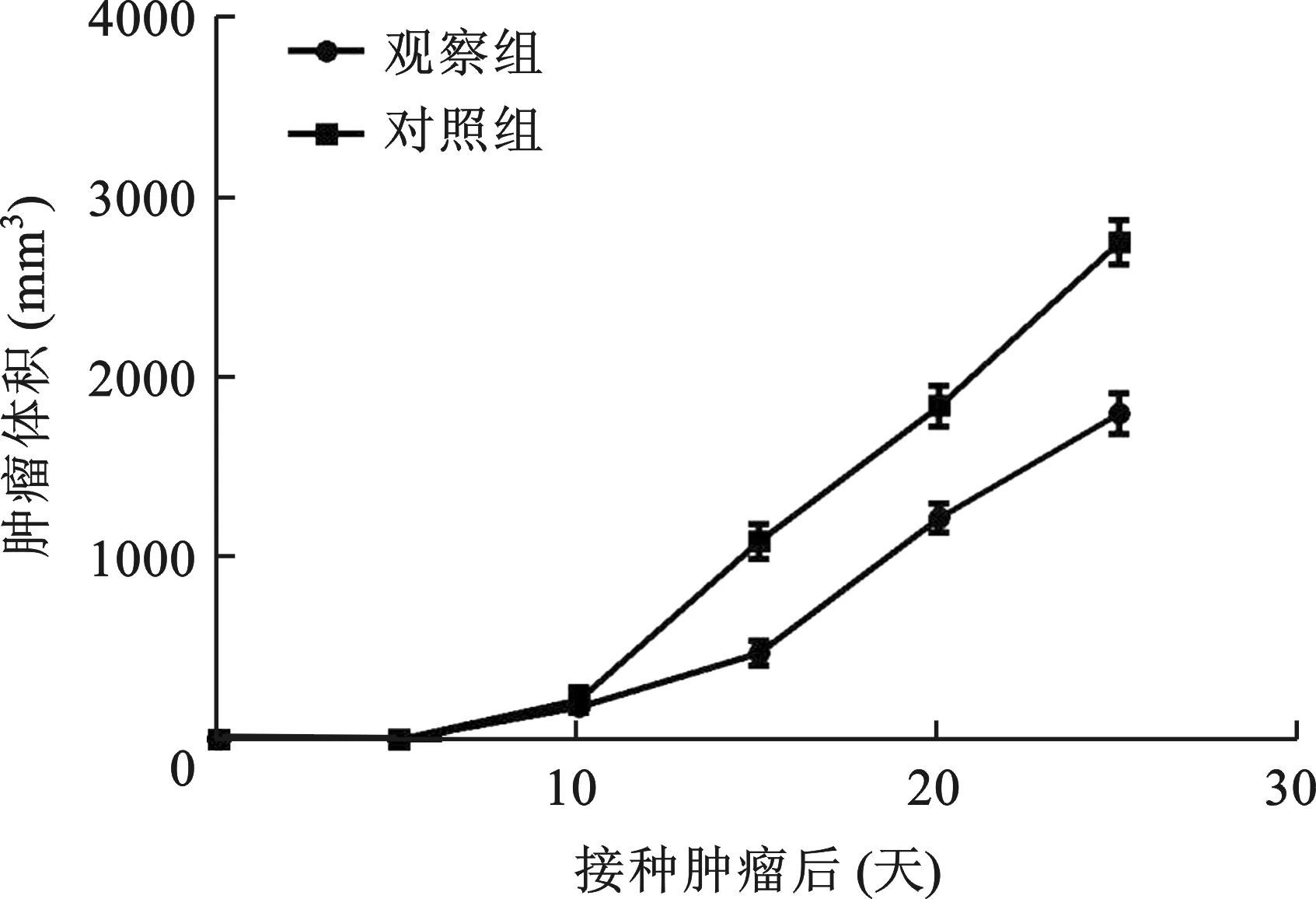
图1 C57小鼠荷瘤注射不同抗体后肿瘤生长曲线
4 C57小鼠荷瘤注射不同抗体后的生存曲线 如图2所示,观察组小鼠生存率显著高于对照组,差异具有统计学意义(P<0.05)。
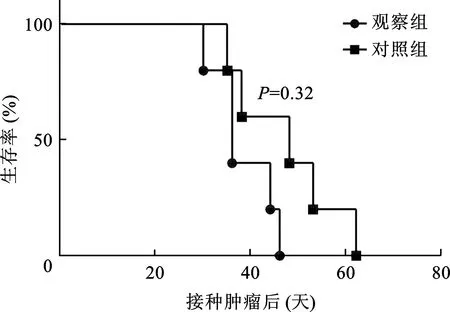
图2 C57小鼠荷瘤注射不同抗体后的生存曲线
讨 论
随着老龄化进程的加快及空气污染的加重,目前肺癌发病人数呈逐年上升的趋势,故目前关于肺癌的发生发展及肿瘤免疫应答方面的研究已成为科研热点。肿瘤患者机体免疫功能与肿瘤的发生及发展密切相关,其中自然杀伤T细胞及MDSCs是两种重要免疫调节细胞亚群[7],自然杀伤T细胞(Natural killer T cells,NKT)表面既表达NK细胞表面的标志物CD56,又表达T细胞的表面标志物TCR-CD3,NKT细胞可识别海绵由CD1-d提呈的脂类抗原,能够在激活状态下产生Th1及Th2细胞进而产生IFN-γ、IL-4等细胞免疫因子,发挥调控细胞免疫及体液免疫的作用,免疫抑制目前是肿瘤免疫应答研究的热点项目,文献显示[8],MDSCs、Treg及INKT细胞是目前与免疫抑制相关的细胞群,而近年来被发现具有强大负调控作用的MDSCs细胞已被证实与肺癌患者疾病发展密切相关,其能抑制抗CD3抗体及多种丝裂原诱导的T细胞增殖,同时抑制同种抗原剂NKT细胞活性,其同时具有固有免疫应答及抑制适应性免疫应答的作用[9]。目前关于肺癌细胞的逃逸机制相关研究表明[10],免疫逃逸不仅与肿瘤抗癌调变、MCH及共刺激因子表达降低有关,此外由肿瘤导致的机体免疫功能降低也是重要相关因素。目前研究显示[11],CD8+T细胞可通过表达死亡受体FasL及释放颗粒酶/穿孔素发挥杀伤肿瘤细胞的功能,而CD4+T细胞可通过分泌IL-12、IL-2及IFN-γ等细胞因子间接诱导自然杀伤细胞、巨噬细胞及细胞毒性细胞对肿瘤细胞的直接杀伤作用。目前研究显示[12],当LLC细胞接种小鼠机体内产生肿瘤细胞的同时,其外周淋巴组织如脾脏、外周淋巴结等可出现CD8+及CD4+T细胞的比例降低,荷瘤小鼠脾脏及淋巴结肿大,导致细胞总数增加,故肿瘤发生发展过程中,抑制机体免疫应答是导致的效应T细胞数量的降低的关键所在。
MDSCs细胞为髓系来源的由未成熟的骨髓细胞、巨噬细胞、树突细胞、单核巨噬细胞及处于低分化期的其他骨髓细胞组成的异质性细胞[13]。目前研究表明[14],肿瘤发生发展过程中产生的如干细胞因子(Stem cell factor,SCF)、粒细胞/巨噬细胞集落刺激因子(Granulocyte / Macrophage colony stimulating factor,GM-CSF)、白细胞介素-6(Interleukin-6,IL-6)等炎性因子均可促进MDSCs的形成,此外还能促进MDSCs扩增迁移至外周血、外周淋巴器官及肿瘤微环境中,抑制NK细胞、巨噬细胞、NK-T细胞、T细胞等多种免疫细胞的抗肿瘤效应。目前文献报道[15],在荷瘤小鼠中,MDSCs特征性表达Gr1+CD11b+。而有研究指出[16],多种动物模型及肿瘤人群中都发现MDSCs具有显著免疫抑制作用,并对肿瘤增长具有促进作用,其主要机制较为复杂。除与肿瘤组织微血管形成有关外,还与T细胞、Treg细胞、B细胞等具有联系,可阻止上述细胞发挥细胞免疫相关功能,并诱导产生利于肿瘤生长的微环境,对肿瘤细胞的增殖迁移产生促进作用。
随着研究的不断深入,有学者指出对于效应T细胞识别及杀伤肿瘤细胞的是宿主抗原提呈细胞,而MDSCs作为树突状细胞及巨噬细胞前体,也具有抗原提呈作用,但与正常抗原提呈细胞启动过程相反,MDSCs主要通过以下机制参与肿瘤抗原的细胞免疫耐受[17]:①正常状态下MDSCs能够表达高水平精氨酸酶,可分解周围环境中T细胞活化必须的精氨酸,影响CD8+及CD4+T细胞的活化过程;②产生一氧化氮合酶及活性氧,导致效应T细胞增殖受阻;③下调T细胞受体相关ζ链,导致效应T细胞活化信号无法传递;④产生膜结合性TGF-β通过直接与T细胞接触的方式抑制其活性;⑤通过下调CD62L分子的表达,使naiveT细胞无法归巢,影响naiveT细胞迁移至肿瘤组织的过程,进而使已经活化的CD8+及CD4+T细胞数量减少。目前较多研究MDSCs在肺癌小鼠中的表达水平,但关于其对CD8+T细胞及荷瘤小鼠生存期方面的研究较少。正常情况下,MDSCs主要存在于小鼠骨髓中,外周淋巴器官含量较少,笔者查阅相关文献,MDSCs在正常小鼠中外周血含量约为7.5%[18],在本次研究中,注射Gr-1前1d时观察组荷瘤小鼠其外周血MDSCs含量为(23.86±1.34),而注射后第3天,MDSCs含量迅速降低,与此同时CD8+含量达到较高水平,随着时间的延长,在注射后第10天,观察组MDSCs含量虽明显低于对照组,但其效果已经大大减弱。就MDSCs水平逐渐回升,我们认为与肿瘤细胞增殖过程中产生的多种细胞因子有关,SCF、GM-CSF、IL-6等均能诱导MDSCs的形成,使原本主要存在于骨髓的MDSCs大量分布于外周血当中。
本研究结果显示,在荷瘤小鼠肿瘤生长25d左右,两组肿瘤大小比较差异无统计学意义,而生存期统计结果显示,观察组小鼠生存期显著高于对照组,差异具有统计学意义,说明注射抗体对于改善生存期意义较大,对肿瘤生产抑制作用较为有限,故我们认为高水平MDSCs能够降低CD8+水平,对生存期有较大影响,随着时间的延长,注射MDSCs抗体无法降低肿瘤生长速度。
